Zein/konjac glucomannan复合颗粒制备的Pickering乳液稳定性研究
2020-07-21董梓炯温晓静蔡吉豪成栢吉钟其建
岳 强,尹 艳,董梓炯,温晓静,蔡吉豪,成栢吉,钟其建
(1.中国检验认证集团 广东有限公司,广东 广州 510623;2.惠州学院 生命科学学院,广东 惠州 516007;3.华南师范大学 生命科学学院,广东 广州 510631)
固体颗粒稳定的乳液称之为Pickering乳液[1].因为固体颗粒一旦吸附到油水界面就很难解吸下来,Pickering乳液被认为是稳定性很高的乳液体系.因为其稳定性很高,没有表面活性剂,还由于其生物相容性高,Pickering乳液的研究成为近十年的研究热点.而用于稳定Pickering乳液的固体颗粒的研究之前都集中在二氧化钛[2]等无机颗粒上.近年来,专注于食品级颗粒乳化剂的研究逐渐增多,如乳清蛋白微凝胶[3]、纤维素纳米晶体[4]、高粱醇溶蛋白[5]和小麦醇溶蛋白[6]等.
玉米醇溶蛋白(zein,Z)具有两亲性,能够自组装成纳米或微米大小的胶体.反溶剂得到的Z胶体颗粒过于疏水,用于稳定Pickering乳液三天就发生了相分离[7].Z与其他物质复配成复合物颗粒是一种有效改善颗粒表面润湿性的方法.Z与单宁酸通过氢键复合的颗粒能够稳定Pickering乳液胶[8].Z与果胶通过相互作用复合的颗粒能够稳定高内相Pickering乳液[9].魔芋葡甘聚糖(konjac glucomannan,K)是一种具有表面活性的天然阴离子多糖,其水溶性好,具有良好的凝胶性和增稠性,K在胃液中难以被消化[10],生物可降解性能高,是一种对环境友好的高分子材料.该文将Z与K复合成复合物颗粒乳化剂,用以稳定食品级的Picker⁃ing乳液,探究其储藏稳定性.
姜黄素在食品工业中常被作为天然色素,具有广泛的食用和医用价值,具有抗氧化性,能够改善心血管功能[11].但姜黄素的结构不稳定,并且在水中溶性差,姜黄素在人体生理条件下不稳定、在肠道中吸收少、在体内代谢迅速,生物利用度低,限制了疏水性活性物质姜黄素在口服药物中的广泛应用,因此构建兼具食用安全和良好性能的输送载体势在必行.近年来通过固体颗粒将荷载姜黄素的液态油包裹的方法极具前景.固体颗粒将液态的分散油滴首尾相连聚集在一起的同时,能够保护液态油脂中荷载的活性物质的化学性质不受外部环境的影响[12].Pickering乳液在荷载疏水性功能活性物质方面较传统乳液更具优势[13],乳液中油水之间颗粒界面层的存在为活性物质提供了良好的物理屏障[14].该文将姜黄素溶解在油相中,研究Z/K复合颗粒稳定的Pickering乳液对活性物质姜黄素的保护作用.
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白,牛胆汁,脂肪酶,胰酶和姜黄素(纯度98%)均购自SIGMA公司.
甲醇,乙腈均为色谱纯.
其他试剂均为分析纯.
玉米油(福临门,中粮佳悦有限公司),购于当地超市.
1.2 仪器与设备
T25高速分散机 德国IKA公司
T10高速分散机 德国IKA公司
旋转蒸发仪 德国IKA公司
C40纳米光度计 德国Implen公司
液相高效色谱仪 美国安捷伦公司
1.3 方法
1.3.1 Z/K复合颗粒的制备
采用反溶剂沉淀法[9]制备Z/K复合颗粒,首先将Z溶于70%(v/v)乙醇溶液,K溶于1%(v/v)冰乙酸溶液,在T25高速分散机搅拌(6000rpm,4min)的条件下,将Z的乙醇溶液逐滴滴入K的冰乙酸溶液中,然后45℃旋转蒸发,得到Z含量2%的Z/K复合颗粒溶液,低温保存.以Z/K质量比=10:1,4:1,2:1,4:3,1:1(w/w)制备一系列的Z/K复合颗粒.
1.3.2 Pickering乳液的制备
以玉米油为内相,分别以Z/K质量比=10:1,4:1,2:1,4:3,1:1(w/w)的Z/K复合颗粒分散体系为连续相,制备Pickering乳液,并标记为Z1,Z2,Z3,Z4,Z5.油水比为 2:8(v/v),两相混合,用 T10高速分散机14400rpm剪切2min,得到Pickering乳液Z1,Z2,Z3,Z4,Z5.
将姜黄素以1.13mg/mL的浓度溶于玉米油,以Z/K质量比=2:1(w/w)的Z/K复合颗粒溶液为连续相,如上所述制备荷载姜黄素的Pickering乳液,标记为zk-cur.
1.3.3 Pickering乳液的储藏稳定性
将Z1,Z2,Z3,Z4,Z5在室温下保存一段时间,并在其储藏0天、储藏1天和储藏110天的时候拍照,通过乳液外观的变化来检测其储藏稳定性.
1.3.4 体外模拟胃肠消化
1.3.4.1 体外模拟胃消化
取zk-cur(包含1 mL荷载姜黄素的玉米油)5 mL溶解到10 mL模拟胃液(包含20 mg NaCl,pH调节为2.0)中,加入10 mL胃蛋白酶溶液(包含96mg胃蛋白酶,用模拟胃液溶解),在37℃水浴恒温摇床中持续震荡1 h,用NaOH将pH值调节为7.0以终止胃消化.
1.3.4.2 体外模拟肠消化与游离脂肪酸的计算
经过体外模拟胃消化后,在体外模拟胃消化液中加入60 mL模拟肠液(包含0.4206 g氯化钠和0.0666 g氯化钙,pH 7.00),40 mL胆盐溶液(包含2.0000 g胆盐),20 mL胰液(包含0.4800 g胰酶)和20 mL脂肪酶溶液(含0.7200 g脂肪酶)消化2小时,记录游离脂肪酸(free fatty acid,FFA)的释放情况[6].
根据式(1)计算模拟消化过程中的游离脂肪酸(FFA,Free Fatty Acid)的释放量.
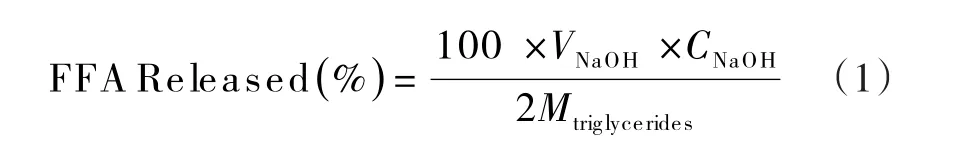
式(1)中,Mtriglycerides为脂肪的平均分子质量(g/mol)
VNaOH为模拟小肠消化时间为t时消耗NaOH溶液的体积(mL)
CNaOH为滴定用标准NaOH溶液的浓度(mol/L)
1.3.4.3 生物利用度的测定与计算
消化液离心30分钟(40000 rpm,4 ℃)[15].收集胶束中间层,用高效液相色谱法[14]评价姜黄素的生物利用度.荷载姜黄素的玉米油(1.13 mg/mL)和Tween 20乳液(2%Tween 20溶液:含姜黄素的玉米油=8:2)为对照.
液相条件:流动相为乙腈:超纯水=55:45(v/v),流速为1 mL/min.
根据式(2)计算模拟消化后姜黄素的生物利用度.
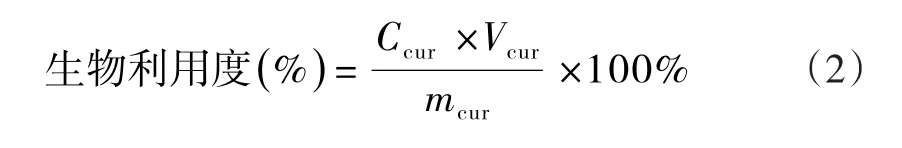
式(2)中,Ccur指离心后上清液中姜黄素浓度;
Vcur指上清液体积;
mcur指纳米颗粒中姜黄素的质量
上述实验数据均重复三次,通过软件Excel 2010进行差异显著性分析.
2 结果与分析
2.1 Pickering乳液的储藏稳定性
乳液的储藏稳定性某种程度上决定了产品最终能否被使用,破乳、漏油、乳析等不稳定状态对于乳液产品来说是不好的.图1展示的是新制、存储1天、存储110天的Z/K复合颗粒稳定的Pickering乳液状态.Z1和Z2(即Z/K=10:1,4:1)在储存一天之后就发生了乳析,并在110天的储存过程中,乳析程度又逐渐加大的趋势,而其他乳液(Z3、Z4、Z5)则状态稳定,甚至到第110天均没有出现破乳、漏油和乳析的状况.说明Z/K复合颗粒在K的含量不够的情况下,是不足以长期有效地稳定Pickering乳液的.该研究中的Z/K复合颗粒溶液的pH值均在3.0左右,Z的等电点大于pH 3.0,Z在颗粒溶液中带正电.在广泛的pH范围内,K表现为弱的负电荷.在剪切力的辅助下,K吸附在Z表面,并通过静电相互作用形成复合物胶体.
2.2 体外模拟胃肠消化
为了探讨Z/K复合颗粒稳定的Pickering乳液在体外模拟胃肠消化过程中的作用,荷载了姜黄素的Z/K复合颗粒稳定的Pickering乳液(zk-cur)、玉米油(oilcur)和Tween 20 稳定的乳液(tween20-cur)加入至模拟胃液和肠液中分别和胃蛋白酶、脂肪酶、胰酶反应.图2记录的是三种体系在模拟肠消化过程中的FFA的释放情况.开始消化后20 min内,FFA释放率以oil-cur、tween20-cur、zk-cur的顺序递增.随着消化时间的持续,三种体系的FFA释放率均逐渐增加,肠消化2小时后 FFA 释放率以 91.56±4.62%(oil-cur)> 55.05±7.09%(zk-cur)> 46.87±5.56%(tween20-cur)的顺序递减.在刚开始消化的时候,玉米油的油水界面面积最小,随着消化过程的持续,玉米油在模拟消化液体系中表面活性成分如胆盐等影响,分散成小油滴,胰酶和脂肪酶能够直接吸附到其几乎裸露的油水界面与油脂反应,因此后来居上,油脂降解程度最高;在Z/K复合颗粒稳定的Pickering乳液中,Z/K颗粒界面层的存在阻碍了胰酶和脂肪酶与油脂接触的作用,因此FFA的释放率比玉米油低;在消化过程中Tween 20稳定的乳液中的Tween 20与胆盐等表面活性剂存在竞争关系,共同组成了一个复杂的乳液体系,随着消化产物等也不断加入到竞争的行列,共同竞争油水界面层,胰酶和脂肪酶与油脂接触变少,最终表现出较小的FFA释放率.
在肠消化的过程中,脂解产物如FFA、单酰基甘油和二酰基甘油与胆盐和磷脂形成混合胶束.混合胶束的非极性区域使姜黄素溶解[16],小的混合胶束可将姜黄素转运至上皮细胞吸收,使姜黄素具有生物利用度.由于离子强度和pH环境的影响,姜黄素在模拟肠液中的降解速度较快[17].油水界面性质是影响姜黄素生物利用度的重要因素[18].经过模拟胃消化1小时和模拟肠消化2小时后,姜黄素的生物利用度以5.87±0.94%(oil-cur)< 8.84±0.32%(tween20-cur)< 9.81±0.24%(zk-cur)的顺序逐渐增加.玉米油的数据比2.13±0.24%[6]高,这可能是由于FFA释放量较高(91.56%比近45%[6]高).在相同的输送体系中,FFA的释放量越大,姜黄素的生物利用度越高[5].姜黄素作为疏水性生物活性物质,乳液体系中的姜黄素生物利用度明显高于玉米油.由于Z/K复合颗粒在油水界面的不可逆吸附[19],Pickering乳液体系比表面活性剂体系(Tween 20稳定的乳液)具有更好的对姜黄素的保护作用.

图1 Zein/konjac glucomannan稳定的Pickering乳液
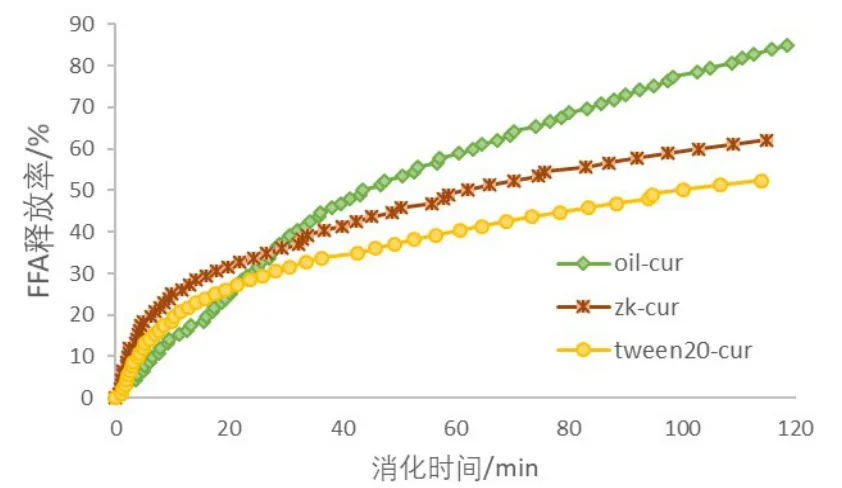
图2 模拟肠消化过程中Z/K制备的Pickering乳液、玉米油、Tween 20制备的乳液的FFA释放率
3 结论
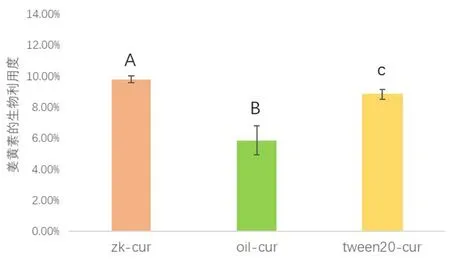
图3 模拟肠消化过程中Z/K制备的Pickering乳液、玉米油、Tween 20制备的乳液的姜黄素的生物利用度
该研究证明了Z/K复合颗粒能够稳定Pickering乳液,并分析Z/K复合颗粒是由Z与K通过静电相互作用结合而成.在研究中,当Z/K质量比=2:1,4:3,1:1(w/w)时,Z/K复合颗粒稳定的Pickering乳液可以稳定存在110天.荷载了姜黄素Z/K质量比=2:1(w/w)的Z/K复合颗粒稳定的Pickering乳液、荷载姜黄素的玉米油和Tween20稳定的乳液一起进入模拟胃肠消化.经过1小时的体外模拟胃消化和2小时的体外模拟肠消化实验,发现油脂水解程度与姜黄素的利用度和所在体系有很密切的关系,FFA释放率以91.56±4.62%(玉米油)>55.05±7.09%(Z/K复合颗粒稳定的Pickering乳液)>46.87±5.56%(Tween20稳定的乳液)的顺序递减,姜黄素的生物利用度以5.87±0.94%(玉米油)<8.84±0.32%(Z/K质量比=2:1,4:3,1:1(w/w)时,Z/K复合颗粒稳定的Pickering乳液)<9.81±0.24%(Z/K复合颗粒稳定的Pickering乳液)的顺序逐渐增加.也就是说zk-cur具有比玉米油和Tween20稳定的乳液更高的生物利用度.这可能是因为Z/K复合颗粒在油滴周围形成相对固定的界面层,对油滴以及荷载在油滴上的活性物质姜黄素都具有保护作用.该研究将疏水的生物活性物质姜黄素包埋在Pickering乳液中,为活性物质在口服药物的应用中提供理论依据,并促进了Pickering乳液在食品、医药、化妆品、保健品等领域的应用发展.
