药物计量认证XRD测试测试报告统计研究
2020-07-21江任之
江任之
(华中科技大学分析测试中心,湖北 武汉 430074)
0 引言
X射线单晶衍射(XRD)常用于化合物的物相分析和晶体结构的测定,广泛应用于材料、化学、物理等领域[1-3],但是在制药领域的研究尚处于起步阶段。
China Metrology Accreditation(CMA)指的是中国计量认证,依照原食品药品监督管理总局2016年第105号文件《仿制药质量和疗效一致性评价工作程序》以及2016年第120号文件《化药仿制药口服固体制剂一致性评价申报资料要求(试行)》,药企所提交监管单位仿制药质量等相关检测报告必须是由计量认证资质的检测结构出具,即所提交资料中的检测报告必须有CMA认证。笔者作为CMA实验人员对近五年本测试中心收到的仿制药企业的XRD送检样品进行分析,以期给其他科学研究者和政策制定者带来一定的参考意义。
1 送检样品统计
2014年到2018年5年内华中科技大学分析测试中心与XRD相关的药物类计量认证测试报告,见表1。2014年 9家公司共11份计量认证报告,无药物稳定性测试报告,共9种原料药,20批次样品。2015年21家公司共51份计量认证报告,11份药物稳定性报告,共31类原料药,192批次样品。2016年15家公司共61份计量认证报告,12份稳定性测试报告,共30类原料药,153批次样品。2017年23家公司共95份计量认证报告,19份稳定性测试报告,共50类原料药,251批次样品。9份报告有含辅料等成品药物测试。2018年23家公司,共100份计量认证报告,40份稳定性测试报告,共44类原料药,313批次样品。9份报告有含辅料等成品药物测试。从数据上看样品数量逐年增多,特别是2016年后出现井喷状态,特别是晶型稳定性的需求增加,原料药种类增加,辅料以及成品药物的计量认证报告报告需求增加,见表1。
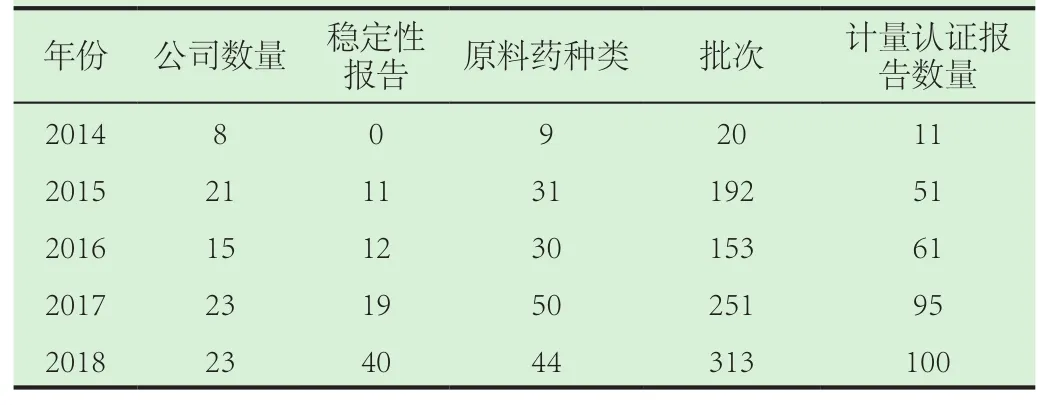
表1 计量认证中心近五年与XRD相关的药物类计量认证测试报告
2 衍射数据收集的范围不合理
目前我国药典对于XRD检测部分给出的标准为2θ角为3-60°,五年认证报告中发现仅有5%左右的药品在5°以下能检测出明显的衍射峰。对于绝大部分药品检测药典的2θ角度范围3-60°满足要求。我国2015版药典与美欧日药典相比,XRD检测部分相对单薄,虽然目前对于药品的晶型没有单独的规定,但很有可能会将每一种单独药物的晶体结构纳入检测标准中。在低角度1-5°对分辨率要求较高,应该选择较小的狭缝以提高分辨率。在5°以上,对强度要求较高,应该增大狭缝提高强度,药物的XRD计量认证报告应在低角度和高角度两个范围检测更为合理[4]。
3 长期稳定性测试样品增多
送检样品从单纯的晶型测定到稳定性长期性测定,近五年的统计中长期稳定性测试占送检样品的25.3%,2018稳定性测试占总数40%。长期稳定性测试的样品主要分为长时间光照,高温高湿,敞口或密封保存。目前报告中送检样品XRD图谱稳定,但是也存在冷冻样品未妥善保管,短期加速样品未能及时检测造成结果错误,而最终留样无法重复,不能满足计量认证的要求。
4 测试的准确性的误差来源及解决办法
多年的实际工作经验,X射线衍射仪的几个主要误差来源:①仪器测角仪的偏移;②测试软件OFFSET点设置错误;③制样不平整,过高或者过低造成峰位的偏移;④不同仪器厂家的分析软件与其他厂家仪器数据的不匹配;⑤药品不均匀,所取所检样品没有代表性;⑥样品形貌特殊,制样过程人为造成样品的取向织构;⑦夹头污染导致粉末样品不在聚焦圆上。针对性解决方法如下:①目前按照计量法通则,一般一年内校正一次,两年内部校准一次,但建议每周一次对标准多晶Si片快速扫描,这样可以确定峰位是否漂移和X射线光管强度衰减情况;②针对1扫描结果,峰位偏移量不大时可使用软件校正,设置OFFSET点校正,然后尽快联系厂家工程师进行光路校正;③保证制样的平整,特别是与仪器检测平面不能有倾斜的角度;④最好使用同一厂家软件分析该厂家仪器数据,不同厂家软件分析数据需要校正步长等;⑤样品必须充分混合均匀,如果单次样品不能;⑥磨粉不影响物相情况下,要求原料药是粉末状;⑦定期清洗夹头;⑧使用离心管存放药物样品,自封袋易产生静电,造成粉尘飞扬[5]。
5 亟需解决的问题
依照原食品药品监督管理总局要求,化学药品资料中粉末XRD图谱的真实性不同申报单位或者同一单位不同批号相关数据需完全一致[6]。目前市面上X射线衍射仪的精度较高,以荷兰帕纳科型号EMPYREAN为例,其峰位数据可以精确到小数点后4位。对照样品与参比样品数据误差多少以内或者小数点后几位符合可判定为完全一致,原药监局以及2015版药典并没有给出详细的参考标准。检测人员无标准可依,在现行的法规下无法给出一致性的结论,通常做法是将样品以及对照品分别测试,提供两份谱图交给送检单位。同时由制样所造成的误差在高角度影响较小,而低角度影响较大依据四圆单晶X射线衍射仪测定小分子化合物的晶体及分析结构分析方法通则(JY/T 008-1996)。目前药物晶型可以使用单晶衍射仪直接确定,晶体的晶胞参数、晶系、空间群、原子/分子的三维排布、成键和非成键原子间的距离和角度、价电子云分布等微观结构信息。缺点在于对样品结晶性要求高,同时单个晶粒并不能说明整个样品的宏观实际,而目前实际工作经验中各药厂送检的仿制原料药工艺普遍不够稳定。
对于形貌特殊的针状或者片状样品,在制样的过程及其容易造成织构,造成测试数据重复性差,而磨粉虽然能很好的解决制样织构的问题,但是磨粉的过程中容易造成原料药晶型的变化,对于X射线射线衍射仪测定的制样也需要国家标准进一步的规范。国内2015版药典与前版相比,内容更加详细完善,但是与美欧日药典相比,存在指导标准空泛,检测方式方法笼统模糊的问题。
最后是留样的稳定性问题,计量认证对送检样品需有一定的保存期限。若用户对计量认证报告结果不认同的情况下,可在在保存期限内对留样进行重复实验。然而工作中遇到过样品迅速变化不易保存,比如盐酸伐昔洛韦原料药的某一中间体在空气中放置30 min立刻发生晶型转变。在接样检测之前一定要与客户沟通好样品的保存条件性状。
