异丙肌苷通过Src/ Ras和钙信号通路上调细胞外调节蛋白激酶活性促进T细胞增殖*
2020-07-20李亚芹邓林红欧阳明星
李亚芹,邓林红,欧阳明星
(常州大学生物医学工程与健康科学研究院,常州 213164)
1 引 言
T淋巴细胞(T lymphocyte)简称T细胞,在胸腺发育完成后,通过淋巴系统和血液循环分布到全身的免疫器官和组织中发挥免疫功能[1]。T细胞免疫是机体防御肿瘤细胞和病原生物的屏障,其功能正常对人类抵御疾病至关重要[2]。T细胞功能低下的人通常需要服用免疫调节药物以维持人体健康。
异丙肌苷是一种免疫调节药物,体外实验证明,它能促进处于有丝分裂中的T细胞的分化和增殖[3]。但目前异丙肌苷促进T细胞增殖的相关信号分子调控机制尚不太清楚。本研究希望通过探究与T细胞活化增殖相关的分子如细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、钙离子(Ca2+)信号通路、非受体酪氨酸激酶Src/小G蛋白家族成员Ras的变化情况,以达到初步了解异丙肌苷促进T细胞增殖的信号机制的目的。
ERK信号传递途径是涉及调节细胞生长、发育及分裂的信号网络的核心,是细胞增殖的关键分子[4]。目前已有研究表明,ERK活性可影响T细胞的活化增殖[5]。基于此,本研究拟通过探讨异丙肌苷是否上调ERK活性从而促进T细胞增殖。为了验证该猜想,使用了一种基于荧光共振能量转移(fluorescence resonance energy transfer, FRET)技术原理的探针[6-7],将ERK激酶FRET探针转染进入T细胞,检测异丙肌苷对T细胞中ERK激酶活性的影响。
Src和Ras均为ERK上游信号分子,经研究发现二者的活性对T细胞的发育和功能至关重要[8-9]。因此,Src-Ras-ERK这条信号通路很有可能介导了异丙肌苷对T细胞的促增殖作用。此外,Fazal等[10]发现ERK活性受胞内Ca2+浓度的调控,并且已有研究证明胞内Ca2+浓度会影响T细胞的激活[11],所以本研究还探讨了Ca2+信号通路是否参与异丙肌苷的免疫调节作用。
2 材料与方法
2.1 材料、试剂与仪器
人T淋巴白血病细胞(Jurkat, Clone E6-1),北京北纳创联生物公司;洛斯维·帕克纪念研究所(Roswell Park memorial institute, RPMI)-1640培养基和胎牛血清(fetal bovine serum, FBS),美国Gibco公司;Src抑制剂PP1、Ras抑制剂Salirasib,美国Sigma公司;异丙肌苷、ERK抑制剂PD98059和Ca2+抑制剂U71322,上海阿拉丁生化科技股份有限公司;CCK8溶液,上海碧云天生物技术有限公司;激光共聚焦培养皿,20 mm,无锡耐思生物科技有限公司;用于悬浮细胞的T重悬缓冲液和E电缓冲液电转试剂,美国Thermo公司。
FRET显微镜平台,Cell Observer, Zeiss Inc., 德国;倒置显微镜,Primo Vert, Zeiss Inc., 德国;电转仪,Neon 0.5~ 2.5 Kv, Thermo Inc., 美国。
2.2 方法
2.2.1细胞培养 Jurkat细胞所用培养基为含10%FBS的RPMI-1640培养液。细胞培养在37 ℃恒温、含5% CO2、饱和湿度的培养箱中。
2.2.2通过CCK8法筛选出异丙肌苷促进T细胞增殖的最佳浓度 以每孔5 000个细胞的密度将Jurkat细胞接种于96孔细胞培养板中,分别加入终浓度为0、5、10、20、40、80、160、320、640 μg/mL的异丙肌苷,每个浓度有10个重复组合。培养48 h后,向每孔加10 μL CCK8溶液。然后将培养板放至37 ℃继续培养4 h,用酶标仪测定OD 450 nm值,进而筛选出异丙肌苷促进T细胞增殖的最佳浓度。
2.2.3Jurkat细胞转染FRET探针 Jurkat细胞电转FRET探针的操作步骤如下:在24孔细胞培养板的每个孔中加入500 μL细胞培养基,置于37℃细胞培养箱中预热;按每孔接种2×105个细胞来计算所需细胞量,将细胞悬液离心,用适量磷酸盐缓冲液洗涤细胞两次;加入T重悬缓冲液重悬细胞,加入1 μg微量质粒于重悬液中,用移液枪吸10 μL混悬液;将移液枪插入电转仪中,设电压为1 325 V,时间为10 ms,电击脉冲数为3次;电转结束后,将移液枪中的液体加入至此前预热的培养基中,放于37 ℃细胞培养箱中继续培养。
2.2.4FRET显微镜采集Jurkat细胞的FRET图像 FRET显微镜系统配置有多点定位功能、自动调焦功能以及维持温度和5% CO2条件的细胞培养盒。FRET显微镜上,ECFP成像通道的荧光滤片参数为激发(436±10) nm,分光455 nm,发射(480±20)nm;FRET成像通道的荧光滤片参数为激发(436±10) nm,分光455 nm,发射(535±15) nm。FRET成像时,通过成像软件自动快速切换ECFP和FRET成像通道,以实现该双通道图像的实时采集。实验中,吸取100 μL细胞悬液置于共聚焦皿中间的玻璃孔上,放置于显微镜的细胞培养盒中,这里选择较少量的培养液有助于减少T细胞的浮动。接下来约10 min内,通过成像软件选定多个荧光细胞观察位置,然后使用40或100倍油镜,在显微镜下进行多位点的FRET图像采集。
2.2.5FRET图像数据的定量分析及统计分析 通过以MATLAB软件平台开发的FRET图像分析软件Fluocell 6.0.0(Lu S et al., 美国)进行数据分析[12],该软件包的下载地址为:http://github.com/lu6007/fluocell。实验分析数据以“平均值+标准差”表示,用统计分析软件Origin 8.0(Originlab Inc., 美国)和GraphPad Prism 6.0(GraphPadSoftware Inc., 美国)进行分析,采用t检验比较各组数据之间的差异,P<0.05表示差异具有统计学意义。
3 结果
3.1 异丙肌苷激活Jurkat细胞的ERK活性
为了确定异丙肌苷促进Jurkat细胞增殖的最佳药物浓度,细胞培养中加入不同浓度梯度的异丙肌苷,共培养48 h后,通过CCK8法检测细胞增殖差异。实验结果见图1,异丙肌苷浓度为80 μg/mL时促细胞增殖效果最明显,因此,后续实验中选择异丙肌苷的作用浓度为80 μg/mL。
接下来分析异丙肌苷是否影响到细胞内的ERK激酶活性。转染ERK FRET的Jurkat细胞在添加80 μg/mL异丙肌苷条件下培养48 h后在FRET显微镜下进行荧光成像。通过FRET定量和统计分析,结果见图2,表明异丙肌苷能明显激活Jurkat细胞中ERK活性。为了进一步验证ERK激酶是否调控异丙肌苷对Jurkat细胞的促增殖作用,以添加80 μg/mL异丙肌苷的Jurkat细胞为对照组,在此基础上用10 μmol/L的ERK抑制剂PD98059处理的细胞为实验组,培养48 h后,通过CCK8法检测细胞增殖差异。结果见图3,ERK抑制剂明显抑制了异丙肌苷促Jurkat细胞增殖效果。这些结果显示异丙肌苷通过激活ERK促进Jurkat细胞增殖。
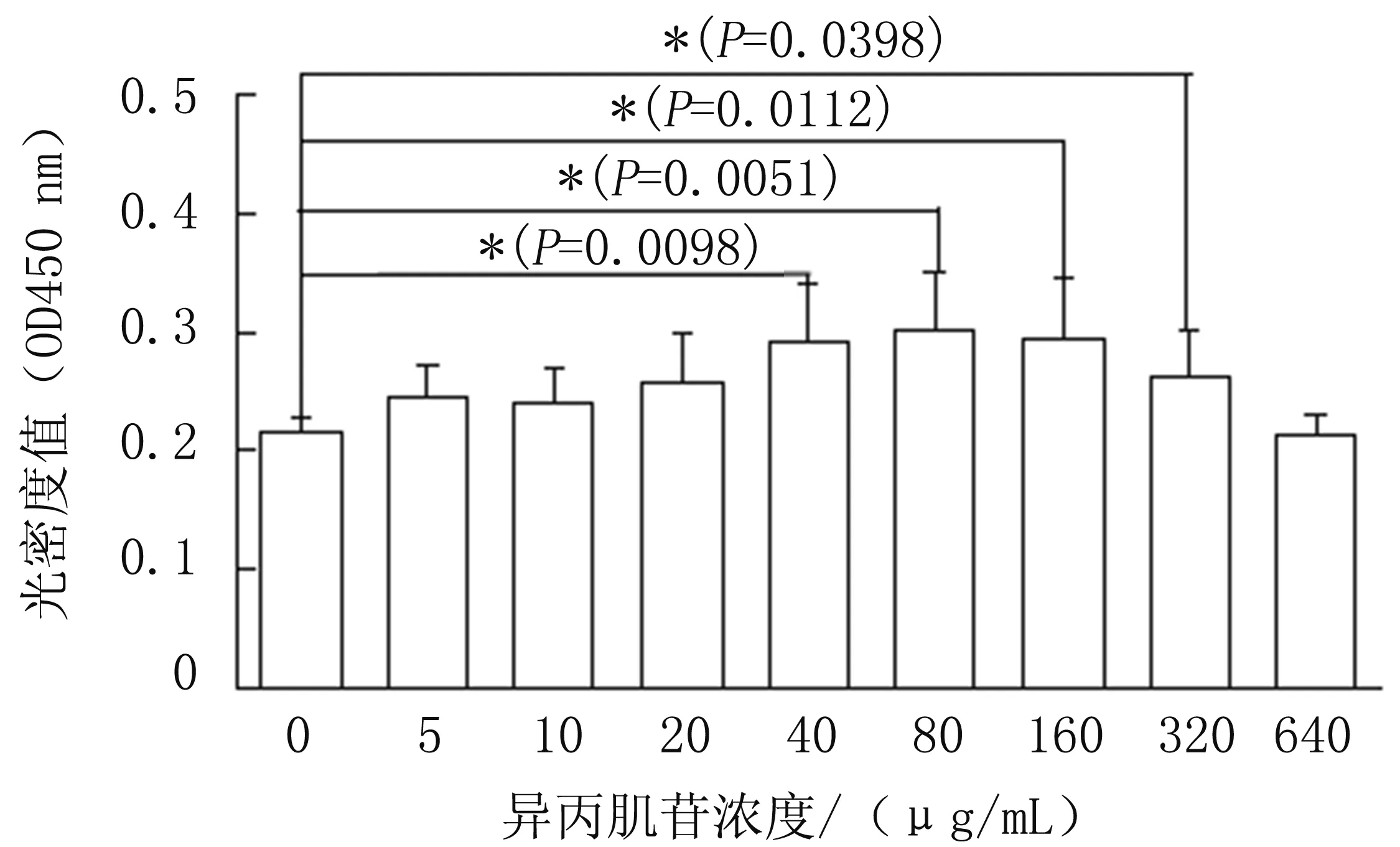
图1 采用CCK8法检测异丙肌苷对Jurkat细胞的增殖影响(* P<0.05)Fig.1 The effect of Isoprinosine on the proliferation of Jurkat cells detected by CCK8 assay(* P<0.05)

图2 异丙肌苷对Jurkat细胞中ERK活性的影响(* P<0.05)Fig.2 Effect of Isoprinosine on ERK activity in Jurkat cells(* P<0.05)
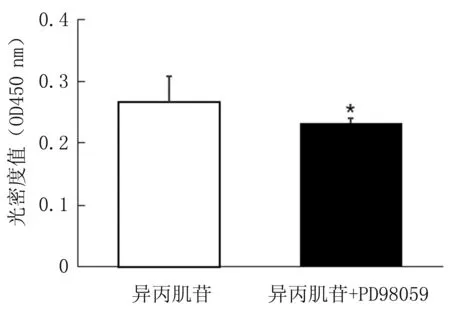
图3 PD98059抑制了异丙肌苷对Jurkat细胞增殖的促进作用(* P<0.05)Fig.3 PD98059 inhibited the effect of Isoprinosine on the proliferation of Jurkat cells(* P<0.05)
3.2 Src激酶参与调节异丙肌苷激活ERK活性
Src激酶是调控ERK活性的重要上游信号之一,因此,本研究检测Src是否参与调节异丙肌苷激活ERK,从而促进Jurkat细胞的增殖。通过加入10 μmol/L Src激酶抑制剂PP1并进行CCK8实验,发现其显著抑制了异丙肌苷的促增殖作用,结果见图4,证明了异丙肌苷促进Jurkat细胞增殖与Src/ERK信号通路相关。为了进一步证明这一点,将转染ERK FRET的Jurkat细胞用异丙肌苷处理48 h,再用PP1(10 μmol/L)处理3 h,进行FRET成像,并和未经PP1处理的对照组比较。结果见图5, PP1能显著抑制异丙肌苷诱导的ERK活性。因此Src激酶信号参与调控异丙肌苷诱导的ERK活性,促进Jurkat细胞增殖。

图4 PP1抑制了异丙肌苷对Jurkat细胞增殖的促进作用(* P<0.05)Fig.4 PP1 inhibited the effect of Isoprinosine on the proliferation of Jurkat cells(* P<0.05)

图5 PP1对异丙肌苷处理48 h的Jurkat细胞中ERK活性影响(* P<0.05)Fig.5 Effect of PP1 on ERK activity in Jurkat cells treated with Isoprinosine for 48 h(* P<0.05)
3.3 Ras激酶参与调节异丙肌苷激活ERK活性
Ras激酶处于Src激酶的下游,也是调控ERK活性的上游激酶之一。加入75 μmol/L Ras激酶抑制剂Salirasib,通过CCK8法发现其显著抑制了80 μg/mL异丙肌苷对Jurkat细胞增殖的促进作用,结果见图6,表明异丙肌苷促进Jurkat细胞增殖与Ras/ERK信号通路相关。将转染ERK FRET的Jurkat细胞用异丙肌苷处理48 h,然后用Salirasib(75 μmol/L)处理3 h,进行FRET成像。结果见图7,经Salirasib处理后,Jurkat细胞群体水平上的ERK活性明显降低。由图7可知,统计学上的差异性分析也证实Salirasib能显著抑制异丙肌苷诱导的ERK活性。因此异丙肌苷通过Ras/ERK信号通路去促进Jurkat细胞的增殖。

图6 Salirasib抑制了异丙肌苷对Jurkat细胞增殖的促进作用(* P<0.05)Fig.6 Salirasib inhibited the effect of Isoprinosine on the proliferation of Jurkat cells(* P<0.05)
3.4 异丙肌苷通过促进Ca2+内流影响Jurkat细胞增殖
Ca2+也是调控Ras/丝裂原活化蛋白激酶激酶(MAPK/Erk kinase, MEK)/ERK通路的重要上游信号之一[13],因此,本研究检测了异丙肌苷对Jurkat细胞中Ca2+信号的影响。通过将Miyawaki等[14]研发和改进的Ca2+FRET探针转染进入Jurkat细胞,可以实时监测胞内Ca2+浓度变化[6]。转染Ca2+探针的Jurkat细胞加入异丙肌苷处理48 h,然后将异丙肌苷处理或对照未处理的细胞置于共聚焦皿上,进行FRET成像并比较,实验结果见图8,异丙肌苷刺激了Jurkat细胞内Ca2+浓度升高。为进一步验证异丙肌苷是否可通过钙信号通路影响Jurkat细胞的增殖,用Ca2+抑制剂U71322(20 μmol/L)处理与异丙肌苷共培养的Jurkat细胞48 h后用CCK8法分析检测,结果见图9,U71322明显抑制异丙肌苷促增殖的影响。

图7 Salirasib对异丙肌苷处理48 h的Jurkat细胞中ERK活性影响(* P<0.05)Fig.7 Effect of Salirasib on ERK activity in Jurkat cells treated with Isoprinosine for 48 h(* P<0.05)
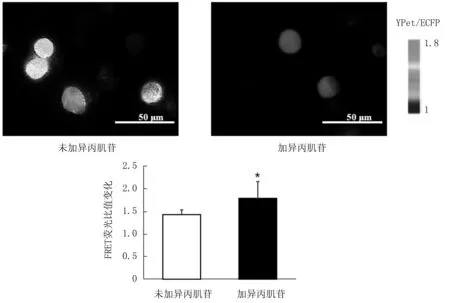
图8 异丙肌苷刺激Jurkat胞浆Ca2+浓度上升(* P<0.05)
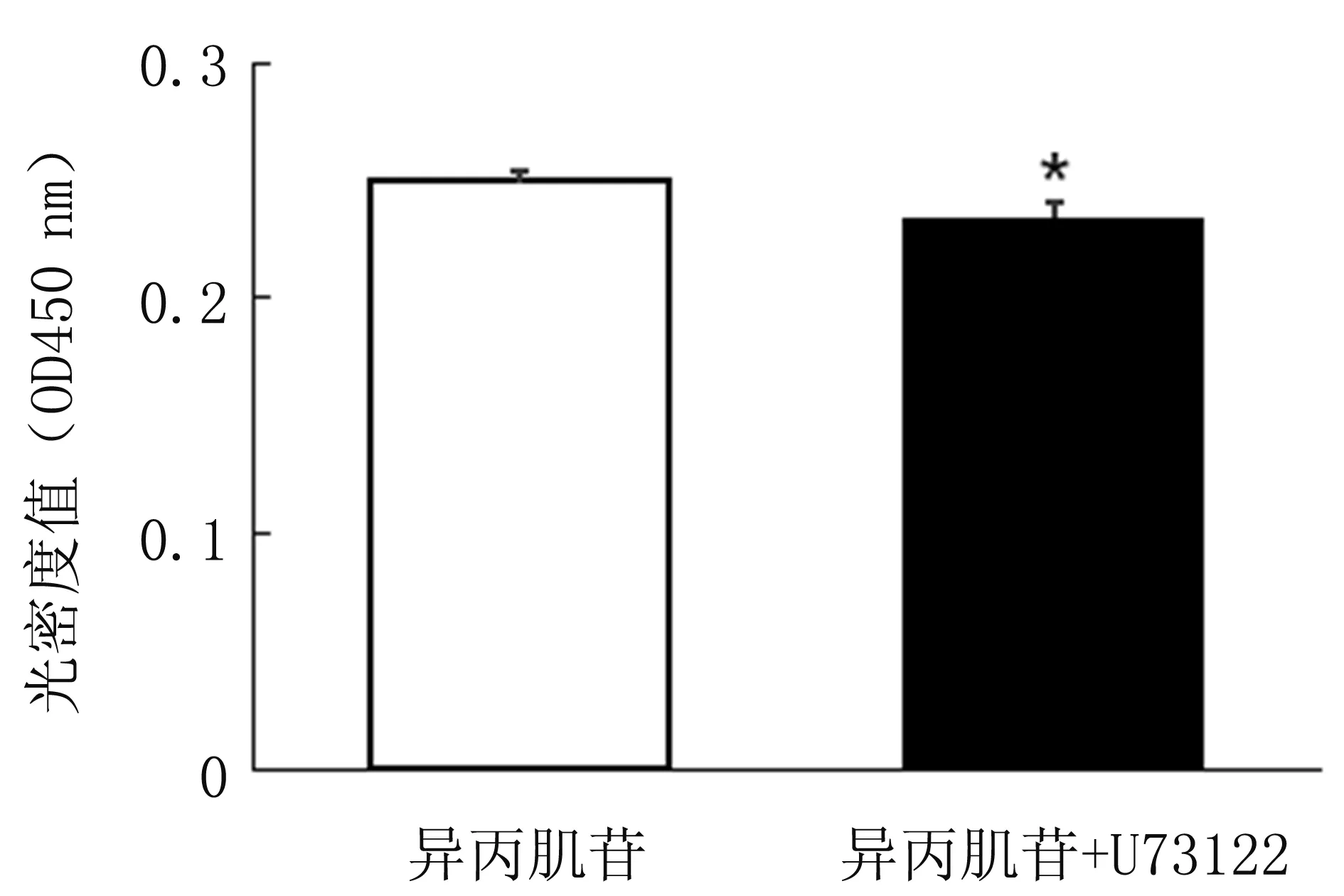
图9 U73122抑制了异丙肌苷对Jurkat细胞增殖的促进作用(* P<0.05)Fig.9 U73122 inhibited the effect of Isoprinosine on the proliferation of Jurkat cells(* P<0.05)
4 讨论
体内T细胞正常活化是实现机体免疫功能的基本要求,具体表现为T细胞增殖、分化、分泌免疫因子等。已有研究表明,异丙肌苷作为免疫治疗药物能够促进T细胞的分化与增殖。本研究探索了异丙肌苷活化Jurkat细胞的相关信号机制。研究发现异丙肌苷能显著激活Jurkat细胞中的ERK活性,并对其上游机制做了进一步的研究。
Src和Ras是MEK-ERK通路的重要上游信号,影响着细胞的生长分裂[16]。我们研究了异丙肌苷激活T细胞过程中Src/Ras的作用,通过使用Src/Ras抑制剂PP1/salirasib间接地证明了异丙肌苷需要通过Src/Ras信号上调ERK活性。此外,本研究发现异丙肌苷还可刺激Jurkat细胞Ca2+信号,帮助进一步激活ERK活性从而影响细胞增殖。
综上所述,我们研究了异丙肌苷促进Jurkat细胞增殖的具体作用机制。异丙肌苷通过T细胞的胞内Src/Ras和钙信号上调其ERK活性,进而影响Jurkat细胞的增殖。由于实验条件的限制,本研究使用的Jurkat细胞属于淋巴系白血病T细胞,所得到的研究结论值得进一步用原代T细胞验证。尽管如此,此研究仍为异丙肌苷治疗免疫性疾病及肿瘤的作用机制及应用前景提供了一些依据,也为一些免疫治疗新药的研发带来了一些启发。
