阿尔兹海默症转基因鼠生长过程中海马theta节律及行为学的实验研究*
2020-07-20谭如欣王欣殷涛刘志朋
谭如欣,王欣,殷涛,刘志朋
(中国医学科学院北京协和医学院 生物医学工程研究所,天津 300192)
1 引 言
阿尔兹海默症(AD)是一种通常发病于老年期的慢性、原发性、不可逆的中枢神经系统退行性疾病,临床症状主要表现为记忆力受损,学习功能和语言功能出现障碍,早期易与正常衰老相混淆,晚期能出现严重的行为障碍,生活不能自理等。AD的主要病理特征为淀粉样斑块和神经纤维缠结,并伴随有神经毒性炎症和小胶质细胞紊乱等[1-2]。针对AD疾病的治疗目前仍然是一个难题。
神经调控是采用物理刺激或药物手段改变中枢神经、外周神经或自主神经系统活性,从而改善患者的症状。神经调控对改善AD认知障碍具有重要意义,并已取得一定进展。
目前,已有多项研究显示AD患者和AD转基因鼠脑内电活动存在异常,为通过调控神经活动治疗AD提供了依据[3-5]。神经振荡表征的是局部场电位(localfieldpotentials,LFPs)记录到的周期性波动的或节律性的神经系统活动。大脑皮层电活动中包含多个频段的神经振荡。海马脑区是空间记忆和陈述性记忆的关键脑区,海马神经振荡节律尤其是海马theta节律被认为与学习记忆、注意力、动机等高级神经活动密切相关[6-8]。海马theta节律的频率在 4~7 Hz,一般认为神经振荡theta节律的产生与内侧隔阂对海马中间神经元和锥体神经元的抑制性输入有关[9]。
然而,AD行为认知异常发展过程中的行为学和电生理变化还需要大量的实验探究。本研究对AD转基因鼠和同源WT鼠进行行为学及在体电生理研究,对比不同月龄段AD转基因鼠和WT鼠的空间认知行为和海马区DG和PP的局部场电位,旨在探讨AD患者认知功能障碍与海马神经元同步化电活动的关系,获得海马theta节律在AD发展过程中的变化特点,为神经调控AD电活动提供实验依据。
2 材料和方法
2.1 实验动物
10只AD转基因鼠(5XFAD),10只同源WT鼠,均购置于中国医学科学院医学实验动物研究所,动物饲养环境为SPF级,室温为(24±2)℃,按照明/暗各12 h提供照明,自由饮食。
2.2 实验分组
10只AD转基因鼠分为两组,2月龄AD组6只和5月龄AD组4只;同时将10只同源WT鼠分为两组,2月龄对照组6只和5月龄对照组4只。2月龄AD组和2月龄WT对照组进行行为学和在体电生理实验。5月龄AD组和5月龄WT对照组依次进行水迷宫实验和在体电生理实验。
2.3 行为学实验
采用直径150 cm的Morris水迷宫对空间学习记忆能力进行测试。将水槽平均分成四个象限并进行标记,采用位于水槽正上方的高清摄像头对小鼠运动轨迹进行捕捉,并经Anymaze动物行为学记录软件进行分析处理。实验流程分为训练和测试。训练一共5天,每天训练4次,训练时长为60 s。在第6天进行测试,小鼠从离平台最远的象限入水,记录小鼠穿越原始平台区域次数。观察指标还包括小鼠在训练时逃避潜伏期,小鼠游泳速度,小鼠在测试时穿越平台次数,平台象限百分比。
2.4 在体电生理实验
使用腹腔注射乌拉坦(1.2 g/kg)对小鼠进行麻醉,将小鼠固定在脑立体定位仪上,划开小鼠头皮,暴露整个头骨。用少量过氧化氢溶液使前颅清晰后,对DG区进行定位。使用专用颅钻在定位颅骨上开一直径约为3 mm的小孔,并在显微镜下将记录电极分别插入PP和DG区。信号采样频率为1 kHz,带通为0.1~120 Hz,记录信号20 min。
2.5 数据分析
数据采用mean±SEM表示,局部场电位数据采用Matlab2016a进行分析处理,滤除50 Hz工频干扰和低频漂移,提取局部场电位功率谱密度。统计学分析使用SPSS 21.0版本,采用多因素方差分析,给出双因素方差分析的单变量检验,差异显著水平设定为P<0.05。
3 实验结果
3.1 2月龄AD转基因鼠和WT对照鼠行为学对比
图1为2月龄AD转基因鼠和WT对照鼠行为学实验对比。由图可知,在训练的第一天,AD转基因鼠和WT对照鼠的逃避潜伏期相同,从第二天开始,随着训练天数的增加,每一组的平均逃避潜伏期均表现出明显的下降趋势。第一天和第四天的逃避潜伏期具有显著差异(P=0.018),表明AD转基因鼠和WT对照鼠寻找平台能力的提高,反映了学习记忆的有效性。在训练中,AD转基因鼠和WT对照鼠逃避潜伏期和游泳速度均无显著差异。在测试过程中,两组小鼠的穿越平台次数和平台象限百分比均无显著差异。行为学实验结果显示,在鼠龄为两个月时,AD转基因鼠并未出现行为异常,两月龄AD转基因鼠在空间学习记忆能力和运动能力上与WT对照鼠无差异。
3.2 2月龄AD转基因鼠和WT对照鼠的在体电生理对比
图2为小鼠局部场电位的功率谱密度曲线。由图2(a)、图2(b)可知,AD转基因鼠和WT对照鼠的信号主频均在theta频段。由图2(c)、图2(d)可知,AD转基因鼠的LFPs信号主频明显低于WT对照鼠,表现为AD转基因鼠局部场电位功率频谱相较于WT对照鼠整体左移,且在DG区和PP区均存在这种差异。
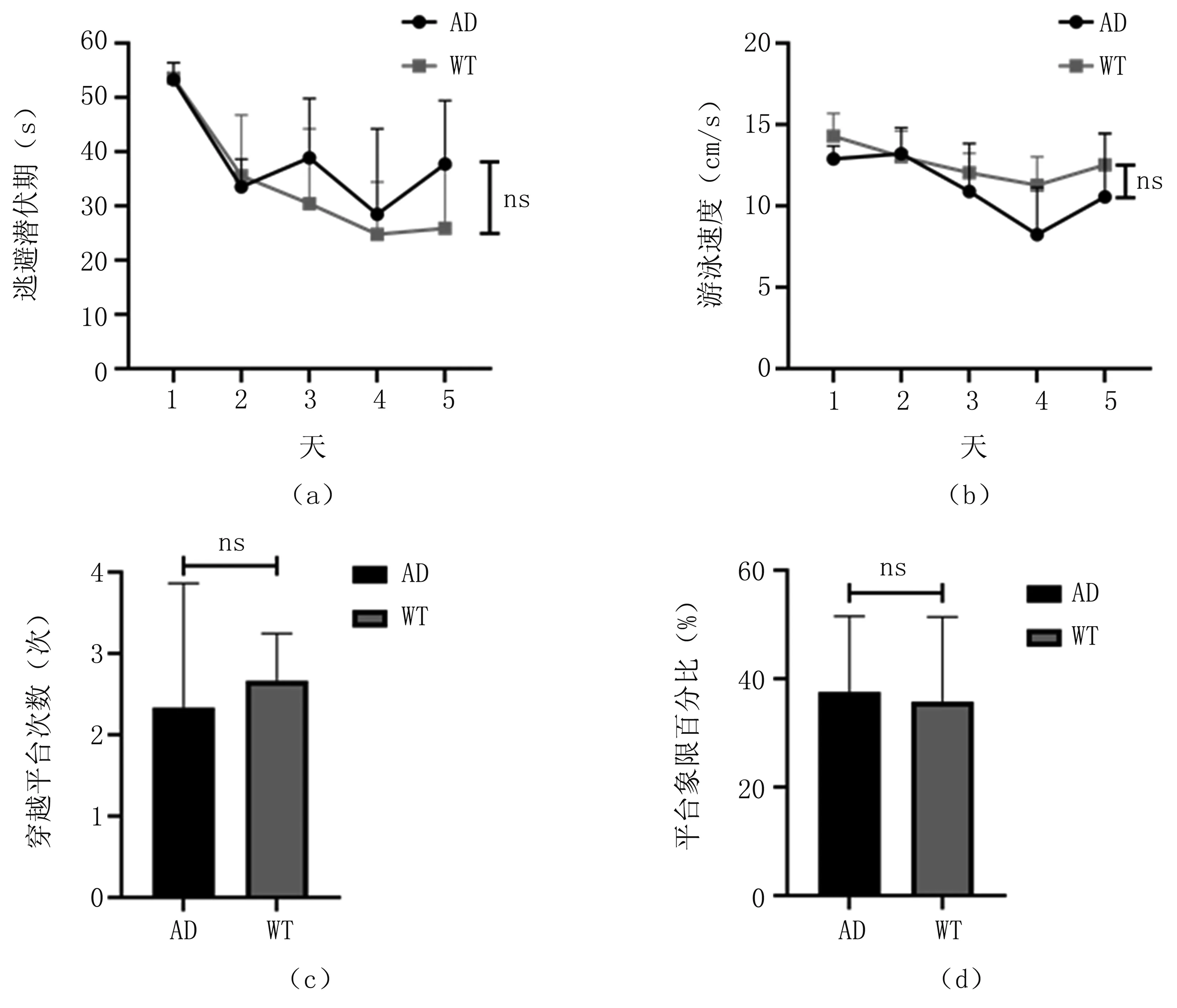
图1 2月龄小鼠水迷宫(a).训练逃避潜伏期;(b).训练游泳速度;(c).穿越平台次数;(d).平台象限百分比Fig.1 Water maze results for 2-month-old mice(a).escape latency;(b).swimming speed;(c).platform crossings;(d).quadrant dwell time
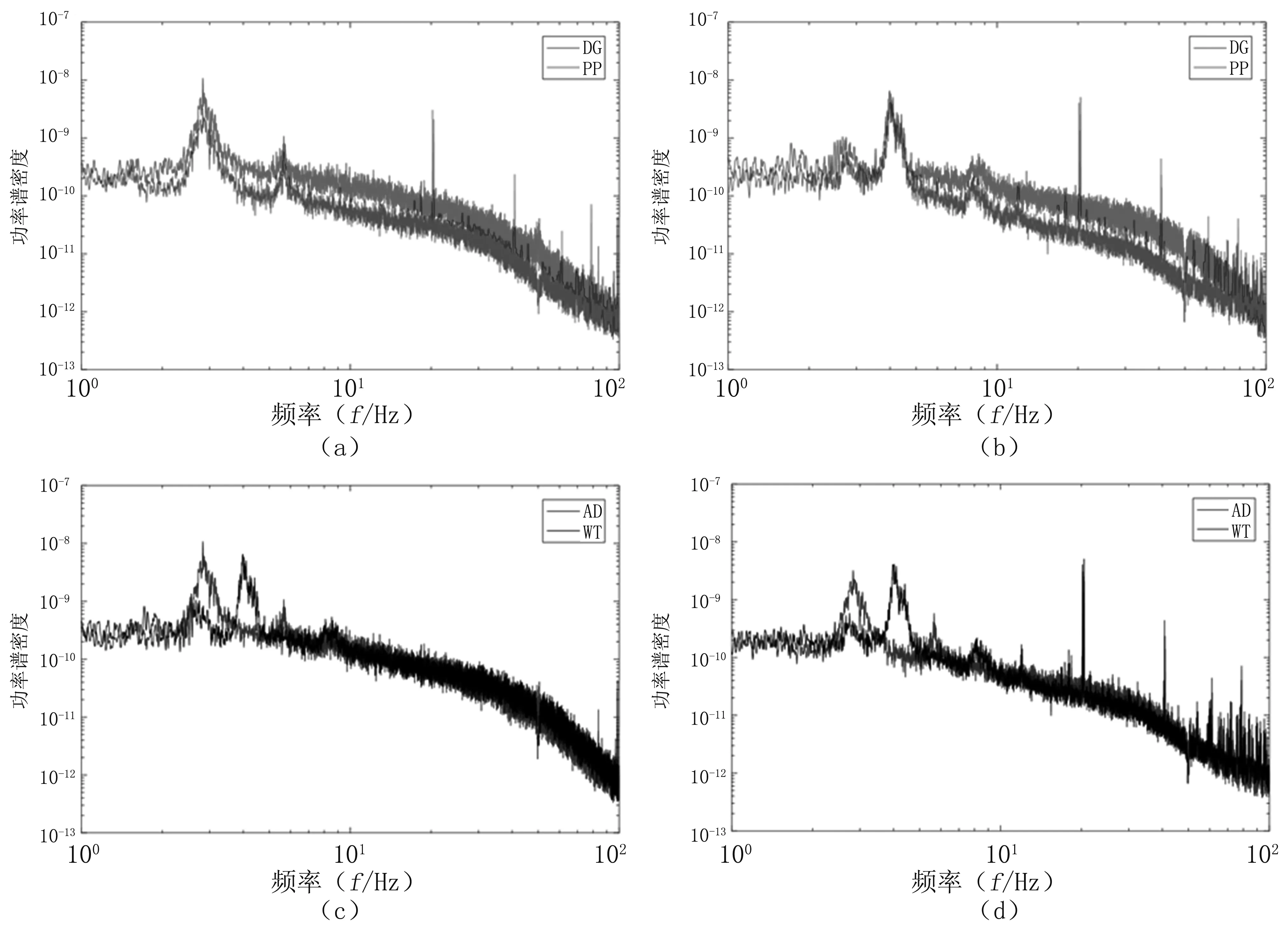
图2 小鼠局部场电位功率谱密度曲线
(a).AD小鼠局部场电位功率谱密度曲线;(b).WT小鼠局部场电位功率谱密度曲线;(c).AD小鼠和WT小鼠在DG区的局部场电位功率谱密度对比;(d).AD小鼠和WT小鼠在PP区的局部场电位功率谱密度对比
Fig.2Local field potential power spectral density curve
(a).AD group local field potential power spectral density;(b).WT group local field potential power spectral density;(c).local field potential power spectral density in DG area;(d).local field potential power spectral density in PP area
为了量化两组小鼠的theta节律变化,进一步提取了AD转基因鼠和WT对照鼠的功率峰值和峰值对应的频率值,功率峰值对应频率反映了两组小鼠LFPs的主频分布情况,见图3。由图3(a)、图3(b)可知,两组小鼠DG区和PP区的功率峰值均无明显差异。图3(c)、图3(d)分别为DG区和PP区的功率峰值对应频率。其中,DG区AD转基因鼠的功率峰值对应频率为(2.78±0.78) Hz,WT对照鼠的功率峰值对应频率为(3.66±0.56) Hz,两者差异较大,具有统计学意义(P=0.015);PP区AD转基因鼠的功率峰值对应频率为(2.72±0.72) Hz,WT对照鼠的功率峰值对应频率为(3.66±0.56) Hz,两者具有显著差异(P=0.021)。结果表明,2月龄AD转基因鼠theta频率的功率峰值与WT对照鼠无异,但功率峰值对应的频率值明显低于同龄WT对照鼠。由此可知,AD转基因鼠在2月龄时已出现了海马theta节律的异常。
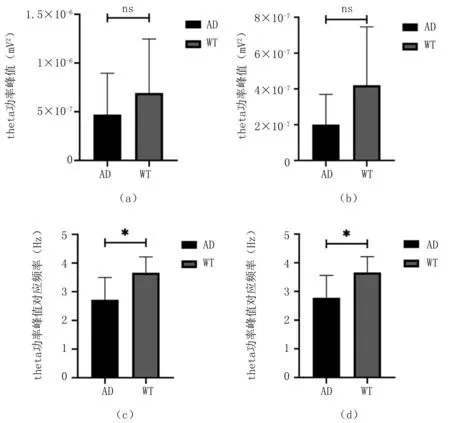
图3 小鼠局部场电位theta功率峰值和theta功率峰值对应频率的统计结果(a).DG区theta功率峰值;(b).PP区theta功率峰值;(c).DG区theta功率峰值对应频率;(d).PP区theta功率峰值对应频率Fig.3 Statistical results of local field theta power peak and main frequency of theta power peak(a).theta power peak in DG area;(b).theta power peak in PP area;(c).main frequency of theta power peak in DG area;(d).main frequency of theta power peak in PP area
3.3 5月龄AD转基因鼠和WT对照鼠行为学对比
对5月龄AD转基因鼠和WT对照鼠的水迷宫空间学习记忆能力测试结果,见图4。图4(a)显示两组小鼠的逃避潜伏期均随着天数的增加逐渐缩短(P<0.05),反映了学习记忆的有效性。同时,5月龄AD转基因鼠的逃避潜伏期显著长于同龄WT对照鼠(P=0.002),表明AD转基因鼠在5月龄时出现了空间学习记忆认知障碍。由图4(b)可知,训练期间两组小鼠的平均游泳速度不受训练天数影响,AD转基因鼠的游泳速度比同龄WT对照鼠更慢,并具有显著性差异(P=0.002),可能是由于5月龄时的AD病变对小鼠运动功能产生了一定的影响,使得AD转基因鼠出现了一定的运动障碍。图4(c)和图4(d)显示AD转基因鼠在测试过程中的穿越平台次数和平台象限百分比均低于WT对照鼠,再次验证5月龄AD转基因鼠出现学习认知障碍。
3.4 2月龄与5月龄AD转基因鼠的电生理对比
由图5可知,5月龄AD转基因鼠的theta功率峰值及总功率峰值均低于2月龄AD转基因鼠,反映了随着鼠龄的增长,AD转基因鼠神经活动变弱。
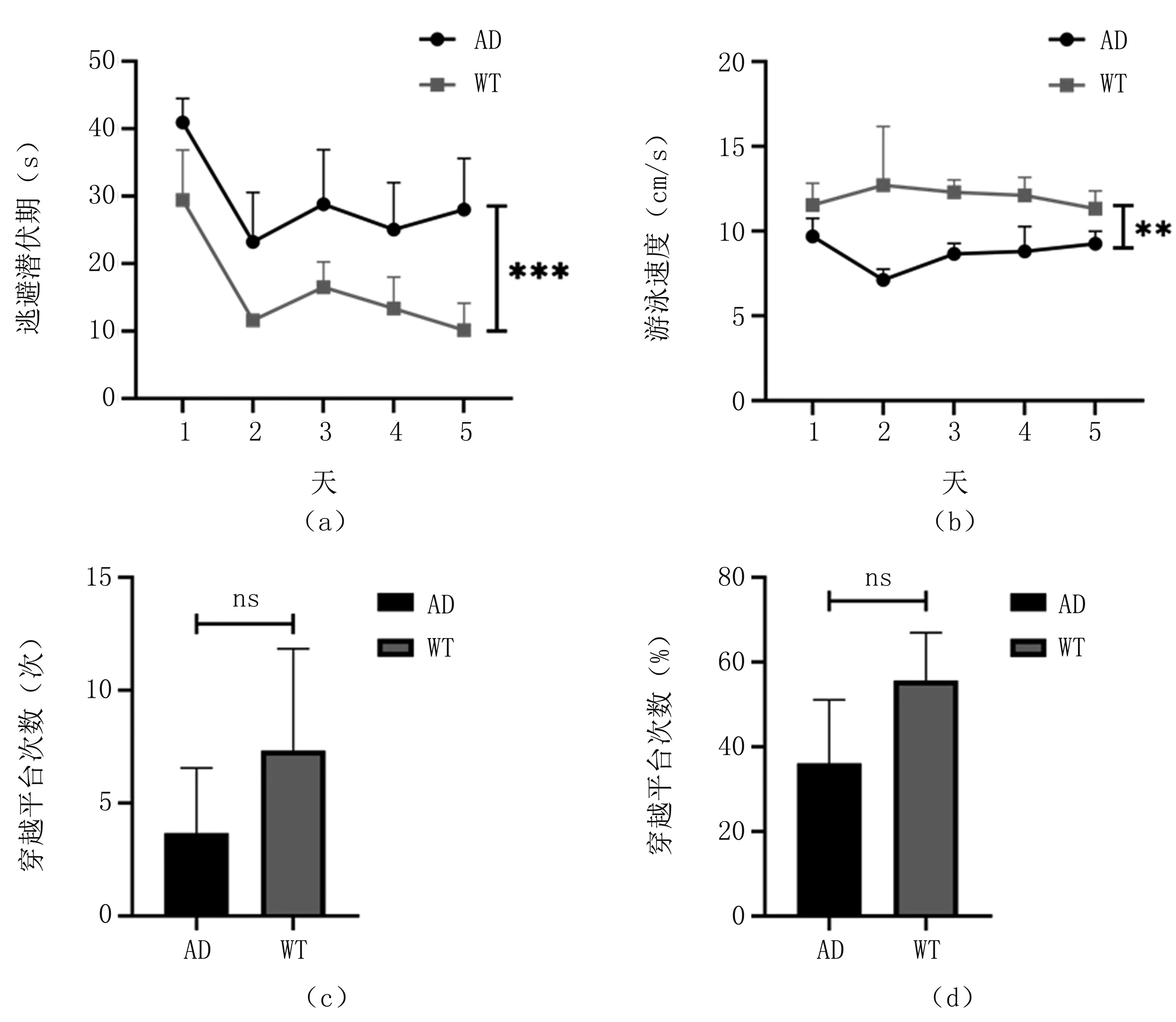
图4 5月龄小鼠水迷宫(a).5月龄小鼠训练逃避潜伏期;(b).5月龄小鼠训练游泳速度;(c).5月龄小鼠测试穿越平台次数;(d).5月龄小鼠测试平台象限百分比Fig.4 Water maze results for 5-month-old mice(a).escape latency;(b).swimming speed;(c).platform crossings;(d).quadrant dwell time
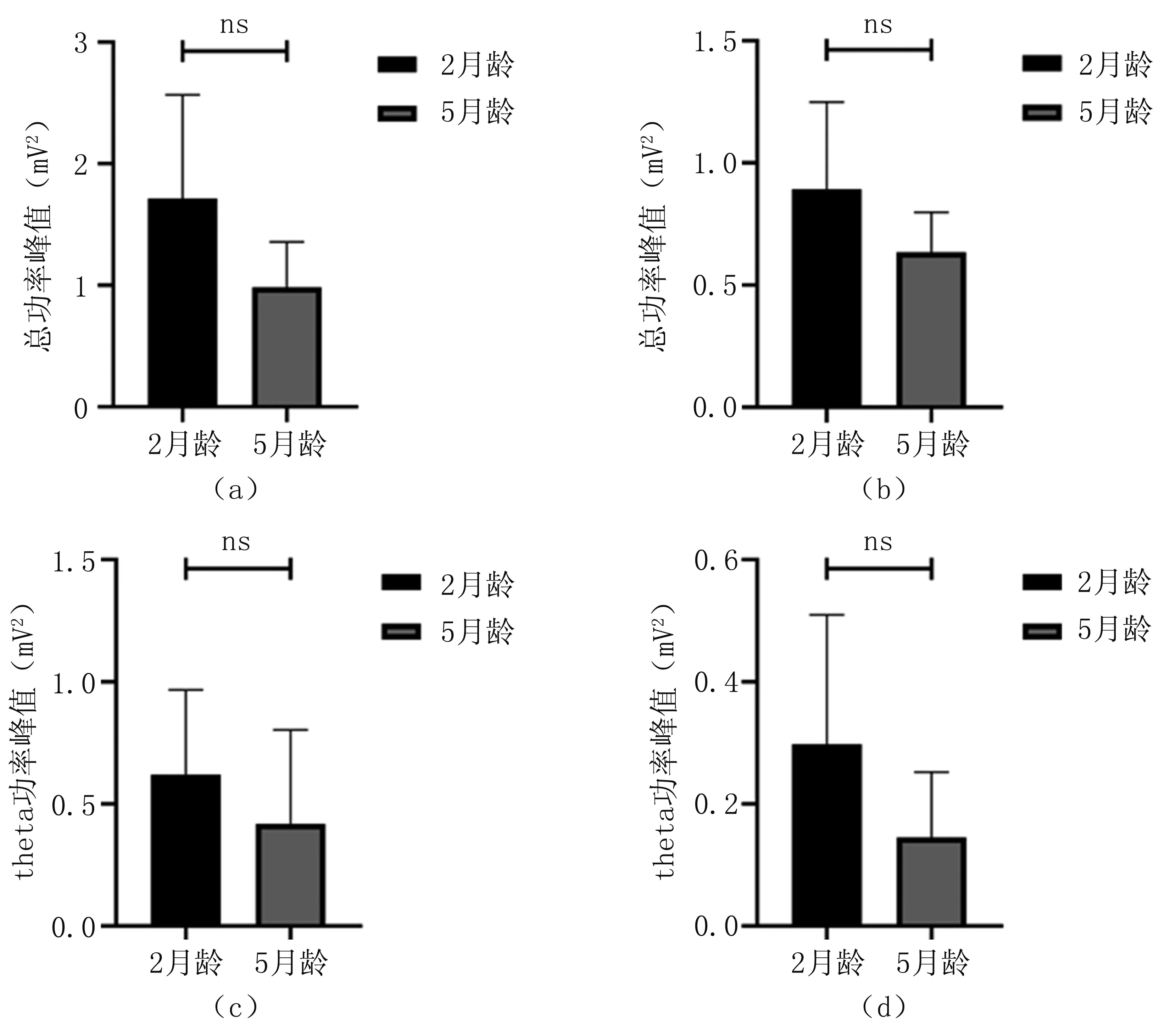
图5 2月龄和5月龄AD小鼠电生理对比(a).DG区总功率峰值;(b).PP区总功率峰值;(c).DG区theta功率峰值;(d).PP区theta功率峰值Fig.5 Electrophysiological in vivo comparison between 2-month-old mice and 5-month-old mice(a).power peak in DG area;(b).power peak in PP area;(c).theta power peak in DG area;(d).theta power peak in PP area
4 讨论
本研究对比了2月龄和5月龄AD转基因鼠的局部场电位功率特征和水迷宫测试的学习记忆行为表现,结果表明,5月龄AD转基因鼠显示出明显的学习记忆认知障碍,2月龄AD转基因鼠尚未出现认知障碍,但局部场电位已经表现出明显的频谱左移,反映出神经电活动异常。
海马theta节律与LTP和学习记忆能力以及空间记忆能力均有着较为密切的联系。已有研究阐明海马theta节律对空间位置的神经编码具有重要作用,海马theta节律的丧失会导致大鼠的空间记忆缺陷[10];theta节律可以同步神经元,以使信息在神经回路内和神经回路之间传递[11-12]。研究发现,随着水迷宫训练天数的增加,海马网络峰值频率逐渐增加,认为小鼠在空间学习过程中网络活动的这些变化可能是导航学习的基础[13]。
在本研究中观察到的theta节律活动的变化与已有研究是一致的,theta节律振荡或其耦合的变化是空间学习[13-14]和空间决策[15-17]的特征,表明了theta振荡在认知过程中的作用。在图1(b)和图4(b)中,2月龄和5月龄WT对照鼠同组对比,在水迷宫空间学习时的游泳速度并无明显变化,说明当动物编码行为相关信息时,如在空间学习决策中,theta频率与运动速度之间的关系是不耦合的[6,16,18]。本研究在获得了正常动物在空间学习时行为学和海马theta节律关系的基础上,对比不同月龄阶段AD转基因鼠和WT对照鼠的神经活动振荡以及认知行为表现。图1(c)和图1(d)中,AD转基因鼠在2月龄时虽然没有表现出行为学异常,但在图2中,其海马区theta节律与WT对照鼠有着显著的区别, AD转基因鼠的theta峰值频率明显小于WT对照鼠,从theta节律上表现出AD转基因鼠空间认知学习能力缺陷。另一方面,AD转基因鼠的theta节律异常早于认知行为异常,在5月龄时,AD转基因鼠在水迷宫实验中表现出显著的空间认知障碍,出现行为异常,结合AD转基因鼠早期theta节律异常情况,说明theta节律除了能实时反映记忆任务的表现,还与空间认知缺陷存在密切联系。这也提示我们对AD患者认知能力缺陷判断时,在观察早期AD患者记忆能力的同时,还要关注是否出现theta节律异常,从而进行早期干预治疗。
5 结论
本研究通过比较不同月龄AD转基因鼠与WT对照鼠的电生理特征和认知行为表现,分析了AD转基因鼠电生理异常和认知异常出现的时期。结果表明,AD转基因鼠在2月龄时,电生理活动theta节律出现异常,但认知行为尚未出现异常;5月龄时,AD转基因鼠相较于同源WT对照鼠,认知能力和运动能力均出现明显的损伤。AD疾病在发展过程中,海马电活动异常要早于认知功能障碍。本研究从宏观上探究了AD患者认知功能障碍与海马神经元同步化电活动的关系,明确了海马theta节律在AD发展过程中出现了变化,在以后的工作中,将深入研究阐明海马theta节律与AD发展的关系。
