“赤霞珠”葡萄自然发酵过程中高产β-葡萄糖苷酶酵母菌株筛选分析
2020-07-20夏俊芳古丽娜孜李璟瑜西热娜依
夏俊芳,古丽娜孜,李璟瑜,禹 凯,西热娜依,武 运
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
葡萄酒的香气来自于葡萄浆果以及在加工、发酵和陈酿过程中产生的物质[1],包括无环萜烯醇、芳樟醇、香叶醇、橙花醇、香茅醇、松油醇以及单环萜烯醇等[2],它们以两种形式存在:自由挥发物和非挥发性糖苷偶联物[3]。自从首次报道葡萄果实中挥发性化合物的糖基化前体以来[4],人们普遍认为,糖苷在葡萄酒酿造过程中的水解作用是决定葡萄酒特征香气形成的主要因素之一[5-6],大量研究表明糖苷结合物的释放可以通过酸解或糖苷酶解的作用来实现,酸解在典型的葡萄酒酿造过程中是相当缓慢,而糖苷酶可以快速水解香气前体并释放挥发性物质[7],因此酶法被用作调节葡萄酒、提高葡萄酒香气的重要方式。
β-葡萄糖苷酶(1,4-β葡萄糖苷酶,EC 3.2.1.21)是从糖苷前体释放单萜物质的关键酶[8]。糖苷前体物被葡萄自身产生的酶和发酵中微生物产生的酶作用,促进葡萄酒香气的形成[9],葡萄果实产生的β-葡萄糖苷酶主要位于浆果果皮的皮下壁,果实产生的β-葡萄糖苷酶在发酵条件(低pH、高葡萄糖或乙醇浓度)对葡萄酒的风味无明显作用[10],而微生物(包括细菌、霉菌以及酵母等)产生的酶对葡萄酒的风味有明显作用如:酵母菌在发酵中具有水解芳香前体物质的能力[11-12]。Perez等[13]使用七叶苷甘油琼脂培养基从乌拉圭葡萄园分离出一些产β-葡萄糖苷酶优良酿酒酵母。Wang等[7]使用对硝基苯基β-D-吡喃葡萄糖苷(p-NPG)法分析两株酵母内部和细胞外产β-葡萄糖苷酶情况。在酿酒条件下,酵母菌在各种糖苷上均有酶活性,因此不同地域环境存在各地区典型特征酵母[14-16],本地土著酵母与该地生态环境相适应,有利于酿造地域特色葡萄酒[17]。为了提高葡萄酒的特色香气物质,探索酿酒酵母生物多样性,本实验从新疆天山北麓葡萄酒产区成熟赤霞珠(CabernetSauvignon)浆果自然发酵过程中筛选高产β-葡萄糖苷酶的优良酵母,利用WL培养基和赖氨酸培养基对其进行分类鉴定并构建18S rDNA发育树,筛选地域特色高产β-葡萄糖苷酶的酵母菌株并探索胁迫因素下菌株产酶活力,为新疆葡萄酒的发展奠定基础。
1 材料与方法
1.1 材料与仪器
“赤霞珠”(Cabernetsauvignon)葡萄 采摘自新疆天山北麓酿酒葡萄产区昌吉回族自治州大三工村甲、乙和丙葡萄种植园中,取样成熟葡萄浆果装入无菌袋,贮存于冰盒,24 h内送至实验室用于酵母菌的分离筛选;商业酵母D254 烟台帝伯仕自酿机有限公司;YPD固体培养基(葡萄糖20 g/L,酵母膏10 g/L,蛋白胨20 g/L,2%琼脂)、初筛培养基(葡萄糖20 g/L,酵母膏10 g/L,蛋白胨20 g/L,2%琼脂)灭菌后温度降至60 ℃加入1 g/L p-NPG、糖类发酵基础发酵管(蛋白胨10 g/L,NaCl 5 g/L,pH7.6置一倒置的杜氏小管)、碳源同化基础培养基(0.5%(NH4)2SO4,0.1% KH2PO4,0.01%NaCl,0.01% CaCl2,0.05% MgSO4·7H2O,0.02%酵母膏,2%琼脂)、氮源同化培养基(2%葡萄糖,0.1% KH2PO4,0.05% MgSO4·7H2O,0.02%酵母膏,2%琼脂) 北京奥博星责任有限公司;p-NPG 美国Sigma公司;对硝基苯酚 上海阿拉丁生化科技股份有限公司;WL培养基、赖氨酸培养基 北京路桥生物有限公司;其他试剂 均为国产分析纯。
FE20 PLUS pH计 上海梅特勒托利多仪器有限公司;DJ100-3型电子分析天平 上海恒平科学仪器有限公司;DY04-13-44-00 压力蒸汽灭菌器 上海东亚压力容器制造有限公司;722 可见分光光度计 上海欣茂仪器有限公司;THZ-98AB恒温培养振荡箱 上海一恒科学仪器有限公司;HSY2-SP电热恒温水浴锅 北京市永光明医疗仪器厂;HR40-IIAI生物安全柜 青岛海尔特种电器有限公司。
1.2 实验方法
1.2.1 赤霞珠(Cabernetsauvignon)葡萄汁发酵过程中酵母菌株的分离 称量约3.5 kg成熟度好的赤霞珠葡萄(糖度25 °Brix),手工破碎后,置于小型无菌玻璃发酵罐中,室温下进行自然发酵,每个时期(发酵前期、发酵中期、发酵后期)取发酵液1 mL于9 mL无菌生理盐水中,梯度稀释10-4~10-7倍,取100 μL各稀释液涂布在YPD培养基上,28 ℃下培养2~3 d,每个稀释度做2个重复。将分离得到的酵母菌株在YPD平板上进行经多次划线纯化后转接于YPD试管斜面,4 ℃保存。
1.2.2 产β-葡萄糖苷酶酵母菌株筛选 初筛:将1.2.1分离到的菌株以1%接种量接种到液体YPD培养基,培养28 ℃,24 h后以1%接种量接种至初筛培养基,再培养72 h后喷1 mol/L Na2CO3后观察黄色光圈大小及颜色深浅能初步反映酶活性高低,将有深黄色光圈菌株保存下来。
复筛:将初筛得到的菌株活化后,再以1%接种量接种到YPD液体培养基中,28 ℃下培养 48 h后取发酵液10 mL于4 ℃8000 r/min离心10 min,收集上清液,测定上清液中的酶活力,从中筛选酶活较高菌株。
1.2.3β-葡萄糖苷酶活性的测定 参照侯晓瑞等[18]的方法,对硝基苯酚标准曲线回归方程为:Y=20.607X+0.0119,决定系数R2=0.9996,吸光度与对硝基苯酚含量成线性关系。取0.1 mL粗酶液与0.2 mL 35 mmol/L p-NPG(pH5.0的柠檬酸-磷酸盐缓冲液配制)混匀,50 ℃保温10 min,加入2 mL 1 mol/L Na2CO3溶液终止反应并显色,于400 nm下测定吸光值。以加热灭活的酶液做空白对照。
酶活力计算公式如下:
式中:U为酶活力单位,U/mL;C为对硝基苯酚(p-NP)的浓度;V为反应体系的体积;N 为原酶液稀释倍数;t 为反应时间;0.1为所取上清液或细胞液的体积。
以商业酵母D254为对照,对初筛中显色较强的菌株,对比不同酵母菌株产β-葡萄糖苷酶活力。
1.2.4 产β-葡萄糖苷酶的菌株鉴定
1.2.4.1 WL、赖氨酸培养基分类鉴定 将1.2.3筛选的菌株挑单个菌落接种于10 mL YPD液体培养基,活化后划线接种与WL培养基28 ℃培养72~96 h,根据菌落形态观察对其进行初步分类。同时将1.2.2筛选的菌株挑单个菌落接种到5 mL无菌水中进行饥饿处理,120 h后接种到赖氨酸培养基,28 ℃培养120 h后观察菌落生长情况,能够在赖氨酸培养基上生长的酵母菌株属于非酿酒酵母,无法生长的为酿酒酵母[18]。
1.2.4.2 生理生化鉴定 a.糖类发酵鉴定:将6种糖(葡萄糖、蔗糖、麦芽糖、半乳糖、乳糖、棉籽糖)分别加入糖类发酵基础发酵管,分别接入0.1% 108CFU/mL酵母溶液,28 ℃ 200 r/min振荡培养48 h,观察杜氏小管内气体产生情况,若小管顶部有气体说明该菌能发酵此种糖[19]。b.碳源、氮源同化试验:碳源同化,选用11种碳源作为同化试验对象包括葡萄糖、蔗糖、半乳糖、麦芽糖、核糖、鼠李糖、乳糖、可溶性淀粉、甘露醇、苹果酸、柠檬酸。分别加入上述11种不同的碳源,配制成不同碳源的液体培养基,备用;氮源同化,3种氮源作为同化试验对象包括硝酸钾、盐酸尸胺和盐酸乙胺,配制成不同氮源的液体培养基,备用;分别接入0.1% 108CFU/mL酵母溶液,28 ℃ 200 r/min振荡培养48 h,如果试管出现混浊则为阳性“+”,否则计为阴性“-”[19]。
1.2.4.3 18S rDNA EF3/EF4区序列分析 利用18S rDNA的高度保守性,对筛选到的菌株进行分子生物学鉴定,这部分测序试验由金唯智生物科技有限公司完成。18S rDNA PCR扩增引物EF3:5 ′-TCCTC TAAATGACCAAGTTTG-3′;EF4:5 ′-GGAAGGGRTG TATTTATTAG-3′[20],采用单菌落为模板进行PCR扩增。
PCR反应体系(25 μL)为:预混液12.5 μL,引物为EF3和EF4各0.5 μL,ddH2O 11 μL,模板DNA 0.5 μL。PCR扩增程序为95 ℃预变性 5 min;95 ℃变性 30 s,52 ℃退火 30 s,72 ℃延伸 1 min,32个循环,72 ℃ 延伸5 min。扩增后,取5 μL的扩增样品在1%的琼脂糖凝胶上80 V电压下进行电泳检测,将亮度好、纯度高的特异性条带(1500 bp 左右)的 PCR 产物用 TaKaRa Agarose Gel DNA Purification Kit Ver. 2.0(Code No. DV805A)试剂盒切胶回收,将对应目的片段置于-20 ℃下保存双向引物测序,基因测序结果在NCBI通过BLAST进行序列比对分析,采用 MEGA 6.06软件,构建菌株的系统发育树。
1.2.5 不同胁迫因素对高产β-葡萄糖苷酶菌株产酶影响
1.2.5.1 乙醇对菌株产酶的影响 分装5 mL YPD液体培养基于试管中,加入倒置的杜氏发酵管,灭菌后接种108CFU/mL G13、G21酵母菌悬液0.1 mL,分别加入无水乙醇,使其最终浓度分别为0%、10%、12%、14%、16%、18%和20%(v/v),28 ℃静置培养48 h,分析乙醇对β-葡萄糖苷酶活力的影响。
1.2.5.2 葡萄糖对菌株产酶的影响 分装5 mL YPD液体培养基于试管中并加入葡萄糖,使其最终浓度分别为2%、5%、10%、15%、20%和25%,加入倒置的杜氏发酵管,灭菌后接种108CFU/mL G13、G21酵母菌悬液0.1 mL,28 ℃静置培养48 h,分析葡萄糖浓度对β-葡萄糖苷酶活力的影响。
1.2.5.3 pH对菌株产酶的影响 分装5 mL YPD液体培养基于试管中并调整pH为2.0、3.0、4.0、5.0、6.0、7.0,加入倒置的杜氏发酵管,灭菌后接种108CFU/mL G13、G21酵母菌悬液0.1 mL,28 ℃静置培养48 h,分析pH对β-葡萄糖苷酶活力的影响。
1.3 数据处理
所有数据均为3次平行实验的平均值,数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序,差异显著性采用Duncan检验进行多重比较,采用Excel 2016整理实验数据、作图。
2 结果与分析
2.1 葡萄酒相关酵母菌株分离
共分离到187株葡萄酒相关酵母,甲葡萄园分离到65株,乙葡萄园分离到70株,丙葡萄园分离到52株葡萄酒相关酵母菌。在发酵的整个过程都分离到相关酿酒酵母,主要集中在发酵的前期和中期,甲、乙、丙三个葡萄园在菌株分离的情况见表1。

表1 酵母菌株分离信息Table 1 The isolation information of yeast strains
2.2 产β-葡萄糖苷酶酵母菌株
187株出发菌株根据1.2.2方法将产酶能力初步分为4个等级:不产酶、弱产酶、中等产酶、较强产酶,如图1。

图1 产酶筛选培养基显色Fig.1 The colour of selective medium for enzyme production注:A:不产酶;B:弱产酶;C:中等产酶;D:较强产酶。
2.3 产β-葡萄糖苷酶酵母酶活性特性分布
初筛得到的产β-葡萄糖苷酶活力的酵母菌株强度大小及分布情况见表2,甲园发酵前期较强,中等产酶的菌株占该园总产酶酵母总数的32%,乙园发酵前期较强,中等产酶菌株占该园产酶酵母总数的23%;丙园发酵前期较强,中等产酶菌株占该园产酶酵母总数的37.1%。总体分析,甲、乙、丙园中产β-葡萄糖苷酶酶活力菌株主要分布在发酵前期。
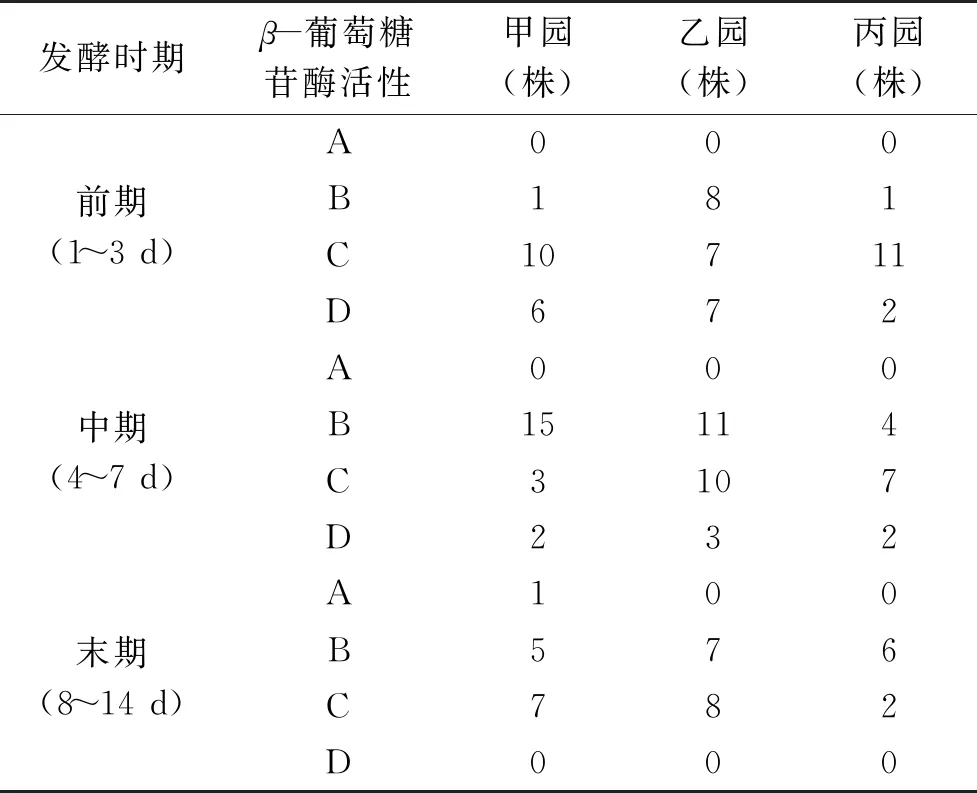
表2 产β-葡萄糖苷酶酵母在不同园区不同发酵期的分布Table 2 Distribution of yeast producing β-glucosidase at different fermentation stages in different parks
2.4 产β-葡萄糖苷酶酵母菌株的复筛
初筛中显色较强的22株菌株(表2中显示为D较强产酶菌株),以商业酵母D254为对照,采用1.2.3方法进行β-葡萄糖苷酶活性测定,结果见表3,其中G13酶活、G21酶活均高于对照商业酵母菌株D254(P<0.01),G8、G17、G19与对照商业酵母菌株D254的酶活力相当(P>0.05)。

表3 不同酵母菌株β-葡萄糖苷酶活性Table 3 Activity of β-glucosidase of different yeast strains
2.5 高产β-葡萄糖苷酶酵母菌株的鉴定
2.5.1 WL、赖氨酸培养基分类分析 将复筛得到的5株高产β-葡萄糖苷酶酵母菌株划线接种于WL培养基、赖氨酸培养基,菌落特征见表4,菌株G8、G13、G17、G19、G21均为酿酒酵母(Saccharomycescerevisiae)。

表4 WL培养基和赖氨酸培养基鉴定结果Table 4 Identification results of WL medium and lysine medium
2.5.2 菌株生理生化特性
2.5.2.1 糖发酵试验 表5是产β-葡萄糖苷酶酵母糖类发酵的试验结果,不同酵母菌株对不同糖的利用能力不同,其中5株菌对葡萄糖、蔗糖的发酵结果均为强阳性,相比上述糖对麦芽糖、半乳糖、棉籽糖的发酵利用率较差;5株菌均不发酵乳糖。

表5 产β-葡萄糖苷酶酵母糖类发酵的试验结果Table 5 Results of fermenting glucose by β-glucosidase yeast strains
2.5.2.2 碳源、氮源同化试验结果 高产β-葡萄糖苷酶酵母菌株的碳、氮源同化结果见表6。G8、G13、G17、G19、G21共5株菌株的碳源同化试验结果中,均能同化葡萄糖、蔗糖、半乳糖、麦芽糖;而5株菌对核糖、鼠李糖、乳糖、苹果酸、柠檬酸均不能同化;氮源同化试验结果,所有菌株均不能同化硝酸钾、盐酸尸胺、盐酸乙胺。
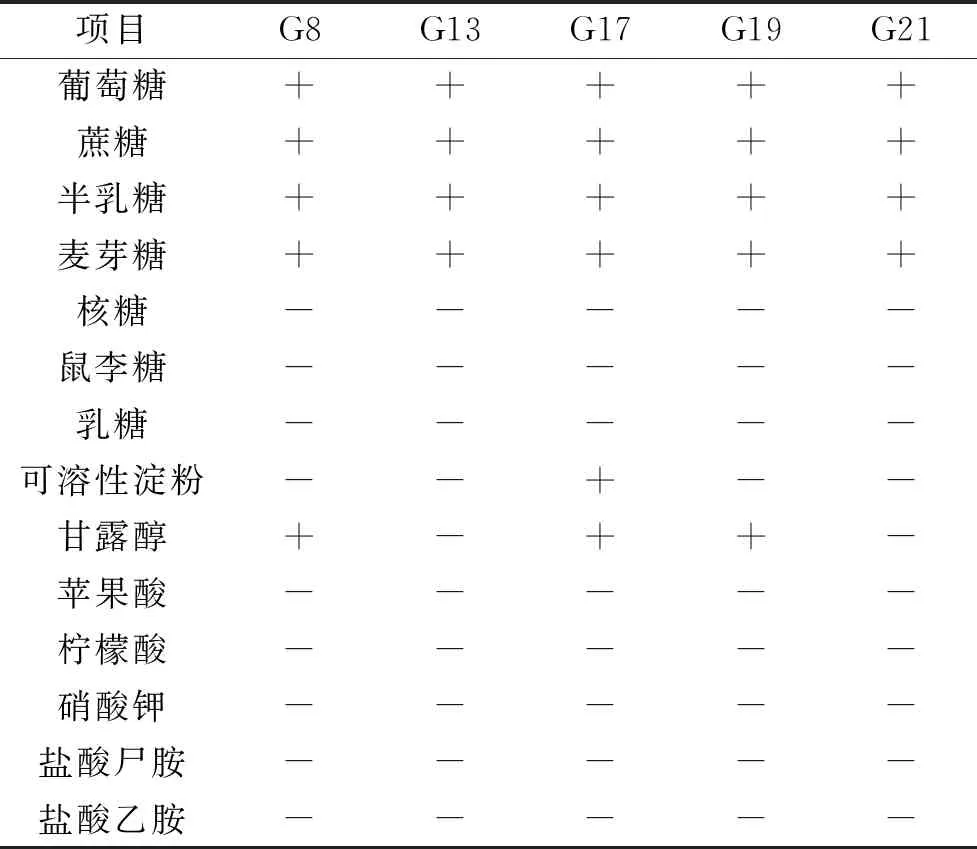
表6 产β-葡萄糖苷酶酵母菌株生理生化实验结果Table 6 Results of physiological and biochemical on β-glucosidase yeast strains
根据发酵糖、碳源同化、氮源同化等试验结果,并对照《The Yeasts,a Taxonomic Study》[21]对酿酒酵母的描述,菌株G8、G13、G17、G19、G21共5株菌均为酵母属(Saccharonmyces)的酿酒酵母(Sacchromucescerevisiae)。
2.5.3 18S rDNA序列分析 通过PCR扩增产生的DNA片段为单一条带,大小长度约为 1500 bp,扩增产物无明显非特异扩增现象,结果见图2。菌株18S rDNA序列经测序后提交GenBank,BLAST比对分析,选择较为相似的序列构建系统发育树,如图3,G8、G13、G17、G19、G21菌株与酿酒酵母(Saccharomycescerevisiae)的18S rDNA序列同源性最高,达到100%,故确定G8、G13、G17、G19、G21菌株均为酿酒酵母(Saccharomycescerevisiae),这与WL、赖氨酸、糖类发酵、碳氮源同化分析的结果相同。

图3 酵母菌株的系统发育树Fig.3 The phylogenetic tree for yeast strains
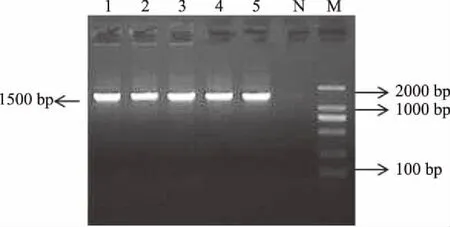
图2 酵母菌株的18S rDNA扩增电泳结果Fig.2 Results of 18S rDNA amplify of yeast strains注:M:Maker;1、2、3、4、5分别是 G8、G13、G17、G19、G21,N:阴性质控。
2.6 不同胁迫因素对高产β-葡萄糖苷酶的菌株产酶影响分析
2.6.1 乙醇对菌株产酶影响分析 对前期实验筛选的高产酶G13、G21菌株进行产酶分析,由图4,随着乙醇浓度的升高,G13、G21产β-葡萄糖苷酶的活性均随乙醇浓度升高而逐渐下降,在10%乙醇浓度下,大约80%的酶活性被保留,乙醇浓度为12%~16%时,G13菌株在14%乙醇浓度酶活力达到37.21 U/mL,G21菌株在14%乙醇浓度酶活力达到35.51 U/mL,相比12%的乙醇浓度的酶活,两株菌产酶活力有所上升,这可能是因为适度浓度的乙醇有助于提高细胞膜的通透性,使细胞内的酶有效释放到胞外,从而提高菌株产酶的活力。而当乙醇浓度为16%时,两株菌产β-葡萄糖苷酶下降到最高酶活的40%,表明G13、G21菌株具有较好的耐受乙醇能力,且在适度(12%~14%)乙醇浓度范围产酶能力较10%乙醇浓度有所提高。

图4 乙醇对产β-葡萄糖苷酶菌株产酶的影响Fig.4 Effect of ethanol on enzyme production of β-glucosidase yeast strains注:组内多重比较,不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05);图5、图6同。
2.6.2 葡萄糖对菌株产酶影响分析 由图5可知,随着葡萄糖浓度的增大,两株菌产β-葡萄糖苷酶能力逐渐减小,5%葡萄糖浓度时酶活力下降了35%,10%葡萄糖浓度时仅保留了50%的最大酶活,当含糖量达20%~25%时产酶活力仅为最佳酶活力的30%,在葡萄酒酿造中,新疆北麓葡萄酒产区葡萄醪液糖度一般为240 g/L,折合百分率糖度大致为24%,表明G13、G21两株菌可耐受较高浓度的葡萄糖且能够产酶,但在高糖浓度下,菌株产酶受到强烈抑制,可见高糖条件对菌株β-葡萄糖苷酶的产生极为不利。

图5 葡萄糖对产β-葡萄糖苷酶菌株产酶的影响Fig.5 Effect of glucose on enzyme production of β-glucosidase yeast strains
2.6.3 pH对菌株产酶影响分析 从图6可知,G13、G21菌株培养48 h,pH4.0时,G13酶活达到47.89 U/mL(P<0.05),pH5.0时,G21酶活达到最高45.62 U/mL(P<0.05),当pH3.0时G13、G21菌株均保持40%的最大酶活,说明在葡萄酒条件pH3.0~3.5条件,G13、G21菌株可发挥产酶活力。

图6 pH对产β-葡萄糖苷酶菌株产酶的影响Fig.6 Effect of pH on enzyme production of β-glucosidase yeast strains
3 结论与讨论
从新疆天山北麓酿酒葡萄产区昌吉回族自治州大三工村甲、乙和丙3个葡萄种植园中的成熟“赤霞珠”酿酒葡萄自然发酵过程中共分离到187株葡萄酒相关酵母,其中甲葡萄园分离到65株,乙葡萄园分离到70株,丙葡萄园分离到52株。在发酵的整个过程都分离到相关酿酒酵母,主要集中在发酵的前期和中期,产β-葡萄糖苷酶酶活力菌株也主要分布在发酵前期,初筛中显色较强的22株菌株采用p-NPG法进行β-葡萄糖苷酶活性测定,并以商业酵母D254为对照,结果5株酵母菌株酶活具有较强产β-葡萄糖苷酶活力,其中G13、G21酶活均高于对照商业酵母菌株D254,G8、G17、G19酶活与对照商业酵母菌株D254的酶活力相当。复筛得到的5株产β-葡萄糖苷酶酵母菌株结合WL营养琼脂和赖氨酸培养基、糖类发酵、碳氮源同化试验、18S rDNA测序鉴定及系统进化树确定五株高产β-葡萄糖苷酶酵母菌株G8、G13、G17、G19、G21均为酿酒酵母(Saccharomycescerevisiae),其中高产酶的G13、G21酵母菌株可耐受较高浓度的乙醇、一定浓度的高糖环境且在葡萄酒pH3.0~3.5条件,发挥产β-葡萄糖苷酶活力。
本研究得到的产β-葡萄糖苷酶的酵母菌株均为酿酒酵母,未筛选到非酿酒酵母,可能是因为本区成熟葡萄的含糖量高,表皮附着的酵母很快在发酵24 h适应环境,成为优势菌株,酿酒酵母通过色素沉着将糖转化为乙醇和二氧化碳,当然很多研究发现非酿酒酵母(假丝酵母属Candida、汉森氏酵母属Hanseniaspora、梅奇酵母属Metschnikowia和毕赤酵母属Pichia)产酶活力高于酿酒酵母[6,13,22-23],是糖苷酶的潜在来源,但在葡萄酒高糖、10%乙醇浓度、低pH下非酿酒酵母产酶活性受到抑制,而一些产β-葡萄糖苷酶的酿酒酵母,如本实验中的G13、G21菌株耐受葡萄酒环境的影响,因此筛选不论强的或者弱的产β-糖苷酶的菌株如在葡萄酒发酵条件下能否稳定产酶对葡萄酒香气的增香至关重要,后续研究应提高产β-葡萄糖苷酶酵母菌株的产酶活力或采取高产酶的非酿酒酵母和酿酒酵母共混发酵以提高葡萄酒的香气及品质。
