麻黄碱及阿托品对人诱导多能干细胞来源心肌细胞动作电位的影响
2020-07-20宫艺其杨礼艾雪峰颜冰倩谭瑶王会景徐徐付炜王伟
宫艺其 杨礼 艾雪峰 颜冰倩 谭瑶 王会景 徐徐 付炜 王伟
诱导多能干细胞(Induced pluripotent stem cell,iPSC)是体细胞经重编程后得到的具有自我更新及多向分化潜能的干细胞。2006年,Takahashi等[1]首次利用4种转录因子oct4、sox2、c-myc,klf4将小鼠皮肤成纤维细胞重编程为诱导多能干细胞(iPSC),随后又将人皮肤成纤维细胞重编程为人诱导多能干细胞(Human induced pluripotent stem cell,hiPSC)[2],从而避免了获取胚胎干细胞所面临的伦理问题,为体外研究各种疾病提供了理想的细胞来源。2013年,Lian等[3]利用小分子物质GSK-3抑制剂及Wnt抑制剂,首次在体外高效分化得到人诱导多能干细胞来源的心肌细胞(Human induced pluripotent stem cell derived cardiac myocytes,hiPSC-CM)。目前,hiPSC-CM被用于建立疾病模型、心肌药物筛选等[4-8],还被用作细胞治疗促进心梗、心衰后的心功能恢复[9-11]。2018年,日本率先批准临床采用hiPSC-CM心肌片用于重症心衰治疗。然而,hiPSC-CM对于许多常见血管活性药物的反应仍不清楚。因此,本研究使用临床常用的经典血管活性药物麻黄碱及阿托品,利用单细胞膜片钳技术,观察这些药物对hiPSC-CM动作电位的影响,为临床提供相关证据。
1 材料与方法
1.1 材料与试剂
hiPSC:取自上海儿童医学中心李彦欣教授课题组,为脐带血细胞来源hiPSC。脐带血捐献者签署了相关知情同意书。本研究经上海儿童医学中心伦理委员会审查批准。
主要仪器:倒置相差显微镜(德国Leica公司DMI300B),细胞培养箱(美国Thermo公司3111),激光共聚焦显微镜(德国Leica公司TSC SP8),微电极拉制仪(美国sutter公司P97),膜片钳系统(美国Axon公司700B)。
主要试剂:基质胶(美国Corning公司354234),E8培养基(加拿大Stemcell公司05990),EDTA(美国Thermo公司),Accutase消化酶(加拿大Stemcell公司7920),Y-27632(加拿大Stemcell公司72304),RPMI1640(美国Thermo公司11875093),B27 minus insulin添加剂(美国Thermo公司A1895601),B27添加剂(美国Thermo公司17504044),ChIR99021(加拿大Stemcell公司72054),IWP-2(加拿大Stemcell公司72124),心肌细胞消化液(北京赛贝生物技术公司CA2011007、CA2011008),肌钙蛋白ctnt抗体(美国Proteintech公司15513-1-AP),肌球蛋白轻链mlc2v抗体(美国Proteintech公司10906-1-AP),α-辅肌动蛋白α-actinin抗体(美国Sigma-Aldrich公司A7811),tra-1-60抗体(德国Merck Millipore公司MAB4360),oct4抗体(美国Epitomics公司2876-1),sox2抗体(美国Epitomics公司2683-1),nanog抗体(美国Epitomics公司3369-1),HEPES(美国Sigma-Aldrich公司H3375-250G),EGTA(上海麦克林公司E6257),ATP镁盐(美国Sigma-Aldrich公司A9187-500MG),盐酸麻黄碱注射液(成都倍特药业有限公司),硫酸阿托品注射液(湖北兴华制药有限公司)。
1.2 方法
1.2.1hiPSC传代培养
在提前铺好基质胶的6孔板中使用E8培养基培养hiPSC,每24小时更换一次。待细胞达到70%~80%汇合后,使用5×10-4mol/L的EDTA在37 ℃下消化5 min,然后按1∶6~1∶9传代至新的铺好基质胶的6孔板中。
1.2.2hiPSC心肌分化
使用Accutase消化酶将hiPSC消化成单个细胞,按1×106个/孔接种于提前铺好基质胶的12孔板,待细胞完全融合,加入含12 μmol/L CHIR99021的RPMI1640/B27 minus insulin分化培养基。24 h后更换普通RPMI1640/B27 minus insulin培养基。48 h后,加入含5 μmol/L IWP-2的RPMI1640/B27 minus insulin分化培养基。48 h后更换普通RPMI1640/B27 minus insulin培养基。再过48 h更换RPMI1640/B27培养基,以后每48小时更换一次RPMI1640/B27培养基维持培养,直至第30天。
1.2.3hiPSC干性鉴定
按1×105个/孔的细胞密度,将hiPSC接种于预先铺好基质胶的24孔板玻璃爬片上。待细胞融合至40%~50%时,室温下4%多聚甲醛固定20 min,0.5%TritonX-100室温破膜30 min,10%山羊血清室温封闭30 min,添加tra-1-60抗体、sox2抗体、nanog抗体、oct4抗体(1∶200),4 ℃孵育过夜。PBS清洗3遍后,添加相应荧光二抗(1∶1 000)室温避光孵育120 min。dapi(1∶1 000)室温核染10 min,激光共聚焦显微镜观察。
1.2.4hiPSC-CM鉴定
按1×105个/孔的细胞密度,将hiPSC-CM接种于预先铺好基质胶的24孔板玻璃爬片上,置于培养箱培养24 h。待细胞完全贴壁后取出,室温下4%多聚甲醛固定20 min,0.5%TritonX-100室温破膜30 min,10%山羊血清室温封闭30 min,添加ctnt抗体、α-actinin抗体、mlc2v抗体(1∶200),4 ℃孵育过夜。PBS清洗3遍后,添加相应荧光二抗(1∶1 000)室温避光孵育120 min。dapi(1∶1 000)室温核染10 min,激光共聚焦显微镜观察。
1.2.5动作电位电极内液、电极外液配制
电极内液(mmol/L):KCl 150,NaCl 5,CaCl22,EGTA 5,HEPES 10,MgATP 5(pH 7.2,KOH);电极外液(mmol/L):NaCl 140,KCl 5,CaCl21,MgCl21,Glucose 10,HEPES 10(pH 7.4,NaOH)。
1.2.6hiPSC-CM动作电位检测
在分化至第30天、含有4×104个hiPSC-CM的35 mm 孔径培养皿中加入1 mL Accutase消化酶消化5 min,随后通过“Y-tube”灌流装置用动作电位电极外液灌流5 min。选取单个、细胞膜完整的心肌细胞作为记录细胞。记录电极用硅酸盐毛细玻璃管由微电极拉制仪拉制而成,充入电极内液后入液阻抗3~5 MΩ。当电极尖端与细胞膜表面形成1 GΩ 以上的高阻封接后,吸破细胞膜,补偿细胞膜电容,串联电阻补偿40%~50%,使用电流钳gap free 模式记录心肌细胞自发产生的动作电位。随后,通过“Y-tube”灌流装置用含500 μmol/L麻黄碱、100 μmol/L阿托品的动作电位电极外液给药5 min,记录两种血管活性药物对心肌细胞动作电位的影响。用Clampfit 10和Origin 8软件进行数据分析。
1.2.7统计学方法
2 结果
2.1 hiPSC干性鉴定
iPSC在基质胶上呈集落、克隆样生长,免疫荧光染色显示细胞核内多能性标志物oct4,sox2,nanog及细胞表面多能性标志物tra-1-60,均呈强阳性表达,表明此iPSC细胞系多能性良好,可用于后续心肌分化(图1)。
2.2 hiPSC心肌分化
将多能性良好的hiPSC按前述方法诱导心肌分化,观察干细胞向心肌细胞转变过程中细胞的形态变化。干细胞从分化开始时的紧密圆形,逐渐变为松散椭圆形的心肌前体细胞(Cardiac progenitor cell,CPC),随着分化进行,细胞逐渐转变为集聚成条索状的心肌细胞(Cardiomyocyte,CM),并在第12天出现自发搏动,随着分化时间的延长,细胞逐渐趋近成熟(图2)。
2.3 hiPSC-CM鉴定
为了进一步证明诱导分化得到的细胞为心肌细胞,我们通过心肌细胞特异性标志物染色对其进行进一步鉴定。免疫荧光染色显示,ctnt、α-actinin和mlc2v均呈强阳性表达。证明经过30 d分化,大部分细胞为相对成熟的心室肌细胞,可用于后续血管活性药物对动作电位影响的实验(图3)。
2.4 麻黄碱、阿托品对hiPSC-CM动作电位的影响
通过灌流系统对hiPSC-CM灌流动作电位电极外液。膜片钳系统显示,心肌细胞呈自发节律性动作电位,可见明显2期平台期,表明得到的细胞为心室肌细胞(图4A、C,图5A、C)。
通过同样方法对hiPSC-CM灌流含500 μmol/L麻黄碱的动作电位电极外液。膜片钳系统显示,加药后心肌细胞自发节律性动作电位频率明显增加(P=0.023)。动作电位波形无明显改变,去极化幅度(APA)、最大去极化速率(dV/dtmax)和90%动作电位时程(APD90)相比加药前无明显变化(图4,表1)。

A~C:oct4、dapi、merge免疫荧光;D~F:sox2、dapi、merge免疫荧光;G~I:nanog、dapi、merge免疫荧光;J~L:tra-1-60、dapi、merge免疫荧光(比例尺=25 μm) A-C: Immunofluorescence of oct4, dapi and the merge; D-F: Immunofluorescence of sox2, dapi and the merge; G-I: Immunofluorescence of nanog, dapi and the merge; J-L: Immunofluorescence of tra-1-60, dapi and the merge (Scale bar=25 μm)图1 hiPSC细胞核多能性标志物oct4、sox2、nanog和细胞膜多能性标志物tra-1-60的表达Fig. 1 The expression of hiPSC nuclear pluripotency markers oct4, sox2, nanog and cell membrane pluripotency marker tra-1-60

A:hiPSC心肌分化模式图;B:分化第0天;C:分化第6天;D:分化第12天;E:分化第30 天(比例尺=100 μm;CPC指心肌前体细胞;CM指心肌细胞) A: Schematic diagram of cardiac differentiation process of hiPSC; B: Cardiac differentiation on Day 0; C: Cardiac differentiation on Day 6; D: Cardiac differentiation on Day 12; E: Cardiac differentiation on Day 30 (Scale bar=100 μm; CPC refers to cardiac progenitor cells; CM refers to cardiomyocytes)图2 人诱导多能干细胞心肌分化过程Fig. 2 The cardiac differentiation process of hiPSC

A~D:ctnt、α-actinin、dapi、merge免疫荧光染色;E~G:mlc2v、dapi、merge免疫荧光染色(比例尺=100 μm) A-D: Immunofluorescence of ctnt, α-actinin, dapi and the merge; E-G: Immunofluorescence of mlc2v, dapi and the merge (Scale bar=100 μm)图3 人诱导多能干细胞来源心肌细胞的鉴定Fig. 3 The identification of hiPSC-CM
同样方法对hiPSC-CM灌流含100 μmol/L阿托品的动作电位电极外液。膜片钳系统显示,加药后心肌细胞自发节律性动作电位频率明显增加(P=0.001)。动作电位波形无明显改变,去极化幅度(APA)、最大去极化速率(dV/dtmax)和90%动作电位时程(APD90)相比加药前无明显变化(图5,表2)。

A:对照组动作电位频率;B:500 μmol/L麻黄碱组动作电位频率;C:对照组单个动作电位波形;D:500 μmol/L麻黄碱组单个动作电位波形 A: The frequency of spontaneous action potential of the control group; B: The frequency of spontaneous action potential of the 500 μmol/L ephedrine group; C: Representative action potential trace of the control group; D: Representative action potential trace of the 500 μmol/L ephedrine group图4 麻黄碱对人诱导多能干细胞来源心肌细胞动作电位的影响Fig. 4 Effects of ephedrine on action potential of hiPSC-CM

A:对照组动作电位频率;B:100 μmol/L阿托品组动作电位频率;C:对照组单个动作电位波形;D:100 μmol/L阿托品组单个动作电位波形。 A: The frequency of spontaneous action potential of the control group; B: The frequency of spontaneous action potential of the 100 μmol/L atropine group; C: Representative action potential trace of the control group; D: Representative action potential trace of the 100 μmol/L atropine group.图5 阿托品对人诱导多能干细胞来源心肌细胞动作电位的影响Fig. 5 Effects of atropine on action potential of hiPSC-CM
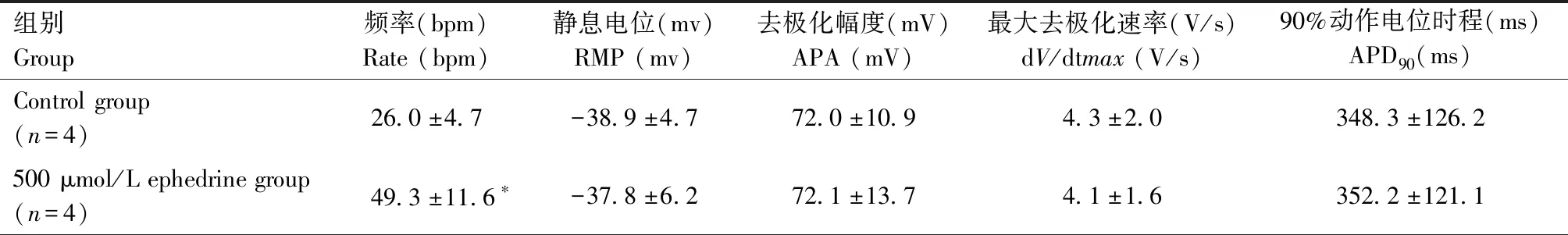
表1 500 μmol/L麻黄碱对hiPSC-CM动作电位的影响Table 1 Effect of 500 μmol/L ephedrine on action potential of hiPSC-CM
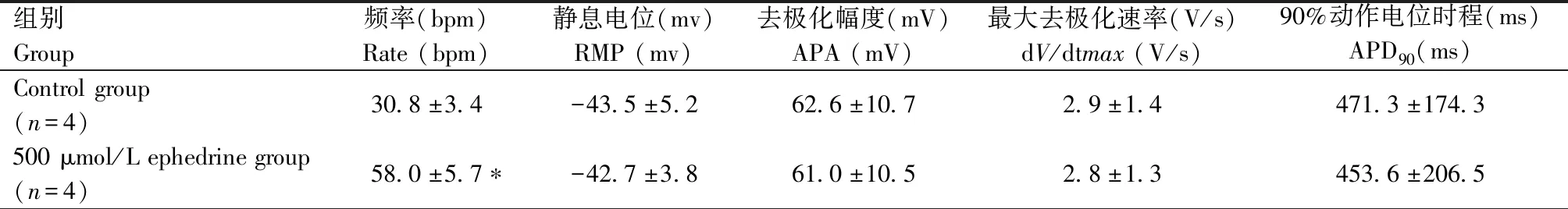
表2 100 μmol/L 阿托品对hiPSC-CM动作电位的影响Table 2 Effect of 100 μmol/L atropine on action potential of hiPSC-CM
3 讨论
本研究结果表明:所使用的hiPSC表达多能性标志,干性良好,经小分子诱导分化后获得的hiPSC-CM高表达ctnt、mlc2v等心肌细胞特异性标志物,且具有自发节律性动作电位。麻黄碱、阿托品可明显增加hiPSC-CM动作电位频率,而对RMP、APA、dV/dtmax、APD90无明显影响。
用于实验的hiPSC-CM均为分化大于30 d的细胞,Burridge等[12]认为hiPSC-CM随着培养时间的延长,心室肌细胞比例会逐渐增加,在肌原纤维、肌节形成以及电生理等方面均会趋近成熟。本研究对分化30 d得到的hiPSC-CM进行了形态学及电生理的鉴定,发现所得到的细胞高表达心室肌特异性标志物mlc2v,且动作电位有明显的2期平台期,与文献报道一致。但是,RMP、APA等与以往文献略有差异[13],分析后认为可能是以下原因:①所使用的iPSC细胞系不同;②记录时液面波动导致记录不稳定;③记录时间略长导致细胞活性略有下降。提示不同细胞系及实验时长可能会对实验结果造成影响。
麻黄碱、阿托品是临床常用的血管活性药物,通过激动心肌细胞肾上腺素能受体或抑制乙酰胆碱受体而发挥作用。在本实验中,我们观察到麻黄碱、阿托品使hiPSC-CM动作电位频率明显加快,但动作电位波形无明显变化,与Calvert等[14]及Gizurarson等[15]使用人或小鼠心肌细胞系观察到的实验结果相一致,提示hiPSC-CM具有良好的药物反应性,与在体心肌细胞相似。
综上所述,hiPSCs通过体外小分子分化,可获得大量心肌细胞,麻黄碱、阿托品能够明显加快hiPSC-CM自发动作电位频率,对动作电位波形无明显影响。本研究证明了hiPSC-CM具有良好的药物反应性,为hiPSC-CM的临床应用及相关药物治疗提供了证据。
