药食同源中药安全性研究进展
2020-07-18石镇港姜德建
石镇港 姜德建

〔摘要〕 “药食同源”是指既是食品又是中药材的物质。随着药食同源中药材广泛的应用,一部分中药材的潜在毒副作用也随之出现。基于此,对中华人民共和国国家卫生健康委员会公布的药食同源中药材进行安全性、不良反应等文献报道系统性筛查,对其中出现过不良反应报道的中药及其毒性成分进行进一步的文献检索,并按其毒性成分已知与否分类综述,以期对其用于食疗、保健以及安全性深入研究提供参考。
〔关键词〕 药食同源;毒副作用;安全性
〔中图分类号〕R28;R285.5;R965.3 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.06.026
〔Abstract〕 "Homology of medicine and food" means substances that are both food and Chinese medicinal materials. With the wide use of homology of medicine and food, the potential toxic and side effects of some medicinal materials also appear. So, in order to provide references for its in-depth research on diet therapy, health care and safety, the literature reports on the safety and adverse reactions of homology of medicine and food which were published by the National Health Commission of the People's Republic of China were systematically screened. Further literature retrieval was carried out on Chinese medicinal materials and their toxic components which had been reported as adverse reactions and the toxic components were classified according to whether its toxic components were known or not.
〔Keywords〕 homology of medicine and food; toxic side effects; safety
隨着国民生活质量的不断提高,越来越多的中药材被纳入“可用于保健食品的物品名单”,药食同源类中药广泛应用于生活中的各个方面,如:食品调料、保健品、茶饮类制品等,但随之而来的是许多报道[1-2]指出部分中药可能引发各种不良反应。现阶段,临床合理安全用药管理中,对毒性明显的药物高度重视,相反对于毒性不明显或具有潜在毒性的药物却没有给予足够的重视。因此,本文对中华人民共和国国家卫生健康委员会公布的药食同源目录[3-6]中中药材(见表1)进行安全性、不良反应等文献报道系统性筛查,对其中有不良反应报道的中药材进行进一步的文献检索并综述,希望能够为其安全性深入研究提供参考。
1 已知部分疑似内源毒性物质的中药品种
1.1 决明子
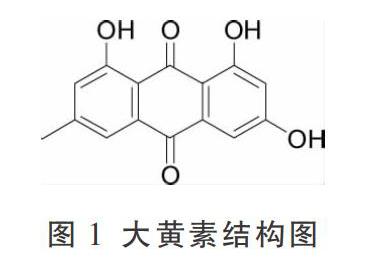
决明子是豆科植物决明(Cassia obtusifolia L.)或小决明(Cassia tora L.)的干燥成熟种子,常见食用方式为代茶饮、煮粥,具有降血脂、降血压、保肝明目、抑菌、抗氧化和泻下通便的功效[7]。在急性毒性实验研究中,一次性给予高剂量决明子醇提物(26.84~79.80 g/kg)、水提物(23.53~57.45 g/kg)会致使昆明种小鼠出现不同程度的肝、肾损伤[8]。对不同提取工艺的炒决明子提取物毒性研究表明,予以昆明种小鼠炒决明子醇提物(以生药计158.00 g/kg)、水提物(以生药计38.08 g/kg)后,小鼠出现BUN、CRE、ALT指标上升,并有间歇性扭体反应、大便溏薄、呼吸频率减慢、呼吸困难、精神萎靡不振、俯卧昏睡等急性毒性症状表现[9]。在亚慢性毒性实验中[10],研究人员予以Wistar大鼠决明子水煎液(以生药计0.315、1.575、3.150、6.300 g/kg)90 d后,发现各给药组大鼠均出现不同程度的肝细胞肿胀、空泡化、坏死、炎性细胞聚集;各给药组肾小管上皮细胞同样出现不同程度的细胞肿胀变形、炎性细胞聚集等现象。在研究决明子醇提物的亚慢性毒性研究中发现:长期食用混有较高剂量决明子醇提物(25 g/kg)饲料会对雄性实验动物的生殖系统产生影响,在病理组织检查中可见曲精小管萎缩,部分曲精小管内无精子、精细胞存在[11]。1961年Lerman[12]首次提出平面芳香稠环结构分子以嵌插方式与DNA结合,而蒽醌类化合物由于其平面刚性结构,可更易与DNA碱基相嵌合,从而影响基因的复制或表达,表现出细胞毒性[13]。蒽醌类化合物是决明子的主要成分,Qin对肝微粒体、大黄素(图1)体内氧化代谢途径及其羟基代谢产物的研究提示了蒽醌类物质的潜在肝毒性机制[14];羟基蒽醌类化合物会因其特殊的结构表现出明显的生殖毒性[13];提示蒽醌类化合物可能是决明子产生毒性的基础物质。
1.2 栀子
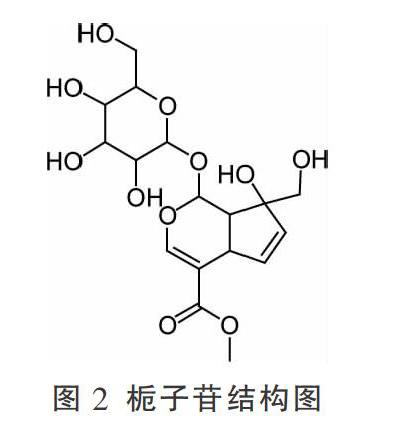
栀子(Gardenia jasminoides Ellis.)是茜草科植物栀子的干燥成熟果实,性寒,可化燥伤阴,伤及脾胃;归心、肺、三焦经,常见食用方式为代茶饮、煮粥、煮汤,常用于泻火除烦、清热利尿、凉血解毒等[15]。有研究表明[16],给予大鼠栀子水煎物(以生药计3.0 g/kg)后第1天动物出现大便溏稀、发黑现象;第4天动物普遍出现嗜睡、活动率降低、精神不振等症状;第6天出现动物死亡现象,大体解剖可见严重肠胃胀气,镜检可见胃黏膜明显损伤、坏死、出血等现象。栀子苷(图2)是栀子的主要有效成分之一,在研究栀子肝肾毒性实验中[17-18],予以大鼠大剂量栀子苷(0.28 g/kg)后出现动物背部脱毛、动物死亡现象,且病理学切片以及镜检结果均提示予以大剂量栀子苷后动物肝脏、肾脏出现损伤。此外,栀子苷在体内的水解产物京尼平以及京尼平与甘氨酸的结合产物栀子蓝是其产生毒性的重要物质[19]。表明栀子苷可能是栀子肝、肾毒性的基础物质。
1.3 薄荷
薄荷(Mentha haplocalyx Briq.)为唇形科植物薄荷的全草或叶,常见食用方式为代茶饮、煮粥、煮汤等,薄荷主要有效成分为挥发油,薄荷醇(图3)占挥发油含量的77%~78%,其次为薄荷酮、乙酸薄荷脂等[20]。有急性毒性研究表明[21],薄荷挥发油对小鼠LD50为1.49 mL/(kg·d),急性毒性实验给药后小鼠出现行动迟缓、翻正反射消失、呼吸急促、呕吐甚至死亡,解剖死亡小鼠可见肝脏出现不同程度的颜色变化,触摸可感觉肝脏表明光滑度下降。在薄荷不同组分“时-毒”关系比较研究中发现[22],给予薄荷挥发油(0.49 mL/kg)后,小鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)于给药12 h达到高峰期,给药4 h后解剖可见肝脏肿胀;薄荷水提组(32.0 g/kg)则是8 h后ALT、AST达到高峰期,2 h后解剖可见肝脏肿胀;“量-毒”关系研究表明,薄荷挥发油和水提组分对肝脏损伤程度与给药剂量呈正相关。另有报道表明[23],薄荷醇也具有许多不良反应,如口腔和鼻腔过敏反应、支气管痉挛、哮喘、紫斑、荨麻疹、接触性皮炎以及过敏性休克等,此外,薄荷醇还能影响中枢神经系统、呼吸系统、消化系统、心血管系统等,主要表现为精神错乱、肺损伤、哮喘、消化道刺激,提示薄荷挥发油可能是其肝、肾毒性以及其他副作用的物质基础。
1.4 白芷
白芷(Angelica dahurica(Fisch. ex Hoffm.)Benth. et Hook. f.)是伞形科(Umbelliferae)植物白芷的干燥根,常见食用方式为代茶饮、煮汤等,主要有效成分为香豆素类,如欧前胡素和异欧前胡素(图4),其次为挥发油、白芷酸等[24]。光毒性是指皮肤在一次性接触某种化学物质后暴露于紫外线照射下所引起红斑、水肿等的一种皮肤急性反应[25]。有研究表明[26],白芷香豆素中欧前胡素和异欧前胡素就具有明显的光毒性活性,这两种成分也是化妆品等外用品中的禁用品,但口服白芷正常剂量无明显毒性。《毒药本草》上提及[27],大量服用白芷(30~80 g)可引起强直性间歇性痉挛、惊厥,继而全身麻痹,甚至呼吸中枢麻痹致死;长期接触生白芷者也可能出现四肢等暴露部位出现红斑、浮肿、丘疹等中毒症状。
1.5 紫苏
紫苏(Perilla frutescens (L.) Britt.)是我国一种重要的经济作物,其叶与种子是常见的调味料,其常见食用方式为代茶饮、炒食等。许多体内和体外研究已经证明紫苏可以抑制IgE介导的反应[28-30],但在Jeong YY等[31]的报道中却显示出紫苏子诱导过敏的病例。在日本,过敏性接触性皮炎已成为长期与紫苏接触人群的一种职业病[32]。关于紫苏及紫苏籽的毒性研究报道较少,文莉[33]研究了紫苏挥发油的急性毒性,以一次性灌胃给药方式观察小鼠死亡率,LD50为以生药量计3.10 g/kg。在研究紫苏醇的细胞毒性研究中,Boon等[34]研究人员观察到,紫苏醇的活性代谢物紫苏醛(图5)体外200 μmmol/L便可引起PC12细胞凋亡,而代谢物紫苏酸(图5B)体外对细胞凋亡作用相对紫苏醇、紫苏醛则较低。
1.6 肉豆蔻
肉豆蔻(Myristica fragrans Houtt.)是一种常见的香料,常见食用方式为代茶饮、炒食,味辛、性温,归脾、胃、大肠经,常用于脾胃虚寒、久泄不止、脘腹胀痛、食少呕吐[35]。有报道表明大剂量(25~28 g)食用或药用肉豆蔻会出现心动过速、恶心、呕吐、激动和幻觉等毒副作用,10位受试者一次性服用400 mg肉豆蔻醚后,2名受试者出现欣快感,2名受试者出现焦虑、震颤、恶心、心动过速等反应[36-38]。其导致毒副作用的主要物质肉豆蔻醚(图6)是肉豆蔻挥发油中主要成分,肉豆蔻醚的代谢产物3-甲氧基-4,5亚甲二氧基苯丙胺(3-methoxy-4,5methylenedioxyamphetamine,MMDA)则是一种具有致幻作用的拟交感神经物质[29]。肉豆蔻中毒症状通常在摄入后3~6 h表现,并在24~36 h后消退[39-40]。
1.7 白果
白果为银杏科植物银杏(Ginkgo biloba L.)的干燥成熟种子,自古以来就是一种药食两用的药材,常见食用方式为代茶饮等,然而国内外因食用白果导致食物中毒的报道也时有出现。一名36岁的日本女性在食用经微波炉烹饪70~80个白果后4 h 出现频繁的呕吐和全身抽搐[41]。HPLC分析显示5名白果中毒患者的血清4'-O-甲基吡哆醇(MPN,也称银杏毒素,见图7)水平在240~1 280 ng/mL之间[42]。一名2岁的日本女孩在摄入50~60个烤白果后7 h 出现呕吐、腹泻和烦躁,并且在非热性惊厥后立即抽取血清中的MPN浓度为360 ng/mL(摄入后约9 h)[43]。另一名2岁大的日本男孩在吃了大约50个白果后4 h出现呕吐和无热惊厥,入院后12 h内其血清中MPN浓度为37~157 ng/mL,入院后18 h尿液中MPN浓度为397 ng/mL[44]。瑞士一名23个月大的男孩在食用未知量的白果后经历了两次无发热强直性癫痫发作,并通过测量血液和尿液中的MPN水平证实了中毒[45]。在对动物的急性毒性试验中也证实了白果急性中毒的主要物质为MPN[46]。其致使中毒的机制与MPN通过吡哆醛激酶抑制维生素B6的酶促活化导致维生素B6缺乏和γ-氨基丁酸(GABA)合成减少有关[47]。
1.8 鱼腥草
鱼腥草为三白草科植物蕺菜(Houttuynia cordata Thunb.)的新鲜全草或干燥地上部分,又名侧耳根、岑草等,味辛,微寒,归肺经,常见食用方式为炒食、代茶饮等,具有清热解毒、消肿疗疮、利尿除湿等功效[48]。《毒药本草》称鱼腥草毒性较低,但其也记载小鼠鱼腥草素灌胃的半数致死量为(1.6±0.081) g/kg;犬静脉滴注38~47 mg/kg,无动物死亡,静脉滴注剂量增加至61~64 mg/kg时,则出现动物死亡现象,解剖后可见肺脏有严重的出血与血栓。犬灌胃给予每日80~160 mg/kg,连续30 d,动物出现大量流涎现象,早期常出现呕吐症状[27]。臨床上鱼腥草注射液引起过敏反应的报道也时有发生[49],多在肌注后几分钟内出现过敏现象,严重时可发生过敏性休克。近年来对鱼腥草的成分研究[50]中发现其含有马兜铃内酰胺II(图8),而此类物质以及马兜铃酸具备一定的肾脏毒性,食用可能会致肾病或肾脏恶性肿瘤[51-52],尽管马兜铃酸与马兜铃内酰胺I均被证实对肾脏具有损伤作用,但对马兜铃内酰胺II的肾毒性研究仍然缺乏。
2 毒性物质未知的中药品种
2.1 夏枯草
夏枯草为唇形科植物夏枯草(Prunella vulgaris L.)的干燥果穗,常见食用方式为代茶饮、炒食等,主要化学成分为三萜皂苷,其苷元是齐墩果酸,花穗含飞燕草素和矢车菊素的花色苷等。夏枯草临床仅见过敏不良反应的报道,一般在服药后几分钟至1小时内发生,表现为胃部不适、恶心、呕吐、晕眩、心悸怔忡、腹痛腹泻等症状[53]。夏枯草含钾量高,不宜与保钾利尿药合用,以免出现高钾血症等副作用。
2.2 人参
人参(Panax ginseng C. A. Mey.)是常用的补益类中药,常见食用方式为代茶饮、泡酒、生食等。随着人参类制剂的滥用,临床上出现了许多不良反应报道[54],不良反应主要表现为呕吐、腹胀、腹痛、呼吸急促、气喘、面色潮红、心率失常、嗜睡、过敏反应、性早熟现象等。口服3%人参酊100 mL会致使轻度的不安与兴奋,服用超过200 mL的人参酊或人参粉则会出现中毒症状,如:失眠、抑郁、头痛、心悸、血压升高、体重减轻等[27]。
2.3 西红花
西红花为鸢尾科植物番红花(Crocus sativus L.)的干燥柱头,是一种名贵传统中药,常见食用方式为代茶饮、泡酒等,常用于冠心病、肝炎、肝硬化等。有文献报道[55],一名47歲女性每日以西红花0.2 g代茶饮,一个月后血脂检测发现ALT、AST、γ谷酰基转移酶水平升高,停用西红花一个月后再次检查,肝功能各指标恢复正常;一名52岁女性以西红花(0.2~0.3 g)与少量葛根配伍代茶饮,10个月后出现身体不适,肝功能指标异常升高,停用西红花、葛根后对症治疗,状况好转,两个月后复查,各项肝功能指标均恢复正常[55],提示西红花可能在一定程度上影响肝功能。在对西红花的肝毒性研究中,以西红花80、40、20 mg/mL浓度,每日灌胃给予大鼠0.1 mL/kg的剂量,连续6周,结果显示,西红花高剂量组的肝组织病理出现肝细胞排列紊乱、条索状结构消失等病理学改变[56],提示高浓度的西红花或其体内代谢产物会引起肝脏损伤。
3 结语
综上所述,药食同源并不意味着可以无节制地食用或滥用中药。同一种药材产地不同,其成分也会有所不同,且不同人群存在差异,不当地使用可能产生不良反应。因此,有必要对药食同源类中药其用量、产地、用法、禁忌以及安全性进行相关性研究,为改变大众“药食同源意味着无毒”的错误观念以及食疗和保健研究提供参考,更好地发挥我国药食同源中药的保健作用。
参考文献
[1] 易 艳,李春英,张宇实,等.3种中药注射剂类过敏反应评价及其机制探讨[J].中国中药杂志,2015,40(14):2711-2716.
[2] 梁爱华,易 艳,张宇实,等.中药注射剂的类过敏反应及其风险防控[J].中国药学杂志,2015,50(15):1301-1308.
[3] 中华人民共和国国家卫生健康委员会:既是食品又是药品的物品名单[EB/OL].[2002-03-04].http://www.nhc.gov.cn/wjw/gfxwj/201304/3312183b2f954e35a29c77921a88d730.shtml.
[4] 中华人民共和国国家卫生健康委员会:关于当归等6种新增按照传统既是食品又是中药材的物质公告[EB/OL].[2019-11-25].http://www.nhc.gov.cn/sps/s7885/202001/b941b6138e93414cb08aed926ca3c631.shtml.
[5] 中华人民共和国国家卫生健康委员会:按照传统既是食品又是中药材物质目录管理办法(征求意见稿)[EB/OL].[2018-07-04].http://so.kaipuyun.cn/s?qt=%E6%8C%89%E7%85%A7%E4%BC%A0%E7%BB%9F%E6%97%A2%E6%98%AF%E9%A3%9F%E5%93%81%E5%8F%88%E6%98%AF%E4%B8%AD%E8%8D%AF%E6%9D%90%E7%89%A9%E8%B4%A8%E7%9B%AE%E5%BD%95%E7%AE%A1%E7%90%86%E5%8A%9E%E6%B3%95%EF%BC%88%E5%BE%81%E6%B1%82%E6%84%8F%E8%A7%81%E7%A8%BF%EF%BC%89&siteCode=bm24000006&database=zcwj&noTools=true.
[6] 中华人民共和国国家卫生健康委员会:关于对党参等9种物质开展按照传统既是食品又是中药材的物质管理试点工作的通知[EB/OL].[2019-11-25].http://www.nhc.gov.cn/sps/s7885/202001/1ec2cca04146450d9b14acc2499d854f.shtml.
[7] 杨 冰,任 娟,秦昆明,等.决明子药理作用及其机制研究进展[J]. 中药材,2018,41(5):1247-1251.
[8] 黄娜娜,郭 欣,蔡涛涛,等.决明子不同提取物单次给药对小鼠肝、肾“量-时-毒”关系研究[J].中国药物警戒,2017,14(10):22-26.
[9] 葛俊德,黄娜娜,郭 欣,等.不同提取工艺对炒决明子急性毒性和物质基础的影响[J].药物评价研究,2019,42(4):641-647.
[10] 刘 飞,郭 换,梁乙川,等.基于降血脂功效的决明子安全性评价[J].中国实验方剂学杂志,2017,23(17):191-197.
[11] 高 芃,隋海霞,刘海波,等.决明子乙醇提取物的亚慢性毒性研究[J].中国食品卫生杂志,2004,16(5):410-415.
[12] LERMAN L S. Structural considerations in the interaction of DNA and acridines[J]. Journal of Molecular Biology, 1961, 3(1):18-30.
[13] 邹义英,李军生.决明子类保健食品的潜在安全风险分析[J].食品科技,2009,34(5):295-297.
[14] QIN B, XU Y, CHEN J, et al. Chemical reactivity of emodin and its oxidative metabolites to thiols[J]. Chemical Research in Toxicology, 2016,29(12):2114-2124
[15] 王清然,邓中平. 栀子肝脏毒性研究进展[J].中成药,2016,38(6):1351-1354.
[16] 刘江亭,李慧芬,崔伟亮.大剂量栀子水煎液对大鼠胃毒性研究[J]. 山东中医杂志,2013,32(4):276-277.
[17] 王 波,杨洪军,高双荣,等.栀子对大鼠肝肾毒性的病理学观察[J].中国实验方剂学杂志,2007,13(5):45-48.
[18] 杨洪军,付梅红,吴子伦,等.栀子对大鼠肝毒性的实验研究[J].中国中药杂志,2006,31(13):1091-1093.
[19] 卫璐戈,张海虹,李会芳.栀子苷、京尼平、栀子蓝的体内外肝毒性对比研究[J].中华中医药学刊,2019,37(2):311-314.
[20] 杨 倩.薄荷挥发油的化学型分析及抑菌、抗炎活性研究[D].南京:江苏大学,2017:1-68.
[21] 李晓宇,孙 蓉.薄荷不同组分对小鼠急性毒性实验比较研究[J].中国药物警戒,2012,9(2):65-68.
[22] 李晓宇,孙 蓉.薄荷不同组分单次给药对小鼠肝毒性“量-时-毒”关系比较研究[J].中国药物警戒,2012,9(3):129-133.
[23] 程阔菊,王 晖,陈 垦.薄荷醇的安全性研究进展[J].辽宁中医杂志,2010,37(2):377-380.
[24] 练有扬,杨 娜,赵雨晴,等.白芷的化学成分及药理活性研究进展[J].科学技术创新,2019(3):36-37.
[25] 国家食品药品监督管理总局.化妆品安全技术规范[S].北京:中华人民共和国食品药品监督管理总局,2015.
[26] 刘 硕,黄 霞,林 勇,等.口服白芷水提物对大鼠皮肤的光毒性作用[J].湖南农业大学学报(自然科学版),2018,44(4):424-429.
[27] 杨仓良.毒药本草[M].北京:中国中医药出版社,1998:189-190, 217-221,842-849.
[28] MAKINO T, FURUTA Y, FUJII H, et al. Effect of oral treatment of perilla frutescens and Its cvonstituents on type-I allergy in mice.[J]. Biological & Pharmaceutical Bulletin, 2001, 24(10):1206-1209.
[29] SANBONGI C, TAKANO H, OSAKABE N, et al. Rosmarinic acid in perilla extract inhibits allergic inflammation induced by mite allergen, in a mouse model[J]. Clinical and Experimental Allergy, 2004, 34(6):971-977.
[30] UEDA H, YAMAZAKI C, YAMAZAKI M. Luteolin as an anti-inflammatory and Anti-allergic constituent of perilla frutescens[J]. Biological & Pharmaceutical Bulletin, 2002, 25(9):1197-1202.
[31] JEONG Y, PARK H, CHOI J, et al. Two cases of anaphylaxis caused by perilla seed[J]. Journal of Allergy and Clinical Immunology, 2006, 117(6):1505-1506.
[32] KANZAKI T, KIMURA S. Occupational allergic contact dermatitis from Perilla frutescens [J]. Contact Dermatitis, 2010, 26(1):55-56.
[33] 文 莉.湖北紫蘇叶挥发油的小鼠急性毒性试验[J].中国药师, 2006,9(11):1034-1035.
[34] BOON P J M, BOON D V D, MULDER G J. Cytotoxicity and biotransformation of the anticancer drug perillyl alcohol in PC12 cells and in the rat[J]. Toxicology & Applied Pharmacology, 2000, 167(1):55-62.
[35] 马 存,冼少华,相 雨,等.肉豆蔻药理作用研究进展[J].中国现代中药,2017,19(8):1200-1206.
[36] QUIN G I, FANNING N F, PLUNKETT P K. Nutmeg Intoxication[J]. Journal of Accident & Emergency Medicine, 1998, 15(4):287-288.
[37] CARSTAIRS S D, CANTRELL F L. The spice of life: An analysis of nutmeg exposures in California[J]. Clinical Toxicology, 2011, 49(3):177-180.
[38] FORRESTER, MATHIAS B. Nutmeg intoxication in texas, 1998-2004[J]. Human & Experimental Toxicology, 2005, 24(11):563-566.
[39] SANGALLI B C, SANGALLI B, CHIANG W. Toxicology of nutmeg abuse[J]. Clinical Toxicology, 2000, 38(6):671-678.
[40] FORREST J E ,HEACOCK R A . Nutmeg and mace, the psychotropic spices from myristicafragrans[J]. Lloydia, 1972, 35(4):440-449.
[41] HASEGAWA S, ODA Y, ICHIYAMA T, et al. Ginkgo nut intoxication in a 2-Year-Old male[J]. Pediatric Neurology, 2006, 35(4):0-276.
[42] DI LORENZO C, CESCHI A, COLOMBO F, et al. Identification and quantification of biomarkers to confirm thepoisoning by ginkgo biloba seeds in a 2-year-old boy[J]. Toxicology Research, 2015(4):922-930.
[43] JANG H S, ROH S Y, JEONG E H, et al. Ginkgotoxin induced seizure caused by vitamin B6 deficiency[J]. Journal of Epilepsy Research, 2015, 5(2):104-106.
[44] 钱怡云.白果复合毒性物质基础及其减毒机制研究[D].南京:南京中医药大学,2017:1-175.
[45] MIZUNO N, KAWAKAMI K, MORITA E. Competitive inhibition between 4\"-substituted pyridoxine analogues and pyridoxal for pyridoxal kinase from mouse brain.[J]. Journal of Nutritional Science and Vitaminology, 1980, 26(6):535-543.
[46] ECKHARD L, CHRISTEL D. Ginkgo biloba and ginkgotoxin[J]. Journal of Natural Products, 2010, 73(1):86-92.
[47] KOBAYASHI D, YOSHIMURA T, JOHNO A, et al. Decrease in pyridoxal-5′-phosphate concentration and increase in pyridoxal concentration in rat plasma by 4′-O-methylpyridoxine administration[J]. Nutrition Research, 2015, 35(7):637-642.
[48] 刘 敏,蔣跃平,刘 韶.鱼腥草中生物碱类化学成分及其生物活性研究进展[J].天然产物研究与开发,2018,30(1):141-145,133.
[49] 周冠强,李元峰,张肇勋.鱼腥草注射液致过敏反应63例文献分析[J].中国药房,2013,24(36):3436-3439.
[50] 丁 超.鱼腥草食用习惯与慢性肾脏疾病的横断面研究[J].生物加工过程,2019,17(2):189-194.
[51] LORD G M, COOK T, ARIT V M, et al. Urothelial malignant disease and Chinese herbal nephropathy[J]. The Lancet, 2001,358:1515-1516.
[52] LAING C, HAMOUR S, SHEAFF M, et al. Chinese herbaluropathy and nephropathy[J]. The Lancet, 2006,368:338.
[53] 丁 涛.中草药不良反应及防治[M].北京:中国中医药出版社, 1992:105.
[54] 吴海鹏,许海燕.人参对小儿的不良反应[J].中医临床与保健,1992(4):49.
[55] 王瑜真,孙守祥.西红花致不良反应2例[J].中国中药杂志,2008(18):2146.
[56] 汪 云,李红霞,朱丽影.藏红花对大鼠肝毒性的实验研究[J].哈尔滨医科大学学报,2010,44(2):133-135,138.
