基于网络药理学的左金丸治疗胃癌作用机制研究
2020-07-18黄钲凯梁明坤吴发胜陆飞国陈广文梁健
黄钲凯 梁明坤 吴发胜 陆飞国 陈广文 梁健


〔摘要〕 目的 基于网络药理学方法探讨左金丸治疗胃癌的作用机制。方法 利用TCMSP数据库获得左金丸所含中药的化学成分及对应作用靶点基因,检索GeneCards和OMIM数据库获得疾病胃癌相关靶点基因,然后取两者的交集,得到左金丸作用于胃癌的预测靶基因;利用Cytoscape 3.7.1 软件构建左金丸化合物-作用靶点-疾病三者相互关系网络,采用STRING数据库对左金丸作用于胃癌的预测靶基因进行蛋白互作网络分析,利用Cytoscape3.7.1 软件的插件cytohubba筛选出关键靶基因,并利用ONCOMINE数据库分析关键靶基因在胃癌中的表达情况;利用在线工具DAVID进行GO功能富集分析并利用Cytoscape3.7.1软件的ClueGO插件进行KEGG通路富集分析。结果 共筛选出左金丸作用于胃癌的预测靶基因68个,关键靶基因15个,这些关键基因在ONCOMINE数据库的胃癌样本和正常样本中的表达存在显著性差异。GO功能富集分析显示,左金丸作用于胃癌的预测靶基因主要涉及对有机物质的反应、细胞凋亡的负调控、细胞程序性死亡的负调控等生物过程;KEGG通路富集分析主要涉及癌症通路、p53信号通路、VEGF信号通路等。结论 本研究初步揭示了左金丸治疗胃癌的主要作用靶点及多靶点、多维调控、协同作用、整体调节的作用机制,可为后续进一步深入研究其作用機制提供参考。
〔关键词〕 左金丸;胃癌;网络药理学;信号通路
〔中图分类号〕R285.5;R96;R735.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.06.014
〔Abstract〕 Objective To study the mechanism of Zuojin Pills in the treatment of gastric cancer based on network pharmacology. Methods Chemical constituents and corresponding action target genes of Chinese materia medica in Zuojin Pills were obtained from TCMSP database, while GeneCards and OMIM database was retrieved for the target genes of gastric cancer. Then the intersection of the 2 groups of genes were taken to get the predicted target gene of Zuojin Pills acting on gastric cancer. Cytohubba, the plug-in of Cytoscape3.7.1 software was used to screen out key target genes. And the ONCOMINE database was used to analyze the expression of key target genes in gastric cancer. Gene ontology (GO) enrichment analysis was conducted by DAVID online tool and kyoto encyclopedia of genes and genomes (KEGG) pathway analysis was carried out using Cytoscape3.7.1 software. Results A total of 68 target genes and 15 key genes were screened for Zuojin Pills in the treatment of gastric cancer. There were significant differences in the expression of these key genes in gastric cancer samples and normal samples in ONCOMINE database. GO functional enrichment analysis showed that Zuojin Pills acting the predicted target gens of gastric cancer involved in a series of biological process, such as response to organic substance, negative regulation of apoptosis, negative regulation of programmed cell death, etc. KEGG pathway enrichment analysis mainly involved pathways in cancer, p53 signaling pathway, VEGF signaling pathway, etc. Conclusion This study preliminarily revealed the main targets of Zuojin Pills in the treatment of gastric cancer, and the action mechanism of multi-target, multi-dimensional regulation, synergistic effect and overall regulation, which can provide beneficial thinking for further deeper study on its action mechanism in the furture.
〔Keywords〕 Zuojin Pills; gastric cancer; network pharmacology; signaling pathway
胃癌(gastric cancer)是起源于胃上皮的肿瘤。胃癌在世界上最常见恶性肿瘤中排名第五,肿瘤相关死亡中排名第三,5年生存率仅为29%[1-3]。近年来虽然胃癌的总体发病率正在下降,但其在所有恶性肿瘤中,发病率仍居第二位,仅次于肺癌[4-5]。胃癌化疗和放疗效果欠佳[6],手术仍是其治疗的重要手段,但遗憾的是大多数患者发现已是晚期,预后较差[7]。中医药治疗胃癌有自己的特色与优势,中医药在协同增效、降低西药毒性、提高患者生存质量等方面发挥重要的作用,越来越受到人们的重视[8-9]。左金丸是经典方剂,由黄连和吴茱萸组成,近年来不少研究表明左金丸有较好的抗胃癌作用[10-12]。
网络药理学综合了系统生物学、生物信息学、药理学等多个学科的技术和知识,可构建药物的“成分-靶标-通路-疾病”网络,从整体水平、分子层面及多靶点、多通路深入探索药物与疾病的关系,是研究药物治疗机制的一种新的有效手段[13-14],将该技术与方法引入中医药研究,从中药研究、复杂疾病治疗等生命科学的海量数据中,挖掘、发现、阐释其中所包含生物学意义[15],可弥补传统研究模式“一病一靶一药”的不足,有助于从整体水平、分子层面全面深入阐明中药多成分、多途径、多靶点的综合作用,从而为中医药研究提供新的思路。鉴于此,本研究借鉴系统生物学技术,采用网络药理学技术与方法,探索分析左金丸治疗胃癌的潜在作用靶点和可能的分子机制,以期为后续研究及临床应用提供理论依据。
1 材料与方法
1.1 左金丸的化学成分及作用靶点筛选
将左金丸所含中药黄连和吴茱萸以完整拼音的形式输入网络在线数据库TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)进行检索,根据口服生物利用度(oral bioavailability,OB)≥30%、类药性(druglikeness,DL)≥0.18的标准,筛选出左归丸所含中药化合物,并通过查阅相关文献与数据库逐一核对验证化合物的结构等基本信息,确保化合物分子的准确无误;然后在TCMSP数据库检索上述筛选出的左归丸化合物对应的相关作用靶点,并将其转换为官方基因名。
1.2 疾病胃癌靶点筛选
通过检索 Genecards数据库(https://www.genecards.org/)和OMIM数据库(https://www.omim.org/search/advanced/geneMap)筛选疾病胃癌相关靶点基因,建立胃癌靶点数据集。
1.3 网络的构建及分析
将筛选出的左金丸的作用靶点与获取的胃癌的疾病靶点,利用网络在线工具Venny2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图,进行Venn分析,得到交集的共同靶点基因,即为左金丸作用于胃癌的预测靶基因。利用Cytoscape3.7.1软件构建左金丸化合物-作用靶点-胃癌三者相互关系网络。采用在线工具STRING(http://string-db.org)构建左金丸作用于胃癌的靶点蛋白相互作用(protein protein interaction, PPI)网络。将蛋白种类参数设置为“人类”,最低相互作用阈值设为中等(>0.7),其他参数采用默认设置,获得蛋白相互作用网络。并将该蛋白相互作用网络导入Cytoscape 3.7.1的软件中,利用该软件的插件cytohubba,根据网络拓扑结构筛选关键靶基因,并利用ONCOMINE数据库分析关键靶基因在胃癌中的表达情况。
1.4 基因本体(gene ontology,GO)功能富集分析
使用网络在线工具DAVID(https://david.ncifcrf.Gov)的“functional annotation”模块进行GO功能富集分析。将获得的左金丸作用于胃癌的预测靶基因导入在线的DAVID数据库,选择物种参数为“homo sapiens”,選择标识符参数为“official gene symbol”,选择列表类型参数为“gene list”,其余参数为默认值,然后提交获取GO功能富集结果。
1.5 京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)通路富集分析
利用Cytoscape 3.7.1软件的插件ClueGO对左金丸作用于胃癌的预测靶基因进行KEGG通路富集分析,设置参数为P<0.05,获得左金丸治疗胃癌的显著富集的信号通路。
2 结果
2.1 左金丸化学成分及作用靶点筛选
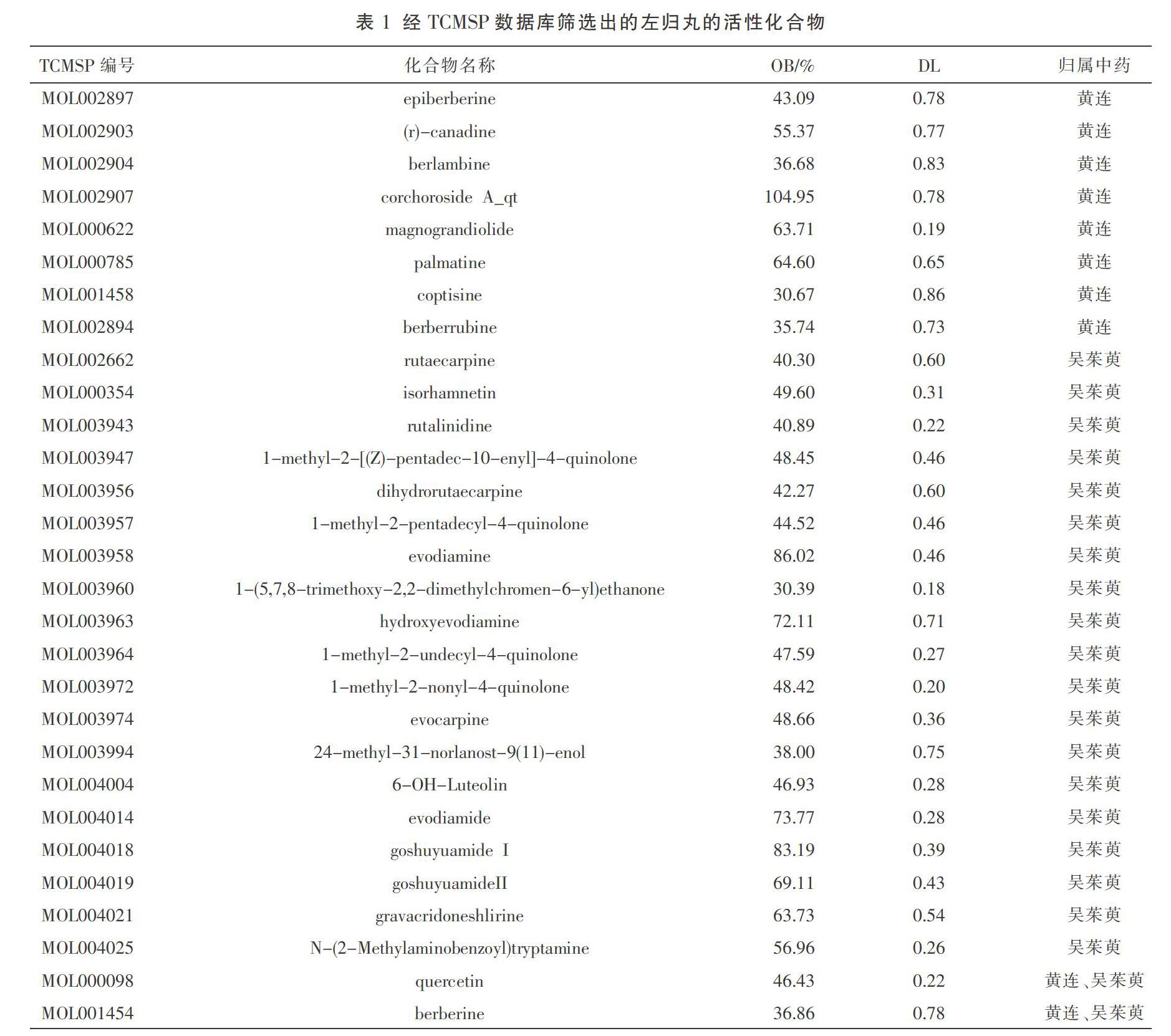
检索TCMSP数据库,初步获得左金丸所含中药黄连的化合物14个,作用靶点223个;吴茱萸的化合物30个,作用靶点449个;汇总并去重后,最终获得左金丸的化合物共29个,其中黄连独有的化合物8个,吴茱萸独有的化合物19个,黄连与吴茱萸共同含有的化合物2个,见表1。去除重复项和非人种属靶点,最终获得左金丸的作用靶点共96个,其中黄连32个,吴茱萸64个,黄连与吴茱萸的共同作用靶点25个;然后运用Uniprot数据库和NCBI数据库将上述筛选的作用靶点转换校正为官方基因名。
2.2 疾病胃癌靶点的筛选
检索GeneCards数据库,并以relevance score≥5的标准筛选出胃癌的靶点基因共2 110个;检索OMIM数据库得到胃癌的靶点基因共240个。将两个数据库的胃癌的靶点基因合并去重后,最终获得胃癌靶点基因共2 260个。
2.3 网络的构建及分析
将左金丸靶点基因与胃癌靶点基因数据导入在线软件Venny 2.1.0绘制韦恩图。通过韦恩图(见图1)分析发现,左金丸靶点与胃癌靶点交集靶点基因共68个,左金丸作用于胃癌靶基因映射率为3%,提示左金丸存在确切防治胃癌的作用靶点,对胃癌具有一定特异性的防治作用。利用Cytoscape 3.7.1软件构建左金丸的化合物-作用靶点-疾病(胃癌)三者相互关系网络,见图2。该网络图生动明了地展示了左金丸的各成分、各靶点之间的相互联系及多成分、多靶点相互作用的复杂网络关系,充分体现了左金丸治疗胃癌多途径、多环节、多靶标、协同作用、整体调节的作用特点。
2.4 靶点蛋白相互作用网络(PPI网络)构建及关键靶点筛选
本研究使用在线工具STRING构建蛋白相互作用网络(PPI网络),见图3。在此基础上,利用Cytoscape 3.7.1的软件的cytohubba插件,通过Degree、EPC、BottleNeck等12种网络结构和节点间加权重联系的计算分析算法,根据得分筛选出15个关键靶基因:MYC、CASP9、CASP3、EGFR、CCND1、VEGFA、CASP8、ESR1、FOS、ERBB2、AR、IL6、CCNB1、RB1、PGR,见图4。提示这些基因在该网络中发挥了关键作用,可能是左金丸治疗胃癌的关键靶点。同时,利用ONCOMINE数据库获得上述关键靶基因在正常样本和胃癌样本中的表达情况(见图5)。从图5中可看出,15个关键靶基因在正常样本和胃癌样本中的表达存在显著性差异(P<0.05),表明这些关键靶基因与胃癌的发生发展存在一定联系。
2.5 GO功能富集分析
GO功能富集分析涵盖生物学3个方面的内容:细胞组分(cellular component)、分子功能(molecular function)、生物过程(biological process)。本研究采用网络在线工具DAVID对获得的左金丸作用于胃癌的预测靶基因进行GO功能富集分析,结果共获得679个功能富集,其中生物过程575个,细胞组分46个,分子功能58个,然后再依据P<0.05的基准,选取GO富集的前15位,进行可视化展示。GO功能富集分析提示,左金丸作用于胃癌的靶基因的生物过程主要涉及对有机物质的反应(response to organic substance)、细胞凋亡的负调控(negative regulation of apoptosis)、細胞程序性死亡的负调控(negative regulation of programmed cell death)等;细胞组分主要涉及微粒体(microsome)、细胞溶质(cytosol)、细胞内膜系统(endomembrane system)等;分子功能主要涉及配体依赖的核受体活性(ligand-dependent nuclear receptor activity)、类固醇结合(steroid binding)、转录因子活性(transcription factor activity)等,见图6-8。
2.6 KEGG通路富集分析
采用Cytoscape 3.7.1软件的ClueGO插件对左归丸作用于胃癌的预测靶基因进行KEGG通路富集并进行可视化处理,设置参数P<0.05,共获得61个通路富集,按照P值排序,排除明显无关通路后,排名靠前的主要涉及癌症通路(pathways in cancer)、p53信号通路(p53 signaling pathway)、VEGF信号通路(VEGF signaling pathway)等,表明左金丸治疗胃癌的作用可能与上述通路有关。见图9-10。
3 讨论
左金丸出自著名医家朱丹溪之《丹溪心法·火方》,方中黄连六两、吴茱萸一两,常用于胃部疾病[16]。现代研究显示左金丸可抑制胃癌细胞增殖,且抑制作用呈浓度-时间依赖关系[17-18]。左金丸的主要活性成分吴茱萸碱和盐酸小檗碱等可诱导胃癌细胞凋亡[19-21],吴茱萸碱和小檗碱可以通过阻滞胃癌细胞周期、抑制血管形成等发挥抗胃癌效应[22-24]。以上相关研究均表明,左金丸具有较好的抗胃癌作用,但与其相关的分子机制仍待研究。
本研究采用网络药理学方法,探讨左金丸治疗胃癌的分子机制,结果显示:左金丸所含化学成分的作用靶点基因有96个,检索相关数据库获得胃癌靶点基因共2 260个,左金丸靶点与胃癌靶点交集靶点基因共68个。同时,我们发现,左金丸每味中药存在多个化学活性成分,每个中药化学成分可作用于多个靶点,同一靶点可参与不同的信号通路及生物学过程,各个化学成分之间存在着密切的网络药理联系,各靶标之间也存在相互作用关系。充分体现了左金丸多靶点、多途径、多效应、协同作用、整体调节的作用特点。通过对68个交集靶基因进一步筛选,获得了关键靶基因共15个:MYC、CASP9、CASP3、EGFR、CCND1、VEGFA、CASP8、ESR1、FOS、ERBB2、AR、IL6、CCNB1、RB1、PGR。其中MYC基因是较早发现的一组癌基因,包括C-myc,N-myc,L-myc。研究表明C-myc在胃癌的生长、迁移、凋亡方面发挥着重要的作用[25-27]。C-myc基因与DDX6基因有协同作用,在胃癌细胞中起癌基因的作用,促进胃癌的发展[28]。C-myc启动子与ISL1结合可激活胃癌细胞中C-myc的表达,从而促进胃癌细胞增殖[29]。有多项研究表明Caspase-9与胃癌的发生发展密切相关[30-32]。此外,研究证实Caspase-3、Caspase-9的异常表达参与胃癌的发生、发展,两者起正协同作用[33]。Caspase-9是细胞线粒体依赖的凋亡途径中重要起始因子,Caspase-9的表达降低,使该凋亡途径受到抑制,细胞凋亡异常,从而导致胃癌的发生[34]。
此外,本研究的KEGG通路富集分析结果显示,左金丸作用于胃癌的靶点主要涉及癌症通路、p53信号通路、VEGF信号通路等。p53是公认的肿瘤抑制基因,在细胞周期调控、DNA损伤修复、细胞分化和凋亡中发挥重要作用[35]。有研究表明miR-18a可通过靶向结合IRF2抑制p53信号通路,促进胃癌细胞的增殖、转移和侵袭[36];此外,另一项研究提示miR-30可能作为一种致癌miRNA通过调节p53途径调控线粒体凋亡[37];可见p53信号通路在胃癌中扮演重要角色,这与本研究通路富集结果提示左金丸主要通过干预p53信号通路等发挥抗癌作用是一致的,同时上述这些既往研究也在一定程度上证明了本研究结果的可靠性。
本研究从网络药理学角度,初步揭示左金丸治疗胃癌的主要作用靶点及多靶点、多维调控、协同作用的分子机制,为后续进一步深入研究其作用机制奠定了基础。但是,本研究主要基于网络药理学和生物信息学数据库资料,因而存在一定的局限性,后续将在此基础上,进行相关实验验证,以进一步阐释左金丸抗胃癌的作用机制。
参考文献
[1] 林果为,王吉耀,葛均波.实用内科学[M].15版.北京:人民卫生出版社,2017:1519.
[2] MACHLOWSKA J, MACIEJEWSKI R, SITARZ R. The pattern of signatures in gastric cancer prognosis[J]. International Journal of Molecular Sciences, 2018, 19(6): 1658-1664.
[3] AHMAD S A, XIA B T, BAILEY C E, et al. An update on gastric cancer[J]. Current Problems in Surgery, 2016, 53: 449-490.
[4] CHEN W, SUN K, ZHENG R, et al. Cancer incidence and mortality in China, 2014[J]. Chinese Journal of Cancer Research, 2018,30(1):1-12.
[5] ZHENG R, ZENG H, ZHANG S, et al. Estimates of cancer incidence and mortality in China, 2013[J]. Chinese Journal of Cancer Research, 2017, 36(1): 66.
[6] OZDEN S, OZGEN Z, OZYURT H, et al. Survival in gastric cancer in relation to postoperative adjuvant therapy and determinants[J]. World Journal of Clinical Cases, 2015, 3(1): 42-51.
[7] NAKAMURA T, OLNUMA T, YAMAGISHI H, et al. Evaluation of a novel high-resolution magnifying video endoscope that is capable of photodynamic diagnosis and therapy for gastric cancer[J]. Photodiagnosis and Photodynamic Therapy, 2014, 20: 135-142.
[8] 劉沈林.中医药治疗胃癌临床述评[J].江苏中医药,2019,51(4):1-5.
[9] 田劭丹,陈信义.中医药治疗恶性肿瘤特色与优势[J].现代中医临床,2019,26(2):8-17.
[10] 孙梦瑶,王丹丹,吴秋雪,等.左金丸对胃癌耐药细胞SGC-7901/DDP增殖和糖酵解的抑制作用[J].上海中医药大学学报,2019,33(1):71-75.
[11] PENG Q X, CAI H B, PENG J L, et al. Extract of Zuojin Pill induces apoptosis of SGC-7901 cells via mitochondria-dependent pathway[J]. Chinese Journal of Integrative Medicine, 2015, 21(11): 837-845.
[12] 张彦博,李 琦,刘艳娜,等.左金丸通过Wnt/β-catenin信号通路对幽门螺杆菌感染的人胃癌细胞转移的影响[J].上海中医药大学学报,2015,29(2):44-47.
[13] ZUO J, WANG X, LIU Y, et al. Integrating network pharmacology and metabolomics study on anti-rheumatic mechanisms and antagonistic effects against methotrexate-Induced toxicity of Qing-Luo-Yin[J]. Frontiers in Pharmacology, 2018, 9: 1472-1487.
[14] YANG M, CHEN J, XU L, et al. A network pharmacology approach to uncover the molecular mechanisms of herbal formula Ban-Xia-Xie-Xin-Tang[J]. Evidence-based Complementary and Alternative Medicine, 2018, 2018: 4050714.
[15] 王程成,封 亮,刘 丹,等.结合生物信息学的中药组分结构研究思路[J].中国中药杂志,2015,40(22):4514-4519.
[16] 叶乃菁,刘 宣,李 琦.左金丸及其活性成分抗胃癌的实验研究进展[J].中华中医药杂志,2014,29(4):1162-1164.
[17] 彭求贤,余惠旻,胡胜全,等.左金丸诱导人胃癌细胞SGC-7901凋亡的研究[J].江苏中医药,2009,41(4):70-71.
[18] 湯庆丰,刘 宣,葛 艳,等.左金丸醇提物抑制幽门螺旋杆菌感染人胃癌细胞增殖及诱导凋亡的实验研究[J].重庆医学,2012,41(15):1462-1464.
[19] ZHU L H, BI W, LIU X D, et al. Induction of apoptosis by evodiamine involves both activation of mitotic arrest and mitotic slippage[J]. Oncology Reports, 2011, 26(6): 1447-1455.
[20] HUANG H, ZHANG Y, LIU X, et al. Acid sphingomyelinase contributes to evodiamine-induced apoptosis in human gastric cancer SGC-7901 cells[J]. DNA and Cell Biology, 2011, 30(6):407-412.
[21] 周红祖,徐丽霞,余惠旻,等.左金方、黄连、吴茱萸诱导人胃癌细胞SGC-7901凋亡的作用比较[J].药物分析杂志,2015,31(2):1160-1165.
[22] LIN J P, YANG J S, LEE J H, et al. Berberine induces cell cycle arrest and apoptosis in human gastric carcinoma SNU-5 cell line[J]. World Journal of Gastroenterology, 2006, 12(1): 21-28.
[23] RASUL A, YU B, ZHONG L, et al. Cytotoxic effect of evodiamine in SGC-7901 human gastric adenocarcinoma cells via simultaneous induction of apoptosis and autophagy[J]. Oncology Reports, 2012, 27(5): 1481-1487.
[24] LIN S, TSAI S C, LEE C C, et al. Berberine inhibits HIF-1alpha expression via enhanced proteolysis[J]. Molecular Pharmacology, 2004, 66(3): 612-619.
[25] BA M, LONG H, YAN Z, et al. BRD4 promotes gastric cancer progression through the transcriptional and epigenetic regulation of c-MYC[J]. Journal of Cellular Biochemistry, 2018, 119(1): 973-982.
[26] 冯海一,张友波,李柱虎.C-myc基因及蛋白在木脂素对人胃癌MGC-803细胞抗增殖过程中的作用[J].时珍国医国药,2015,26(2):381-383.
[27] YANG D D, CHEN Z H, YU K, et al. METTL3 promotes the progression of gastric cancer via targeting the MYC pathway[J].frontiers in Oncology, 2020, 10: 115-123.
[28] TANIGUCHI K, IWATSUKI A, SUGITO N, et al. Oncogene RNA helicase DDX6 promotes the process of C-myc expression in gastric cancer cells[J]. Molecular Carcinogenesis, 2018, 57(5):579-589.
[29] SHI Q, WANG W, JIA Z, et al. ISL1, a novel regulator of CCNB1, CCNB2 and C-myc gene, promotes gastric cancer cell proliferation and tumor growth[J]. Oncotarget, 2016, 7(24): 36489-36500.
[30] 杨 静,程 玉,王明娟,等.Caspase-3、Caspase-9在胃癌组织中的研究进展[J].承德医学院学报,2016,33(6):506-509.
[31] 文亚渊,刘宝华,付 涛.基因Survivin、Caspase-9在胃癌组织中的表达及其与胃癌发生的关系[J].中国肿瘤临床,2005,32(17):969-972.
[32] PARK I C, PARK M J, HWANG C S, et al. Mitomycin C induces apoptosis in a caspase-dependent and Fas/CD95-independent manner in human gastric adenocarcinoma cells[J]. Cancer Letters, 2000, 158(2): 125-132.
[33] 杨 静.凋亡相关基因Caspase-3、Caspase-9和c-IAP1在胃腺癌组织中的表达及意义[D].承德:承德医学院,2017.
[34] 潘 科,卢书明,于劲达,等.胃癌及癌前病变细胞凋亡与caspase-9、Bax的关系[J].现代肿瘤医学,2010,18(2):317-319.
[35] 张 健,王 冬,于景翠.胃癌中miRNA功能相关的信号通路[J].中国肿瘤生物治疗杂志,2017,24(11):1331-1335.
[36] CHEN Y J, WU H, ZHU J M, et al. MicroRNA-18a modulates P53 expression by targeting IRF2 in gastric cancer patients[J]. Journal of Gastroenterology and Hepatology, 2015,31(1): 155-163.
[37] WANG J, JIAO Y, CUI L, et al. MiR-30 functions as an oncomiR in gastric cancer cells through regulation of P53-mediated mitochondrial apoptotic pathway[J]. Bioscience Biotechnology and Biochemistry, 2016, 81(1): 119-126.
