金橘中金橘苷的纯化工艺
2020-07-18黄华花王明军吕诗诗王圣江王晓莹
黄华花,王明军,吕诗诗,王圣江,王晓莹
厦门市中药生物工程重点实验室/福建省中药精加工与健康产品开发重点研究室/厦门医学院药学系(厦门 361023)
金橘是芸香科植物金橘[Fortunella margarita(Lour.)Swingle]的成熟果实,药食同源,应用广泛,常鲜食,也可制成果脯、罐头、果糕、果汁饮料等食用[1-4],甚至被开发成保健食品如金桔利口酒、金枣丹、金桔咀嚼片等[5-7],金橘是一种具有很大开发潜力的药用保健资源。现代研究表明[8-12],金橘具有抗炎镇痛、化痰止咳、调节免疫、预防结石、解酒保肝、调节胃肠运动等作用,黄酮为其活性部位[13-14],但具体的活性成分尚不明确,限制了金橘的深度开发利用。金橘苷仅在金橘中有过报道,为黄酮类成分,且含量最高,可能为金橘的活性成分。在前期对金橘中金橘苷的提取工艺进行研究基础上,试验采用硅胶柱色谱法对金橘苷进行分离纯化,在单因素考察基础上,以金橘苷提取率和纯度为考察指标,以洗脱剂比例、上样量、硅胶量、柱直径为考察因素,利用Box-Behnken响应面法对金橘苷的纯化工艺进行优化,该工艺可为金橘的深度研究及产业化应用提供技术参考和依据。
1 材料
1.1 材料与试剂
金橘,采集于广西桂林阳朔,由厦门医学院药学系鲍红娟副教授鉴定为Fortunella margarita(Lour.)Swingle的干燥成熟果实。切片,去核,阴干,粉碎,过60目筛,备用。
金橘苷对照品(批号Q14M10Q73839,纯度>98%,上海源叶生物科技有限公司);柱层析硅胶(100~200目,青岛海洋化工有限公司);氯仿、甲醇、磷酸(均为分析纯);乙腈(色谱纯);超纯水。
1.2 仪器与设备
H-Class超高效液相色谱仪(美国Waters公司);KQ5200E型超声波清洗器(昆山市超声仪器有限公司);CPA225D、BS224S型电子天平(德国Sartorius公司)。
2 方法与结果
2.1 金橘苷纯化
2.1.1 粗品的制备
取金橘粉末40 g,按料液比1∶50(g/mL)加入90%甲醇,超声(功率900 W,频率40 kHz)处理30 min,滤过,浓缩至100 mL,即得。
2.1.2 纯化方法
精密吸取一定体积的2.1.1的粗品于蒸发皿中,按1∶0.3(mL/g)的比例加入硅胶,混匀,蒸干,粉碎,得负载样品硅胶。称取一定量硅胶(100~200目),湿法装入一定直径的层析柱内,干法上样,加入大量一定比例的洗脱剂进行洗脱,按相同体积将洗脱液收集于事前已编好号的收集瓶内,回收溶剂,作为过柱后的各供试品。
2.2 金橘苷的含量测定
2.2.1 对照品溶液的制备
取金橘苷对照品适量,精密称定,加90%甲醇溶解并制成质量浓度0.262 5 mg/mL的对照品贮备液。吸取对照品贮备液4 mL置于25 mL量瓶中,加90%甲醇定容至刻度,摇匀,即得对照品溶液。
2.2.2 供试品溶液的制备
过柱前的供试品溶液的制备。取2.1.1的粗品0.5 mL,置于10 mL量瓶中,加90%甲醇定容至刻度,摇匀,即得。
过柱后的供试品溶液的制备。取2.1.2的供试品,精密加入90%甲醇1.5 mL溶解,滤过,即得。
2.2.3 色谱条件

图1 UPLC色谱图
色谱柱,Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm);流动相,乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~5 min,15% A→45% A;5~8 min,15% A);流速0.3 mL/min;检测波长333 nm;进样量2 μL。在此色谱条件下,理论板数按金橘苷计不低于5 000,相邻峰间分离度均大于1.5,基线分离良好,色谱图见图1。
2.2.4 线性关系考察
精密吸取2.2.1的对照品贮备液1,2,4,8和16 mL稀释至25 mL,得系列标准品溶液。按2.2.3的色谱条件进样分析,以峰面积对质量浓度(mg/mL)进行回归分析,得回归方程为Y=1.453×107X+1.088×104,r=0.999 9,线性范围为10.5~168.0 μg/mL。
2.3 金橘苷提取率和纯度计算
将2.2.2的各供试品溶液按2.2.3的色谱条件进样分析,按面积归一化法,将纯度大于60%的各供试品溶液合并,计算提取率和纯度。

式中:m为过柱后合并的纯度大于60%的供试品溶液中金橘苷质量,mg;M为过柱前的供试品溶液中金橘苷质量,mg。
金橘苷的纯度为合并的纯度大于60%的供试品溶液按2.2.3的色谱条件进样分析后,通过积归一化所得的纯度。
2.4 单因素设计试验
2.4.1 洗脱剂对金橘苷提取率和纯度的影响
精密吸取2.1.1的粗品2 mL,共5份,分别置于蒸发皿中,按1∶0.3(mL/g)的比例加入硅胶,混匀,蒸干,粉碎,得负载样品硅胶。称取10 g硅胶,共5份,分别湿法装柱(柱直径1.5 cm),干法上样,分别以氯仿-甲醇-水比例(1∶1∶0.1,2∶1∶0.1,3∶1∶0.1,4∶1∶0.1和5∶1∶0.1)进行洗脱,按相同体积收集洗脱液,回收溶剂,按2.2.2的方法制备过柱后的供试品溶液,按2.2.3的色谱条件进样分析,记录峰面积并计算金橘苷提取率和纯度,结果见图2。随着洗脱剂中氯仿比例增加,金橘苷提取率和纯度均不断增加,其中洗脱剂比例1∶1∶0.1时,金橘苷提取率和纯度均很低,洗脱剂比例5∶1∶0.1时金橘苷提取率和纯度与比例4∶1∶0.1时差异不大,但洗脱速度很慢,消耗大量洗脱剂,因此确定洗脱剂比例2∶1∶0.1,3∶1∶0.1和4∶1∶0.1作为响应面的3个水平。
2.4.2 上样量对金橘苷提取率和纯度的影响
分别精密吸取2.1.1的粗品1.5,2.0,2.5,3.0和3.5 mL共5份,置于蒸发皿中,按1∶0.3(mL/g)的比例加入硅胶,混匀,蒸干,粉碎,得负载样品硅胶。称取10 g硅胶,共5份,湿法装柱(柱直径1.5 cm),分别将上述样品干法上样,加入氯仿-甲醇-水比例3∶1∶0.1的洗脱剂进行洗脱,按相同体积收集洗脱液,回收溶剂,分别按2.2.2的方法制备过柱后的供试品溶液,按2.2.3的色谱条件进样分析,记录峰面积并计算金橘苷提取率和纯度,结果见图3。随着上样量增加,金橘苷提取率和纯度先增加后降低,且在上样量2.5 mL时,达到最高值,因此确定上样量2.0,2.5和3.0 mL作为响应面的3个水平。

图2 洗脱剂对金橘苷提取率和纯度的影响

图3 上样量对金橘苷提取率和纯度的影响
2.4.3 硅胶量对金橘苷提取率和纯度的影响
精密吸取2.1.1的粗品2 mL,共5份,分别置于蒸发皿中,按1∶0.3(mL/g)的比例加入硅胶,混匀,蒸干,粉碎,得负载样品硅胶。分别称取5.0,7.5,10.0,12.5和15.0 g硅胶,湿法装柱(柱直径1.5 cm),干法上样,加入氯仿-甲醇-水比例为3∶1∶0.1的洗脱剂进行洗脱,按相同体积收集洗脱液,回收溶剂,分别按2.2.2的方法制备过柱后的供试品溶液,按2.2.3的色谱条件进样分析,记录峰面积并计算金橘苷提取率和纯度,结果见图4。随着硅胶量增加,金橘苷提取率和纯度先增加后降低,且在硅胶量10 g时,达到最高值,因此确定硅胶量7.5,10.0和12.5 g作为响应面的3个水平。
2.4.4 柱直径对金橘苷提取率和纯度的影响
精密吸取2.1.1的粗品2 mL共5份,分别置于蒸发皿中,按1∶0.3(mL/g)的比例加入硅胶,混匀,蒸干,粉碎,得负载样品硅胶。称取10 g硅胶5份,湿法装于直径分别为1,1.5,2.0,2.5和3.0 cm的层析柱内,干法上样,加入氯仿-甲醇-水比例3∶1∶0.1的洗脱剂进行洗脱,按相同体积收集洗脱液,回收溶剂,分别按2.2.2的方法制备过柱后的供试品溶液,按2.2.3的色谱条件进样分析,记录峰面积并计算金橘苷提取率和纯度,结果见图5。随着柱直径增加,金橘苷提取率和纯度逐渐降低,因此确定柱直径1.0,1.5和2.0 cm作为响应面的3个水平。

图4 硅胶量对金橘苷提取率和纯度的影响
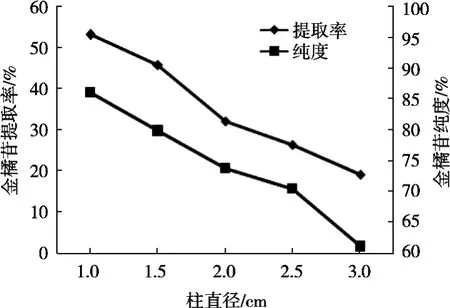
图5 柱直径对金橘苷提取率和纯度的影响
2.5 Box-Behnken试验设计及结果
2.5.1 Box-Behnken试验设计
以单因素考察为基础,确定了考察因素及各因素的取值,见表1。根据Box-Behnken进行响应面试验设计,方案及结果见表2。
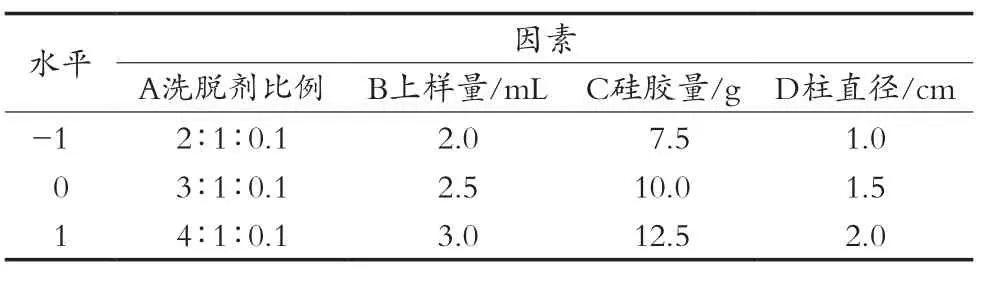
表1 因素与水平
2.5.2 综合评分的计算
将表2中金橘苷提取率X1、金橘苷纯度X2的数据进行线性插值处理Z=(X-Xmin)/(Xmax-Xmin)后计算综合评分Y,结果见表3。

式中:Z1为金橘苷提取率变换后的指标值;Z2为金橘苷纯度变换后的指标值。
2.5.3 响应面模型的建立及方差分析
运用Design Expert 8.0.6进行回归分析,拟合得到综合评分(Y)对A(洗脱剂比例)、B(上样量)、C(硅胶量)和D(柱直径)的回归方程为:Y=0.73+0.21A-0.046B+0.11C-0.11D+0.020AB-0.087AC-0.15AD-0.041BC+0.056BD+7.283×10-3CD-0.078A2-0.052B2-0.11C2-0.14D2。对该模型进行方差分析,结果见表4。
由表4可知,该模型差异极显著(p<0.000 1),失拟项不显著(p=0.102 6,p>0.05),R2=0.932 8,说明该模型拟合程度好,回归方程适合用于检验结果。回归方程各项方差分析表明,一次项A、C、D的影响极显著(p<0.01),B的影响不显著;二次项C2、D2的影响极显著(p<0.01),A2的影响显著(p<0.05),B2的影响不显著;交叉项AD的影响极显著(p<0.01),AC的影响显著(p<0.05),AB、BC、BD、CD的影响不显著。由F可知,4个因素对Y的影响大小依次为:A>D>C>B。通过舍去不显著项得到优化模型方程为Y=0.73+0.21A+0.11C-0.11D-0.087AC-0.15AD-0.078A2-0.11C2-0.14D2。
2.5.4 交互效应分析
为进一步考察4个因素中交互作用对综合评分的影响,运用Design Expert 8.0.6软件绘制三维曲线图,其中AC、AD之间的交互作用对综合评分的影响显著,与方差分析的结论相一致,见图6。
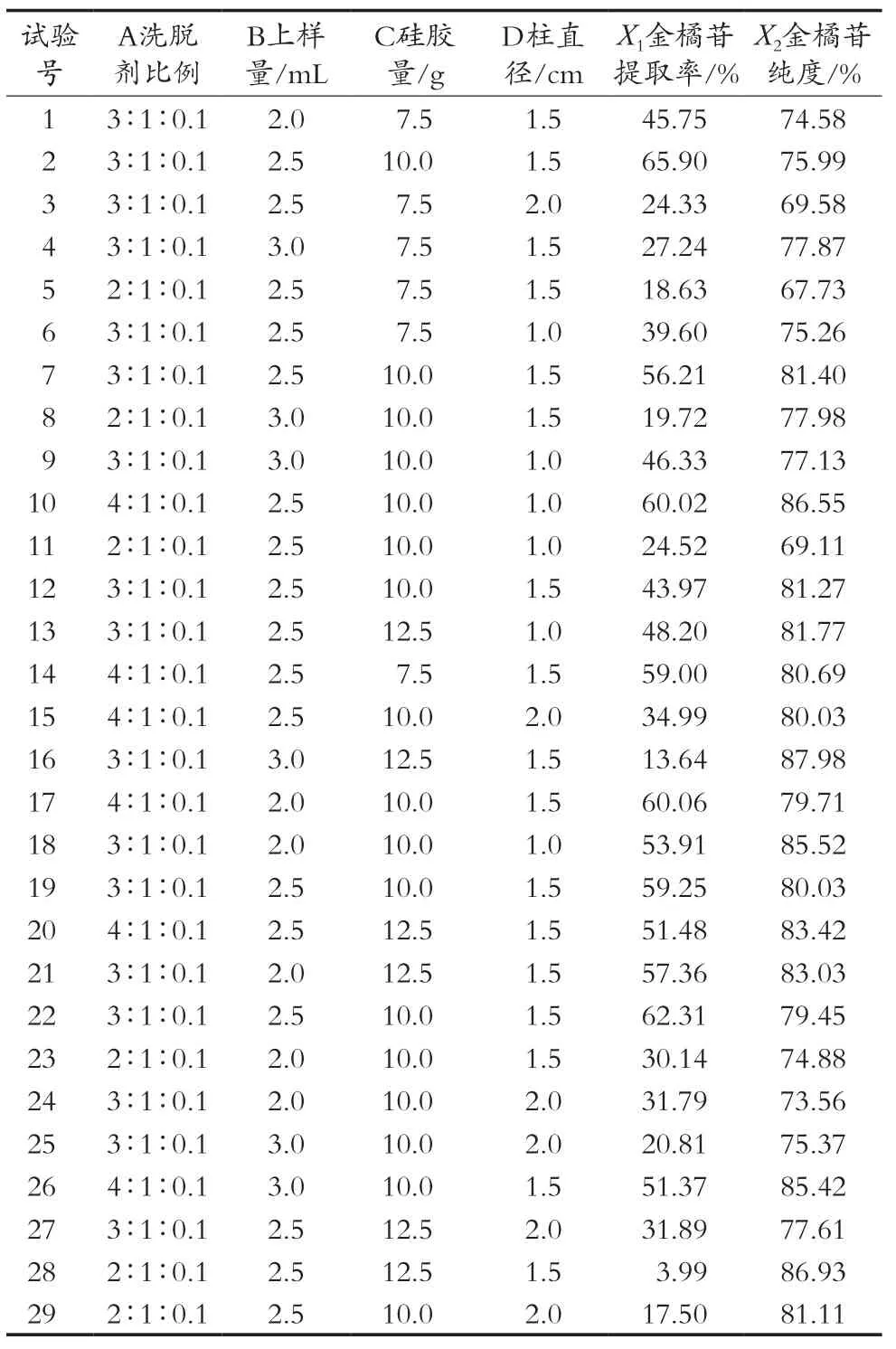
表2 响应面试验设计及结果
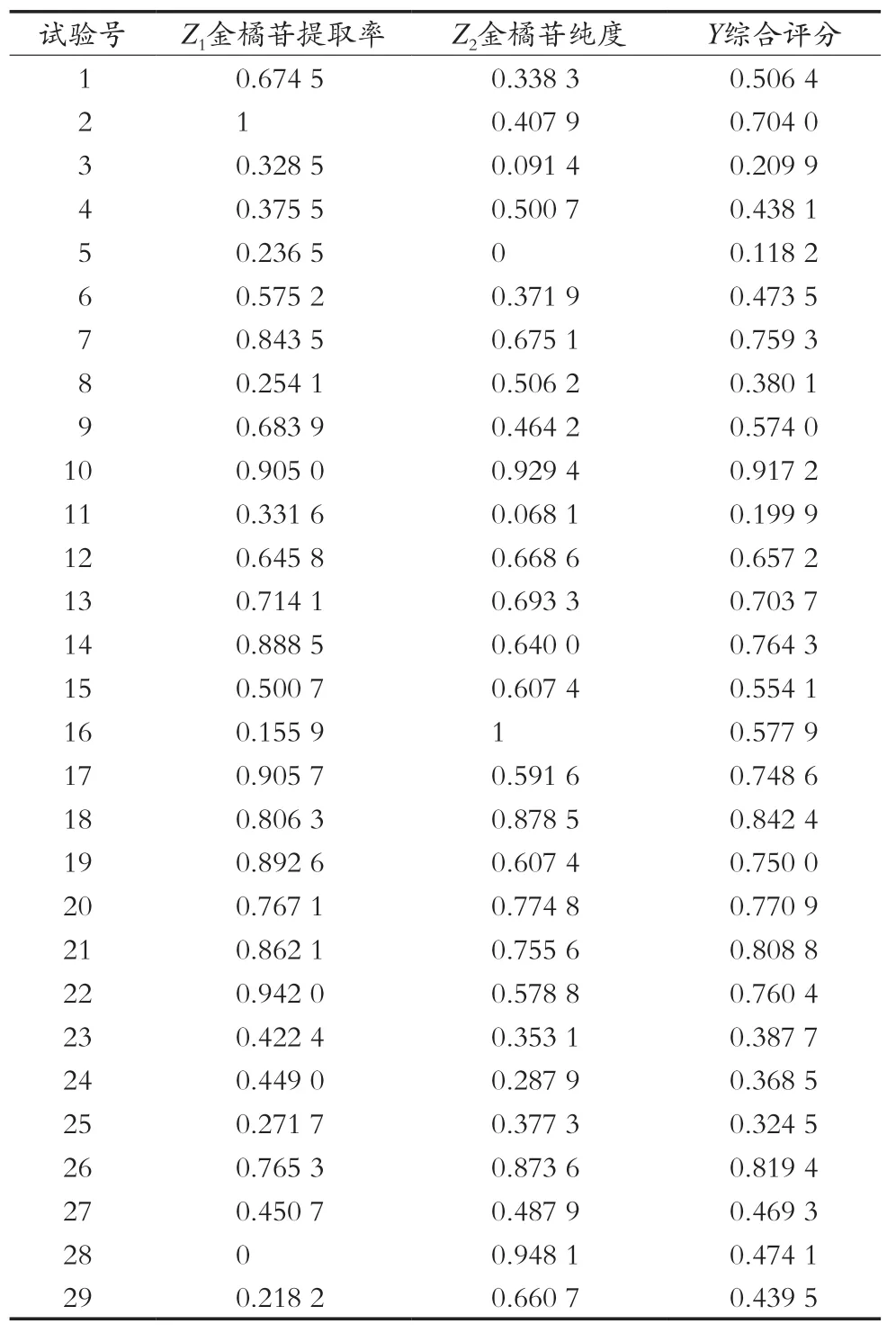
表3 变换后的指标值及综合评分

表4 回归模型的显著性检验及方差分析
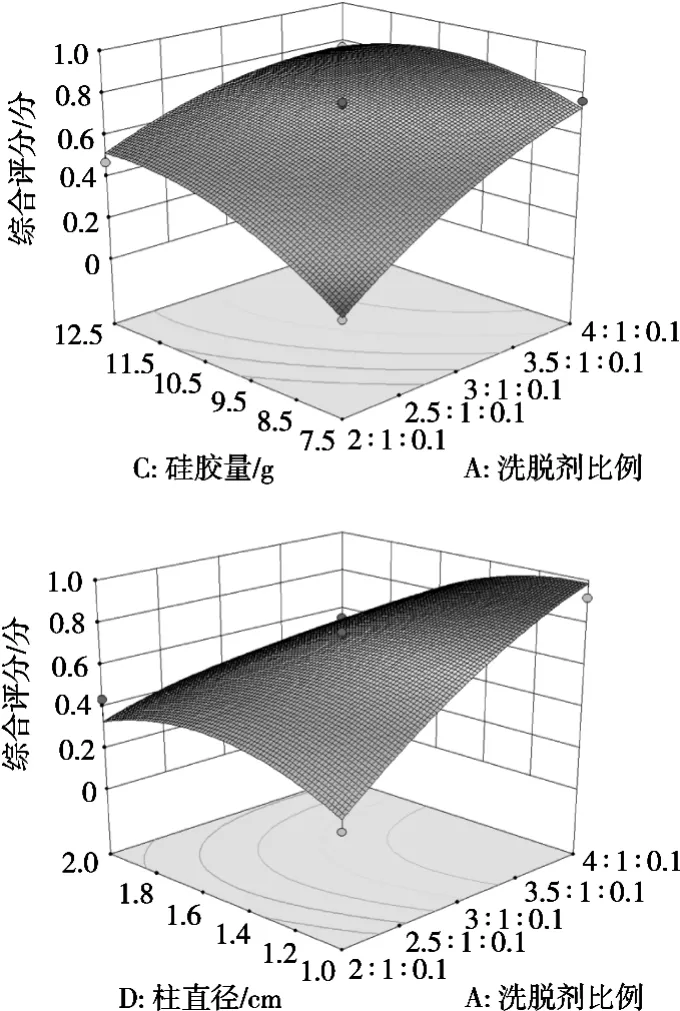
图6 交互效应图
2.5.5 最佳工艺条件的确定与验证
Design Expert 8.0.6软件分析得到金橘苷的最佳纯化条件为洗脱剂比例4∶1∶0.1、上样量2.06 mL、硅胶量10.56 g、柱直径1 cm,在此条件下,金橘苷取率和纯度的综合评分为1.023 4。为检验所得工艺的可靠性,进行验证试验。为了实际操作方便,对验证时的工艺条件四舍五入得洗脱剂比例4∶1∶0.1、上样量2.1 mL、硅胶量10.6 g、柱直径1 cm,在此条件下进行3次平行试验,具体结果见表5。由结果可知,测得的金橘苷提取率和纯度的综合评分为1.000 5(RSD=1.09%,n=3),与预测值相比偏差为2.24%,二者比较接近,表明模型合理可靠,预测性好,可以采用此工艺对金橘苷进行纯化。

表5 验证试验结果(n=3)
3 结论与讨论
3.1 结论
试验以单因素考察为基础,利用响应面法设计优化金橘苷的纯化工艺,得到4个因素对金橘苷提取率和纯度影响的大小依次为:洗脱剂比例>柱直径>硅胶量>上样量。优化所得最佳纯化工艺条件为:氯仿-甲醇-水4∶1∶0.1、上样量2.1 mL、硅胶量10.6 g、柱直径1 cm。此工艺稳定、可靠,可较好地纯化金橘苷,为金橘的深度研究及产业化应用提供技术参考和依据。
3.2 讨论
3.2.1 粗品制备方法的确定
前期已对金橘中金橘苷的提取工艺进行了研究,以甲醇浓度、提取温度、提取时间和料液比为考察因素,采用响应面法优化金橘苷的提取工艺,所优化的提取工艺条件为:甲醇体积分数90%、料液比1∶50(g/mL)、超声提取30 min、提取温度25 ℃。因此,试验以此条件进行粗品的制备。
3.2.2 硅胶目数的考察
在预试验中,考察硅胶目数对金橘苷分离效果的影响,分别以100~200、300~400目硅胶为填料进行金橘苷的纯化。结果发现,采用300~400目硅胶为填料时,洗脱剂的流速非常慢,洗脱时间长,且金橘苷提取率和纯度与采用100~200目硅胶为填料时差异不大,因此,试验采用100~200目硅胶为填料进行金橘苷的纯化。
3.2.3 拌样硅胶量的确定
在预试验中,考察湿法上样和干法上样的效果,发现干法上样金橘苷的纯化效果较好,对干法上样时拌样硅胶量进行考察,分别考察1∶0.1,1∶0.3和1∶0.5(mL/g)的拌样硅胶量。结果发现,拌样硅胶量1∶0.1时,负载样品硅胶太硬,粉碎困难,且损失较大,而拌样硅胶量1∶0.5时,上样后样品层太厚,纯化效果差,因此,试验最终确定1∶0.3的拌样硅胶量。
