子宫颈微偏腺癌4例临床病理分析
2020-07-18出树强陈玮姗陈少华徐艳娟黄种心
出树强,陈玮姗,陈少华,徐艳娟,晋 龙,黄种心
子宫颈微偏腺癌(minimal deviation adenocarcinoma MDA)又叫恶性腺瘤,是一种分化良好的胃型黏液腺癌。MDA非常少见,在所有子宫颈腺癌中仅占1%~3%[1]。最常见的临床症状为阴道出血或黏液样物,最常见的体征为子宫颈肥大,因肿瘤病灶位置较深且病理形态分化良好,常规检查无特异性表现,因此临床和病理误诊率、漏诊率均较高[2]。MDA比普通型子宫颈腺癌预后更差,侵袭性更强[3],临床和病理医师需加强对该病的认识,才能准确诊断该肿瘤。本文报道4例子宫颈MDA,并结合相关文献探讨其临床病理学特征、免疫表型、诊断和鉴别诊断等,以期提高对该肿瘤的认识。
1 材料与方法
1.1 材料收集福建医科大学附属第二医院、福建省泉州市第一医院2006年1月~2019年10月收治的4例子宫颈MDA,HE切片及免疫组化切片均由两位高年资病理医师复阅确认;同时收集患者的临床、影像学资料并进行随访。
1.2 方法所有标本均经10%中性福尔马林固定,常规脱水、石蜡包埋、切片、HE染色。免疫组化染色采用EnVision法,DAB显色,苏木精复染。一抗包括Ki-67、MUC6、CK7、CEA、p53、p16、ER、PR。所选抗体及试剂盒均为即用型,均购自福州迈新公司。
2 结果
2.1 临床特征4例患者年龄33~52岁,平均42岁。有阴道出血史者2例,黏液样白带增多者2例。妇科检查4例患者均表现为子宫颈肥大,其中1例子宫颈外口见菜花状肿物。影像学检查中,4例妇科彩超均未发现子宫颈病变,1例通过MRI可见子宫颈占位性病变(图1)。4例病理诊断均为MDA,其中1例伴中分化胃型腺癌。肿瘤最大径2~6.2 cm,平均4.4 cm。3例行全子宫+双侧附件+双侧盆腔淋巴结清扫术,术后辅助放疗;余1例因拒绝行手术治疗,仅行活检+放疗+化疗。4例患者随访时间12~40个月,在随访时间内2例未发现复发和转移,其中1例33岁患者在术后3年转移至右侧盆腔壁;另1例未行根治性手术患者随访1年后出现膀胱转移(表1)。

图1 MRI示子宫颈占位性病变
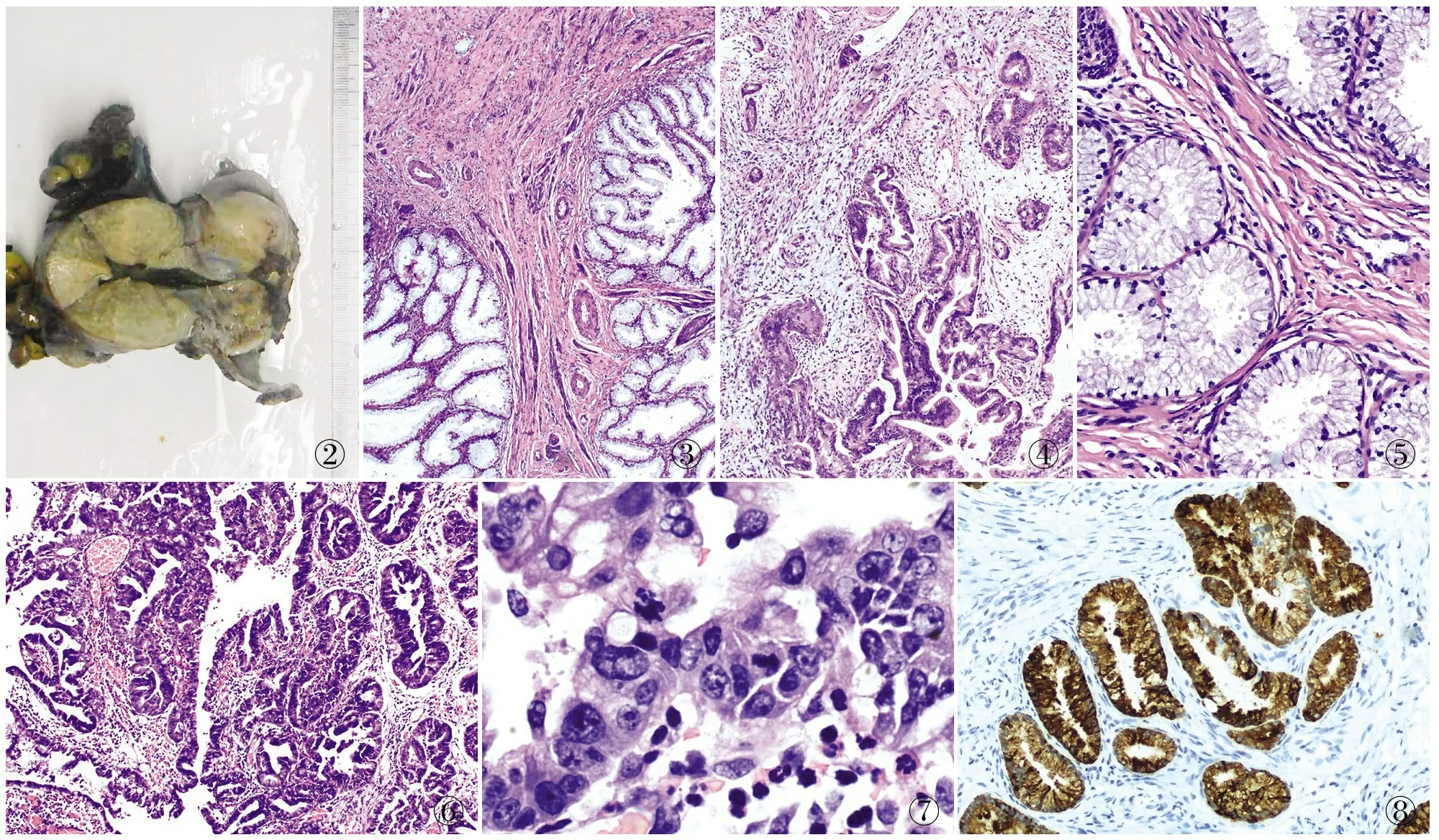
2.2 眼观4例患者子宫颈外观均明显肥大,外翻呈桶状或拳头状(图2)。3例表面黏膜光滑;1例轻度糜烂,可见一菜花状肿物。切面均呈灰白色,质地较硬,可见黏液。
2.3 镜检4例镜下形态大致相同。肿瘤腺体由黏液腺上皮细胞构成,位于子宫颈黏膜下,向深层呈浸润性生长(图3),3例浸润至子宫颈纤维肌壁深层,1例浸润子宫颈全层,并累及左右子宫旁组织;肿瘤腺体形状多样,2例呈圆形、卵圆形,2例成角、扭曲状(图4);腺上皮细胞分化良好,均为高柱状,核位于基底部,无明显核仁,核分裂象罕见(图5);肿瘤周边均可见明显促纤维结缔组织反应和轻微的炎症细胞浸润。其中例2大部分区域分化良好(MDA区域),局灶区域异型明显(胃型腺癌区域),异型明显区域腺体大小不等,呈乳头状、管状或筛状(图6),胞质可见黏液,胞质嗜酸或淡染,核大,呈泡状核,核仁明显,核质比增高,核分裂象易见(图7)。
2.4 免疫表型4例MDA腺上皮MUC6(图8)、CK7、CEA、p53均阳性,Ki-67增殖指数10%~30%,而p16、ER、PR均阴性;其中例2胃型腺癌区域Ki-67增殖指数达80%,其余免疫表型同MDA区域。
3 讨论
MDA于1870年由Gusserow首次报道,并命名为恶性腺瘤。1975年Silverberg和Hurt[4]重新定义该疾病,并将其称为子宫颈MDA。WHO(2003)女性生殖系统肿瘤分类首次命名该肿瘤,并将MDA归类为子宫颈黏液腺癌的特殊亚型,WHO(2014)女性生殖系统肿瘤分类新增胃型黏液腺癌亚型,并将MDA定义为分化极好的胃型黏液腺癌[3]。由于MDA极少见,目前该肿瘤的发病机制尚不明确,多数研究认为MDA的发病与HPV感染无关[5];有研究发现MDA患者常合并有Peutz-Jeghers综合征,两者可能由同一种基因突变引起[6];也有学者研究发现MDA常伴有小叶状宫颈管腺体增生,两者具有相似的临床和组织学特征,以及相似的分子遗传学特征[7],因而推测小叶状宫颈管腺体增生可能是MDA的癌前病变。
3.1 临床特征MDA好发于中年女性,平均发病年龄42岁。常无特征性临床表现和检查方法。临床症状主要为阴道出血或黏液样物;体征主要为子宫颈肥大,可达正常子宫颈的数倍[8]。影像学检查中,MRI推荐为首选检查方法,可见子宫颈肥大以及子宫颈深层间质内有多囊性损害,肿物在T1W1呈低信号,T2W2呈高信号[9-10]。本组病例特征与文献报道基本一致。值得注意的是,本组4例患者术前彩超均未发现子宫颈明显占位病变,其中1例行子宫颈MRI进一步检查提示恶性可能。因此,对于阴道出血或多量排液而常规检查无异常的患者可建议行MRI检查。

表1 4例子宫颈微偏腺癌的临床资料
②③④⑤⑥⑦⑧
3.2 组织病理学特征MDA大体观察表现为子宫颈明显肥大,呈桶状扩张,表面可见较多黏液或出血。镜下可见MDA由黏液腺上皮细胞组成,常浸润子宫颈深层间质,肿瘤腺体形态多样,呈卵圆形、扭曲状、乳头状、小巢片状等;肿瘤细胞多呈高柱状,胞内含丰富黏液,核位于基底层,无明显核仁,核分裂象罕见,异型性小;肿瘤周边可见间质反应。本组4例患者子宫颈均明显肥大,2例肿瘤腺体分化良好,1例轻度异型,另一例与胃型腺癌相混合,其中MDA区域分化良好,胃型腺癌区域异型明显。目前国内外仅2篇文献[11-12]报道MDA伴胃型腺癌,McCluggage等[12]认为MDA和胃型腺癌具有相似的分子遗传学特点,这两种形态本质上均属于胃型腺癌,只不过分化程度及生长方式不同。需特别注意的是,子宫颈内膜隐窝、隧道样腺丛等子宫颈良性病变亦可深入到子宫颈深层间质,需与MDA具有欺骗性的镜下形态相鉴别,有学者认为如果子宫颈腺体浸润超过上皮下(>5 mm),恶性肿瘤的可能大,李彦敏等[13]通过研究亦发现子宫颈粗针穿刺活检深度(>5 mm),有助于MDA的早期诊断。
3.3 免疫表型和黏液染色由于MDA的组织形态学具有欺骗性,常导致误、漏诊,因此需联合免疫组化和黏液染色协助诊断。免疫表型:MDA通常表达幽门腺黏液标志物MUC6和HIK1083,并表达CK7、p53和CEA,且Ki-67增殖指数高于正常子宫颈腺体,但p16与普通型子宫颈腺癌弥漫阳性相反,MDA通常呈阴性或局灶阳性[14]。MDA肿瘤细胞内黏液与正常子宫颈腺上皮相反,MDA腺体主要分泌中性黏液及少量酸性黏液,阿利新蓝-过碘酸雪夫(AB/PAS)黏液染色有助于鉴别,MDA腺体呈红色,而正常子宫颈腺体呈紫色[15]。本组病例MUC6、CK7、CEA和p53均阳性,Ki-67增殖指数10%~30%,与上述研究结果一致。
3.4 鉴别诊断(1)子宫颈高分化腺癌:腺体结构紊乱,存在腺体背靠背或共壁现象,肿瘤细胞异型明显,免疫组化p16常阳性,MUC6阴性。MDA腺体结构异型小,无共壁现象,肿瘤细胞核质比低,细胞异型性小,核分裂象罕见,免疫组化标记p16阴性或斑驳阳性,MUC6弥漫阳性。(2)子宫颈良性腺体增生:如小叶状子宫颈腺体增生、子宫颈腺体隧道样腺丛等。腺体主要集中在子宫颈表面,缺乏浸润特征,腺体结构和细胞无异型,且Ki-67增殖指数低。(3)其他:如子宫颈内膜异位、子宫颈微腺体增生、中肾管残余或增生等,通过形态学及免疫组化易于鉴别。
3.5 治疗及预后因子宫颈MDA较少见,目前该病尚无规范化治疗方案,多按同期子宫颈腺癌治疗。早期患者以手术治疗为主,术后根据患者情况,选择辅助放、化疗[2]。晚期患者原则上宜采用放疗为主的治疗方式,但由于MDA作为特殊类型的子宫颈腺癌对放、化疗不敏感,因此仍首选根治性全子宫、双侧附件及盆腔淋巴结清除术,术后辅助放、化疗[16]。MDA预后差,临床分期及手术范围是影响患者预后的主要因素。本组2例患者发生转移,其中例3转移至盆腔壁,可能与该患者临床分期高、手术切除不完整相关;例4转移至膀胱,可能与该患者未行根治性手术有关。
