柴胡疏肝散辅助治疗重度抑郁症的网络药理学研究
2020-07-17卢玲庄胜陈炜玉倩汪顺贵李华霞刁丽梅
卢玲 庄胜 陈炜 玉倩 汪顺贵 李华霞 刁丽梅


摘 要 目的:研究柴胡疏肝散辅助治疗重度抑郁症(MDD)的潜在分子机制。方法:采用网络药理学方法。利用基因表达综合数据库(GEO)下载MDD患者基因芯片数据集GSE76826,再利用R语言软件中的limma包筛选出MDD患者样本中的差异基因。利用中药系统药理学数据库和分析平台(TCMSP)筛选柴胡疏肝散的活性成分及其对应的靶标。通过在线软件venny 2.1.0对MDD的差异基因和柴胡疏肝散的靶标取交集,获取柴胡疏肝散治疗MDD的共同靶标基因,然后将共同靶标基因导入Cytoscape 3.6.1软件构建“柴胡疏肝散活性成分-MDD靶标基因”关系网络。利用BisoGenet插件构建蛋白互作(PPI)网络,并对其进行拓扑结构分析,筛选核心靶标基因,进行京都基因与基因组百科全书(KEGG)通路分析。结果:柴胡疏肝散治疗MDD的活性成分有139种,包括槲皮素、山柰酚、木犀草素、豆甾醇等;其作用的核心靶点基因共有8个,包括NR3C2、DPP4、ALOX5、GSTM1、CCND1、IGFBP3等;其主要通过调节细胞受体、嘌呤代谢、类固醇生物合成、氨酰生物合成等信号通路发挥治疗MDD的作用。结论:柴胡疏肝散可通过多个靶标、多个途径发挥辅助治疗MDD的作用,可为后续研究其作用机制提供理论基础。
关键词 网络药理学;柴胡疏肝散;重度抑郁症;靶标;机制
ABSTRACT OBJECTIVE: To explore the molecular mechanism of Chaihu shugan powder in the adjunctive treatment of major depressive disorder (MDD). METHODS: Network pharmacology was adopted. The microarray dataset GSE76826 was downloaded from GEO common database, and the limma package was used to screen the differently expressed genes in the samples of MDD patients. The active ingredients and corresponding targets of Chaihu shugan powder were screened out based on TCMSP platform. Through the online software venny 2.1.0, the differently expressed genes of MDD and the targets of Chaihu shugan powder were screened, and the common target genes of Chaihu shugan powder for MDD were obtained. The target genes were introduced into Cytoscape 3.6.1 software to construct the network diagram of “Chaihu shugan powder active ingredients-MDD target gene”. Then, BisoGenet plug-in was used to construct the PPI network, analyze the topological structure and screen the core target gene. KEGG pathway analysis was conducted. RESULTS: There were 139 active components of Chaihu shugan powder for the treatment of MDD, including quercetin, kaempferol, luteolin, stigmasterol, etc. There were 8 core target genes, including NR3C2, DPP4, ALOX5, GSTM1, CCND1, IGFBP3 and so on. They play an important role in the treatment of MDD via signaling pathway such as regulating cell receptor, purine metabolism, steroid biosynthesis, aminoacyl biosynthesis, etc. CONCLUSIONS: Chaihu shugan powder can play a role in the adjunctive treatment of MDD through multiple targets and pathways, which can provide a theoretical basis for the follow-up study of its mechanism.
KEYWORDSNetwork pharmacology; Chaihu shugan powder; Major depressive disorder; Targets; Mechanism
重度抑郁癥(MDD)是一种具有高发病率、高复发率、高共病率和高自杀率等特点的情绪性功能障碍疾病[1],主要临床表现为情绪抑郁、易疲劳、兴趣丧失、精力减退、注意力下降、决策力受损、反应迟钝等。目前,该病的主要治疗方式有药物治疗、物理治疗及心理治疗等[2]。以选择性5-羟色胺再吸收抑制剂为代表的一线抗抑郁药,可以有效缓解抑郁症患者的愤怒情绪和攻击性行为,但也存在副作用[3]。相关研究发现,中药辅助治疗重度抑郁症,可减轻抗抑郁药物的副作用,提高患者的依从性及治愈率,如柴胡疏肝散联合推拿治疗脑卒中后重性抑郁障碍,其治疗有效率可达90%[4];另外,利用柴胡疏肝散颗粒能降低抑郁症患者的汉密尔顿抑郁量表评分,改善其日常生活能力及抑郁状态,提高其血清脑源性神经营养因子水平[5]。这表明柴胡疏肝散对MDD有一定的辅助治疗作用,但其治疗MDD的潜在分子机制尚不明确。
中药网络药理学通过“网络靶向多组分”的模式进行研究,可预测中药化合物的靶向分布和药理作用,揭示药物-基因-疾病网络关系,能高效率地从中药复方中筛选出多种活性成分,更好地诠释中药方剂的组合规律和网络调节效应[6]。本研究在中药复方多成分、多靶标、多途径作用的研究思路上,基于中药网络药理学技术,构建“柴胡疏肝散活性成分-MDD靶标基因”关系网络,探讨柴胡疏肝散治疗MDD的潜在分子机制,以期为该方剂后续研究及应用提供参考。
1 材料与方法
1.1 MDD患者基因表达谱芯片数据的获取
本研究从基因表达综合数据库(GEO,https://www.ncbi.nlm.nih.gov/gds/)中下载序列号为GSE76826的基因芯片数据矩阵文件。该数据矩阵文件是将年龄≥50岁的32例人体血液转录组样本通过Agilent-039494 SurePrint G3 Human GE v2 8x60K Microarray 039381探针进行试验处理而得的。该数据矩阵文件中包含对照组12例,为健康个体血液样本的基因表达谱芯片数据;试验组20例,为MDD患者血液样本的基因表达谱芯片数据。
1.2 MDD患者差异基因的筛选
使用R语言软件(版本:v.3.5.0)中的limma包对MDD患者的差异基因进行筛选。limma包可对RNA测序(RNAseq)数据执行差异表达和差异剪接分析[7]。本研究差异基因的筛选条件为P<0.05且|log2 FC|>0.5,其中log2 FC>0.5为上调,log2 FC<-0.5为下调[8-9],然后根据筛选出的差异基因绘制火山图。
1.3 柴胡疏肝散活性成分的筛选及靶标预测
利用中药系统药理学数据库和分析平台(TCMSP,http://tcmspw.com/ tcmsp.php)研究柴胡疏肝散和靶点的相互关系。以生物利用度(OB)≥30%和类药性(DL)≥0.18为条件[10-11]筛选出柴胡疏肝散(由柴胡、陈皮、甘草、白芍、川芎、香附、枳壳组成)中每味中药的活性成分;同时,查询获得柴胡疏肝散所有活性成分对应的靶标,然后通过UniProt 数据库(https://www.uniprot. org/)对靶标进行基因注释,获取各个靶标对应的基因ID。
1.4 构建“柴胡疏肝散活性成分-MDD靶标基因”关系网络
通过在线软件venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)对MDD差异基因和柴胡疏肝散活性成分对应的靶标基因取交集,获取MDD与柴胡疏肝散的共同靶标基因,即柴胡疏肝散治疗MDD的作用靶标基因。为了解药物活性成分与疾病靶标基因之间的作用关系,将共同靶标基因与药物活性成分编排成关系对文件,再导入Cytoscape 3.6.1软件进行可视化分析,得到“柴胡疏肝散活性成分-MDD靶标基因”关系网络。
1.5 蛋白互作(PPI)网络的构建及拓扑分析
为了解各个靶标基因之间的相互作用关系,将柴胡疏肝散治疗MDD的靶标基因导入Cytoscape 3.6.1软件中,使用集网络构建、可视化和分析功能于一体的生物信息学工具BisoGenet插件[12]构建PPI网络。通过CytoNCA插件对构建的PPI网络进行拓扑分析,计算Betweenness(BC)值,设置BC的最小值为600[13-15],筛选出核心靶标基因,构建PPI核心子网络。
1.6 基因集富集分析
为了筛选出的核心靶标基因在MDD中富集的生物学通路及潜在的作用机制,笔者通过GSEA 4.0.2软件对核心靶标基因进行基因集富集分析。通过GSEA算法[16-17],剔除掉正常样本后,根据每个靶标基因在MDD患者样本中表达量的中位值,分别定义了靶标基因的高表达组和低表达组两个表型,然后基于基因表达数据与靶标基因高、低表型的关联度大小进行排序,判断每个京都基因与基因组百科全书(KEGG)功能基因集内的基因是否富集于基因列表的上部或下部,并根据富集于上下部的情况得到KEGG通路富集结果[18-19]。GSEA中KEGG通路富集分析的显著差异的条件设定为错误发现率(FDR)<0.05,P<0.05[18,20]。
2 结果
2.1 MDD差异基因的筛选结果
基于R语言软件中的limma包及篩选阈值P<0.05且|log2FC|>0.5,得到808个MDD差异基因,其中上调基因272个,下调基因536个,详见图1。
2.2 柴胡疏肝散中活性成分及预测靶标的筛选结果
共筛选出157种活性成分,其中柴胡活性成分17种、陈皮5种、甘草92种、白芍13种、川芎7种、香附18种、枳壳5种;剔除18种重复成分后,最终获得139种活性成分。根据这139种活性成分在TCMSP中共检索到对应靶标241个。柴胡疏肝散中部分活性成分及靶标基因见表1。
2.3 “柴胡疏肝散活性成分-MDD靶标基因”关系网络的构建结果
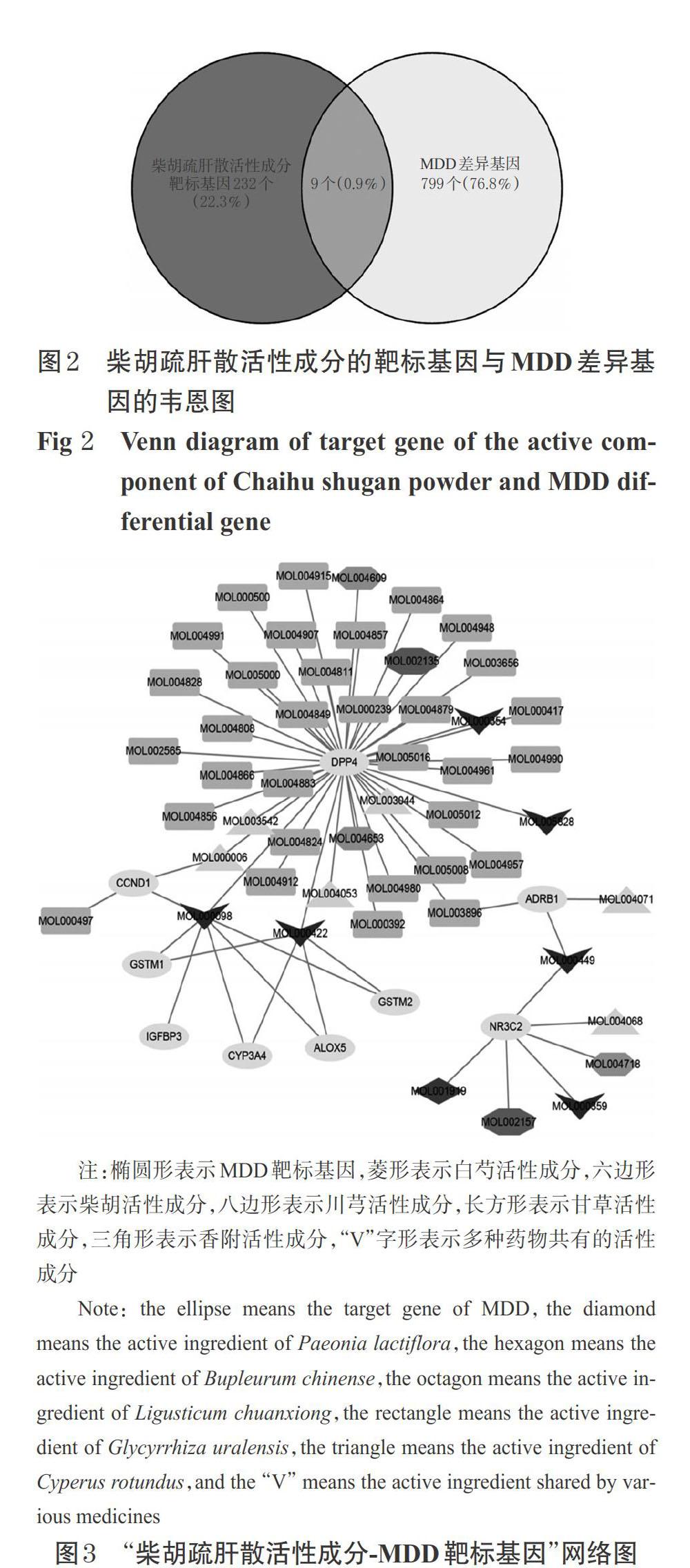
通过在线软件venny 2.1.0将808个MDD差异基因与筛选得到的241个柴胡疏肝散作用的靶标基因取交集,共获得9个共同靶标基因NR3C2、DPP4、CYP3A4、ALOX5、GSTM1、GSTM2、ADRB1、CCND1、IGFBP3,其韦恩图详见图2。这9个共同靶标基因既是与MDD密切相关的差异基因,又是柴胡疏肝散活性成分作用的靶标,由此推测柴胡疏肝散可通过这些靶标治疗MDD。将这9个靶标基因与柴胡疏肝散活性成分导入Cytoscape 3.6.1软件进行可视化分析,得到“柴胡疏肝散活性成分-MDD靶标基因”关系网络,详见图3。
2.4 PPI网络拓扑结构分析
将靶标基因导入Cytoscape 3.6.1软件后以BisoGenet插件构建得到PPI网络,详见图4。结果表明,9个共同靶标基因间均存在直接或间接的相互作用关系。
对PPI网络进行拓扑结构分析,根据BC值>600构建PPI核心子网络,详见图5。该核心网络中包含除GSTM2外的8个共同靶标基因,即NR3C2、DPP4、CYP3A4、ALOX5、GSTM1、ADRB1、CCND1、IGFBP3,推测这8个共同靶标基因不仅在“柴胡疏肝散活性成分-MDD靶标基因”网络中发挥着重要的作用,还在PPI网络中扮演着重要的角色,可能是柴胡疏肝散治疗MDD的核心靶标基因。
2.5 基因集富集分析结果
根据“2.4”项下得到的NR3C2、DPP4、CYP3A4、ALOX5、GSTM1、ADRB1、CCND1、IGFBP3核心靶标基因在每个MDD患者样本中表达量的中位值,分别定义为高表达组和低表达组两个表型。GSEA富集分析结果显示,与低表达组比较,高表达组有6个核心靶标基因的高表达表型主要富集在细胞受体、RNA聚合酶、核糖体、嘌呤代谢、DNA复制、细胞周期、氨酰生物合成、类固醇生物合成、tRNA生物合成、幽门螺杆菌感染的上皮细胞信号转导等相关通路,详见表2。其中,靶标基因CYP3A4、ADRB1的GSEA富集结果未满足FDR<0.05的筛选条件,故予以剔除。由此可知,柴胡疏肝散活性成分作用的靶标基因分布于不同的代谢通路,可通过多化合物、多靶标、多途径辅助治疗MDD。
3 讨论
3.1 柴胡疏肝散治疗MDD的基础
中医将MDD归属“郁病”范畴,《内经》认为外感六淫、七情内伤可导致脏腑功能紊乱而发为郁[21]。柴胡疏肝散出自《景岳全书》,是中医疏肝解郁的代表方剂,自明代以来被广泛应用于临床。现代药理研究表明,柴胡疏肝散可通过调节神经递质、细胞因子、内分泌系统、神经细胞损伤信号通路、抗氧化应激等,发挥抗抑郁症的作用[22],但其具体的作用机制尚不明确。因此,研究柴胡疏肝散辅助治疗MDD的分子机制具有重要临床意义。
3.2 柴胡疏肝散抗MDD的活性成分
本研究结果显示,柴胡疏肝散的活性成分可能通过多靶点、多途径参与MDD的辅助治疗。其中,槲皮素、山柰酚、木犀草素、豆甾醇、异鼠李素、谷甾醇、川陈皮素等能作用于较多的靶标基因,可能是柴胡疏肝散治疗MDD的主要活性成分。相关研究发现,β-谷甾醇、豆甾醇、异鼠李素和槲皮素均有抗抑郁作用[23]。槲皮素可通过抗氧化、抗炎、降低兴奋性毒性、升高5-羟色胺水平来发挥抗MDD作用[24]。山柰酚可通过降低氧化应激、减少促炎细胞因子和上调蛋白激酶B/β-联蛋白途径来发挥抗抑郁作用[25]。槲皮苷和山柰酚均可通过升高下丘脑POMC mRNA的水平和血浆β-内啡肽水平,达到抗MDD的效果;木犀草素的抗抑郁活性,可能与其抑制内质网应激作用有关[26]。
3.3 核心靶标基因
PPI网络拓扑分析和GSEA基因集富集分析的结果表明,NR3C2、DPP4、ALOX5、GSTM1、CCND1、IGFBP3可能是柴胡疏肝散治疗MDD的关键靶标基因。丘脑-垂体-肾上腺轴(HPA轴)功能失调是抑郁症等疾病的基础,研究发现,大脑中核受体亚家族C组成员2(NR3C2)的表达下降,可导致HPA轴的反馈受限、皮质醇水平升高,与抑郁的发生密切相关[27]。二肽基肽酶4(DPP4)能够通过降解神经调节肽来调节神经传递,且血清中DDP4是诊断MDD的重要生物学标志物[28]。胰岛素样生长因子结合蛋白3(IGFBP3)是神经发生的重要因子,异常的神经发生可能导致海马功能障碍和新生齿状颗粒细胞的产生减少,从而导致MDD患者认知、情感和行为功能的缺陷[29]。同期蛋白D1(CCND1)是一种细胞周期调节因子,参与了神经前体细胞的增殖,与损伤后神经发生、发育和修复相关,研究发现,let-7 miRNA家族不仅可以通过调控CCND1的活性来干预抑郁症,还可以通过靶向白细胞介素6(IL-6)来参与MDD的炎症过程[30]。此外,5-脂氧合酶(ALOX5)被证实在炎性疾病的发生中至关重要[31]。谷胱甘肽S-转移酶Mu-1(GSTM1)也与抑郁的发生密切相关,相关动物实验证实,GSTM1在抑郁样本中表达增加[32]。
3.4 主要通路
GSEA基因集富集分析结果显示,柴胡疏肝散治疗MDD的主要信号通路有细胞受体信号通路、RNA聚合酶、核糖体、嘌呤代谢、DNA复制、细胞周期、氨酰生物合成、类固醇生物合成、tRNA生物合成、幽门螺杆菌感染的上皮细胞信号转导等。其中,细胞周期与抑郁的发生密切相关,可通过抵抗神经元凋亡和壞死、改变细胞周期进程,从而治疗MDD[33]。相关研究发现,MDD与氨基酸类神经递质和氨酰生物合成异常有关[34]。此外,MDD的发生与类固醇生物合成密切相关,如糖皮质激素、神经类固醇等。神经类固醇通过与大脑中的受体结合来调节基因表达和调节神经元的兴奋性,从而影响MDD的病理生理过程[35]。下丘脑功能障碍是抑郁症发病的关键,神经炎症、神经递质和嘌呤代谢系统失衡是抑郁症的重要特征,相关研究发现,炎症性抑郁症中伴随有氨基酸代谢和嘌呤代谢的紊乱[36]。另外,细胞因子可能通过影响糖皮质激素受体而导致抑郁发生,目前已有研究证实,可通过抑制炎性细胞因子及其信号通路、增强糖皮质激素受体功能等,达到治疗抑郁症的目的[37]。
综上,柴胡疏肝散辅助治疗MDD的主要活性成分有槲皮素、山柰酚、木犀草素等,其作用机制可能与细胞受体、嘌呤代谢等信号通路有关,具有多靶标、多途径的特点,可为后续研究提供理论基础。
参考文献
[ 1 ] WRAYNR,RIPKE S,MATTHEISEN M,et al. Genome- wide association analyses identify 44 risk variants and refine the genetic architecture of major depression[J]. Nat Genet,2018,50(5):668-681.
[ 2 ] 张程赪,张嘉骥.改良电休克联合帕罗西汀对重度抑郁症执行功能的影响[J].中国医药科学,2019,9(21):280- 283.
[ 3 ] LOCHER C,KOECHLIN H,ZION SR,et al. Efficacy and safety of selective serotonin reuptake inhibitors,serotonin-norepinephrine reuptake inhibitors,and placebo for common psychiatric disorders among children and adolescents: asystematic review and meta-analysis[J]. JAMA Psychiatry,2017,74(10):1011-1020.
[ 4 ] 蔺建忠,纪斌,何龙,等.柴胡疏肝散联合推拿治疗脑卒中后重性抑郁障碍50例[J].中医研究,2019,32(7):9-12.
[ 5 ] 胡丹,盛蕾.加味柴胡疏肝颗粒辅助治疗缺血性脑卒中后抑郁的疗效观察[J].中草药,2016,47(21):3866-3870.
[ 6 ] LI S,ZHANG B. Traditional Chinese medicine network pharmacology: theory,methodology and application[J]. Chin J Nat Med,2013,11(2):110-120.
[ 7 ] RITCHIE ME,PHIPSON B,WU D,et al. Limma powers differential expression analyses for RNA-sequencing and microarray studies[J]. Nucleic Acids Res,2015. DOI:10. 1093/nar/gkv007.
[ 8 ] AMBATIPUDI S,GERSTUNG M,PANDE M,et al. Genome-wide expression and copy number analysis identifies driver genes in gingivobuccal cancers[J]. Genes Chromosomes Cancer,2012,51(2):161-173.
[ 9 ] GALAMB O,KALM?R A,BART?K BK,et al. Aging related methylation influences the gene expression of key control genes in colorectal cancer and adenoma[J]. World J Gastroenterol,2016,22(47):10325-10340.
[10] YU G,LUO Z,ZHOU Y,et al. Uncovering the pharmacological mechanism of Carthamus tinctorius L. on cardiovascular disease by a systems pharmacology approach[J]. Biomed Pharmacother,2019.DOI:10.1016/j.biopha.2019. 109094.
[11] WANG W,LIU T,YANG L,et al. Study on the multi-targets mechanism of triphala on cardio-cerebral vascular diseases based on network pharmacology[J]. Biomed Pharmacother,2019. DOI:10.1016/j.biopha.2019.108994.
[12] MARTIN A,OCHAGAVIA ME,RABASA LC,et al. BisoGenet: a new tool for gene network building,visualization and analysis[J]. BMC Bioinformatics,2010. DOI:10. 1186/1471-2105-11-91.
[13] 秦一冰,曲妮妮,鄭忻,等.基于网络药理学探讨柴胡-黄芩治疗新型冠状病毒肺炎的作用机制[EB/OL].(2020- 03-26)[2020-04-22].http://kns.cnki.net/kcms/detail/21. 1546.R.20200326.1521.002.html.
[14] 何信用,郑思成,王群,等.基于网络药理学的黄连解毒汤治疗动脉粥样硬化的潜在分子机制研究[J].中草药,2020,51(3):687-696.
[15] 贾雪丽,杨彦,孙予祥.中药复方肠复康抗结直肠癌血管生成作用靶基因网络药理学研究[J].中华中医药学刊,2020,38(3):246-251、279.
[16] SUBRAMANIAN A,TAMAYO P,MOOTHA VK,et al. Gene set enrichment analysis: a knowledge-based approach for interpreting genome-wide expression profiles[J]. Proc Natl Acad Sci USA,2005,102(43):15545- 15550.
[17] MOOTHA VK,LINDGREN CM,ERIKSSON KF,et al. PGC-1alpha-responsive genes involved in oxidative phosphorylation are coordinately downregulated in human diabetes[J]. Nat Genet,2003,34(3):267-273.
[18] WU H,ZHANG J. Decreased expression of TFAP2B in endometrial cancer predicts poor prognosis: a study based on TCGA data[J]. Gynecol Oncol,2018,149(3):592-597.
[19] OUYANG W,REN L,LIU G,et al. LncRNA mir4435- 2HG predicts poor prognosis in patients with colorectal cancer[J]. Peer J,2019. DOI:10.7717/peerj.6683.
[20] LIU B,LIU J,LIAN Y,et al. Identification of SEC61G as a novel prognostic marker for predicting survival and response to therapies in patients with glioblastoma[J]. Med Sci Monit,2019. DOI:10.12659/MSM.916648.
[21] 王文凱,张贺,刘景亮,等.郁证病名的古代文献考辨[J].江苏中医药,2019,51(10):76-79.
[22] 周瑾,黄菲,吴晓俊.柴胡疏肝散抗抑郁化学成分和药理作用研究进展[J].中药药理与临床,2019,35(2):174- 179.
[23] G?RA?A? DERELI FT,ILHAN M,K?PELI AKKOL E. Identification of the main active antidepressant constituents in a traditional Turkish medicinal plant,Centaurea kurdica Reichardt[J]. J Ethnopharmacol,2020. DOI:10. 1016/j.jep.2019.112373.
[24] SHEN Z,XU Y,JIANG X,et al. Avicularin relieves depressive-like behaviors induced by chronic unpredictable mild stress in mice[J]. Med Sci Monit,2019. DOI: 10. 12659/MSM.912401.
[25] GAO W,WANG W,PENG Y,et al. Antidepressive effects of kaempferol mediated by reduction of oxidative stress,proinflammatory cytokines and up-regulation of AKT/β-catenin cascade[J]. Metab Brain Dis,2019,34(2):485-494.
[26] GUAN LP,LIU BY. Antidepressant-like effects and mechanisms of flavonoids and related analogues[J]. Eur J Med Chem,2016. DOI:10.1016/j.ejmech.2016.05.026.
[27] ROBERT K,DAVID K,MICHAAEL L,et al. Genetic variation of the mineralocorticoid receptor gene (MR,NR3C2) is associated with a conceptual endophenotype of “CRF-hypoactivity”[J]. Psychoneuroendocrinology,2018.DOI:10.1016/j.psyneuen.2018.09.036.
[28] WAGNER L,KAESTNER F,WOLF R,et al. Identifying neuropeptide Y(NPY) as the main stress-related substrate of dipeptidyl peptidase 4 (DPP4) in blood circulation[J]. Neuropeptides,2016,DOI:10.1016/j.npep.2016. 02.007.
[29] MAHMOOD S,EVINOV? A,?KERE?OV? M,et al. Association of EGF,IGFBP-3 and TP53 gene polymorphisms with major depressive disorder in Slovak population[J]. Cent Eur J Public Health,2016,24(3):223-230.
[30] MAFFIOLETTI E,SALVI A,CONDE I,et al. Study of the in vitro modulation exerted by the antidepressant drug escitalopram on the expression of candidate microRNAs and their target genes[J]. Mol Cell Neurosci,2017. DOI:10.1016/j.mcn.2017.10.005.
[31] MARBACH-BREITR?CK E,KALLEDAT A,HEYDE- CK D,et al. Atopic patients show increased interleukin 4 plasma levels but the degree of elevation is not sufficient to upregulate interleukin-4-sensitive genes[J]. Skin Pharmacol Physiol,2019,32(4):192-200.
[32] RAO C,SHI H,ZHOU C,et al. Hypothalamic proteomic analysis reveals dysregulation of glutamate balance and energy metabolism in a mouse model of chronic mild stress-induced depression[J]. Neurochem Res,2016,41(9):2443-2456.
[33] 劉颖,张萱,刘纯岩,等.抗抑郁药奥氮平对大鼠海马神经细胞凋亡和细胞周期的影响[J].吉林大学学报(医学版),2013,39(6):1094-1097.
[34] LIU LY,ZHANG HJ,LUO LY,et al. Blood and urinary metabolomic evidence validating traditional Chinese medicine diagnostic classification of major depressive disorder[J]. Chin Med,2018. DOI:10.1186/s13020-018-0211-z.
[35] QI XR,LUCHETTI S,VERWER R,et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: a postmortem study[J]. Brain Pathol,2018,28(4):536-547.
[36] WU Y,LI Y,JIA Y,et al. Imbalance in amino acid and purine metabolisms at the hypothalamus in inflammation-associated depression by GC-MS[J]. Mol Biosyst,2017,13(12):2715-2728.
[37] PACE TW,MILLER AH. Cytokines and glucocorticoid receptor signaling. Relevance to major depression[J]. Ann NY Acad Sci,2009. DOI:10.1111/j.1749-6632.2009.04984.x.
(收稿日期:2020-03-24 修回日期:2020-05-08)
(编辑:唐晓莲)
