氯胺酮复合丙泊酚对大鼠抑郁改善作用及对STAT3信号通路表达的影响*
2020-07-15孙媛王莉王欣毛瑞芬
孙媛,王莉,王欣,毛瑞芬
(河北医科大学第一医院麻醉科,石家庄 050031)
大脑处理情感的关键部位为边缘系统,其主要构成部分为杏仁核,杏仁核参与了机体情绪和行为的调节,为抑郁症患者发病主要脑区[1-2]。研究显示,抑郁症患者杏仁核内部分细胞因子发生过量表达,造成炎症反应信号路径活化[3]。Janus激酶/信号转导与转录激活子(the Janus kinase/signal transducer and activator of transcriptions,JAK/STAT)信号路径为主要炎症细胞因子将胞内信号激活的转导路径。大量研究显示,JAK/STAT信号路径可参与抑郁症神经细胞分化、增殖、凋亡核神经突触可塑性等病理进程[4-5]。丙泊酚有抗惊厥作用,氯胺酮是N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗药,被广泛用于危重患者和小儿麻醉手术。研究显示,氯胺酮不仅有麻醉作用,还有快速抗抑郁作用,对难治性抑郁具有一定疗效[6]。CHEN等[7]研究显示,链脲佐菌素所致糖尿病的大鼠较正常大鼠抑郁表征明显。笔者在本研究考察氯胺酮复合丙泊酚麻醉对链脲佐菌素所致大鼠抑郁症状的改善作用及对STAT3信号通路表达的影响,现报道如下。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级Wistar雄性大鼠,6周龄,购自成都达硕实验动物公司,实验动物生产许可证号为SCXK(川)2018-33,体质量80~120 g,平均(108.17±6.37) g。常规饲养1周后开始实验,大鼠分笼饲养,每笼5只,室温22~26 ℃,相对湿度55%~65%,昼夜循环,保持光照12 h,大鼠灌胃、添加饲料及换水等由专人负责。
1.2试药与仪器 链脲佐菌素(美国Sigma公司,批号:050814),白细胞介素-6(IL-6)、IL-1β及糖蛋白130(glycoprotein 130,gp130)试剂盒(购自武汉华美生物公司,批号分别为1903052,1812006,1901007),氯胺酮(福建古田制药厂,批号:181213),丙泊酚(意大利AstraZeneca公司,批号:A1890),肿瘤坏死因子-α(TNF-α)试剂盒(杭州联科生物公司,批号:181014),信号转导与转录激活子-3(total-STAT3)、Janus激活酶2(total-Jak2)试剂盒(武汉优尔生科技公司,批号分别为1901139,1902221)。
电热恒温鼓风干燥箱(型号:DHG-9023A)、数字显示隔水式电热恒温培养箱(型号:PYX-DHS)、漩涡混合器(型号:XW-80A)、离心机(型号:TGL-168)由美国KIMBLE公司生产;全自动封闭式组织脱水机(型号:TSJ-Ⅱ)由常州中威电子仪器厂生产。
1.3实验方法 采用随机数字表法将大鼠分为正常对照组、模型对照组、氟西汀组及麻醉组,每组15只。麻醉组、模型对照组及氟西汀组大鼠腹腔注射链脲佐菌素60 mg·kg-1。药物导致糖尿病,进而产生抑郁。28 d后麻醉组大鼠腹腔注射氯胺酮(10 mg·kg-1)和丙泊酚(80 mg·kg-1),氟西汀组灌胃氟西汀溶液0.2 mg·(100 g)-1,正常对照组和模型对照组腹腔注射等剂量0.9%氯化钠溶液,连续7 d。
1.4观察指标 ①旷场实验,给药后1 d所有大鼠置于操作间,光线适度,环境安静。待测前将大鼠分别置于新鼠笼,适应5 min,再将大鼠置于旷场箱中央方格,大鼠头部方向一致,记录5 min,再将大鼠取出,旷场箱采用清水与75%乙醇清洗后检测第2只大鼠,记录大鼠直立次数、穿格数和修饰次数。
②旷场实验后将大鼠断颈处死,选取前额皮质,酶联免疫吸附测定(ELISA)法检测IL-6与IL-1β含量。
③Western blotting法检测大鼠前额皮质脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)蛋白表达,选取坐骨神经组织,研磨,经组织裂解后上样电泳,起始电压80 V,溴酚蓝染料前缘进入到分离胶上缘后电压提升到100 V,溴酚蓝泳出分离胶下缘后电泳结束。半干电转移仪于聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜内行蛋白质电转移,恒流30 mA,连续90 min。PVDF膜取出后采用5%TBST缓冲液(TBST Buffer)脱脂奶粉封闭,震荡60 min。结束封闭后采用TBST漂洗液洗膜10 min,3次,膜转移到杂交袋内,加入适量漂洗液稀释抗体,封口后4 ℃下孵育过夜;TBST漂洗液洗膜10 min,3次,再加入漂洗液稀释的辣根过氧化物酶标记二抗,震荡60 min。PVDF膜放置在电化学发光(electrochemi luminescence,ECL)显色液内震荡温育5 min,暗室下曝光、显影及定影。清水冲洗,晾干扫描,Image-Pro Plus(IPP)软件对扫描图像目的条带行灰度分析。
④选取杏仁核组织,ELISA法检测total-STAT3、TNF-α、total-Jak2及gp130含量,试剂盒中标准品稀释后加至酶标板标准品孔,大鼠杏仁核组织研磨后的上清液样品加入样品孔,每孔10 μL,胶纸将反应孔封住,37 ℃下孵育2 h,洗板5次,再加入生物素化抗体工作液10 μL,37 ℃下孵育1 h,洗板5次,加入酶结合物工作液10 μL,37 ℃下避光孵育30 min,洗板5次,每孔加入显色液10 μL,37 ℃下避光孵育20 min,最后加入终止液,混匀后检测吸光度(A450)值,以标准品浓度为横坐标,以A值为纵坐标,绘制标准曲线,依据样品A值于标准曲线内查看其浓度。
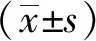
2 结果
2.1旷场实验结果 见表1。与正常对照组比较,模型对照组大鼠直立次数、穿格数和修饰次数减少;与模型对照组比较,氟西汀组、麻醉组大鼠直立次数、穿格数和修饰次数增加,均差异有统计学意义(P<0.05)。
表1 4组大鼠旷场实验中直立次数、穿格数和修饰次数比较
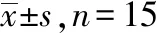

组别直立次数穿格个数修饰次数正常对照组8.02±2.1956.30±10.757.16±1.83模型对照组3.99±2.05①14.93±10.28①1.45±1.69①氟西汀组10.10±2.21②54.20±10.18②6.83±1.58②麻醉组9.26±2.18②52.17±10.46②6.40±1.76②
①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05。
①Compared with normal control group,P<0.05;②Compared with model control group,P<0.05.
2.2前额皮质IL-6与IL-1β含量 见表2。与正常对照组比较,模型对照组前额皮质IL-6与IL-1β含量升高;与模型对照组比较,氟西汀组、麻醉组大鼠前额皮质IL-6与IL-1β含量降低,差异有统计学意义(P<0.05)。
2.3前额皮质BDNF表达情况 正常对照组、模型对照组、氟西汀组及麻醉组前额皮质BDNF表达分别为(100.00±0.00)%、(61.07±3.29)%、(86.31±3.15)%及(84.19±3.26)%。与正常对照组比较,模型对照组前额皮质内BDNF表达降低;与模型对照组比较,氟西汀组、麻醉组大鼠前额皮质内BDNF表达升高,差异有统计学意义(P<0.05)。
2.4杏仁核total-STAT3、TNF-α、total-Jak2及gp130含量 见表3。与正常对照组比较,模型对照组total-STAT3、TNF-α及gp130含量升高;与模型对照组比较,氟西汀组、麻醉组total-STAT3、TNF-α及gp130含量降低,差异有统计学意义(P<0.05)。
表2 4组大鼠前额皮质内IL-6与IL-1β含量比较


组别IL-6IL-1β正常对照组60.03±6.1559.27±4.10模型对照组81.37±6.30①80.25±4.17①氟西汀组61.82±6.26②62.15±4.20②麻醉组63.25±6.31②64.26±4.39②
①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05。
①Compared with normal control group,P<0.05;②Compared with model control group,P<0.05.
表3 4组大鼠杏仁核total-STAT3、TNF-α、total-Jak2及gp130含量比较
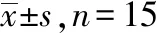
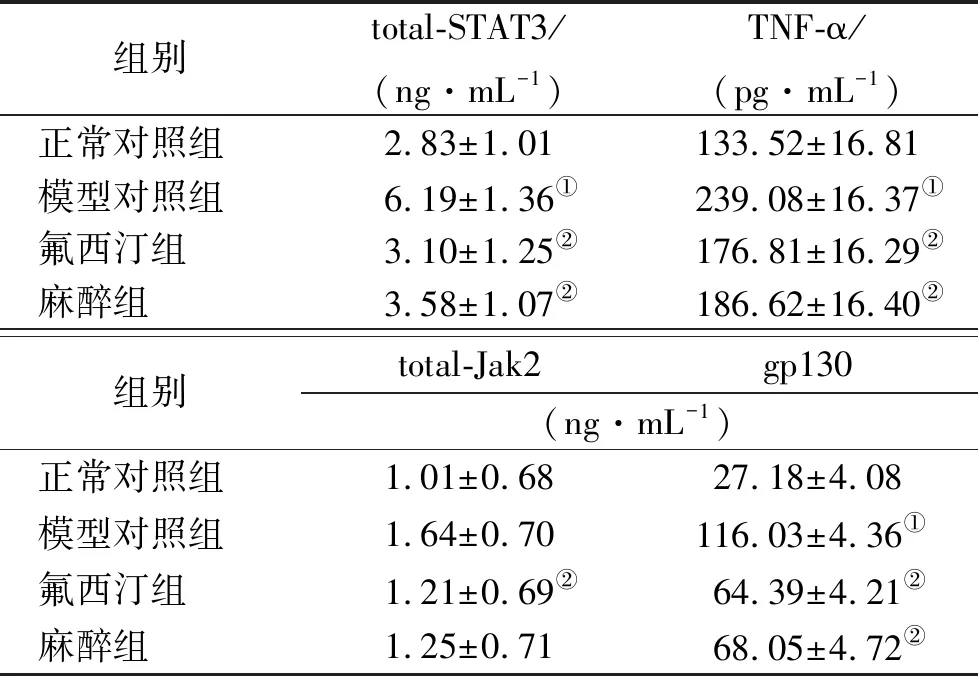
组别total-STAT3/(ng·mL-1)TNF-α/(pg·mL-1)正常对照组2.83±1.01133.52±16.81模型对照组6.19±1.36①239.08±16.37①氟西汀组3.10±1.25②176.81±16.29②麻醉组3.58±1.07②186.62±16.40②组别total-Jak2gp130(ng·mL-1)正常对照组1.01±0.6827.18±4.08模型对照组1.64±0.70116.03±4.36①氟西汀组1.21±0.69②64.39±4.21②麻醉组1.25±0.7168.05±4.72②
①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05。
①Compared with normal control group,P<0.05;②Compared with model control group,P<0.05.
3 讨论
CHEN等[7]研究发现,链脲佐菌素所致糖尿病大鼠较正常大鼠抑郁表现明显。本研究结果显示,与正常对照组比较,模型对照组大鼠直立次数、穿格数和修饰次数减少;与模型对照组比较,麻醉组大鼠直立次数、穿格数和修饰次数增加,均差异有统计学意义,提示链脲佐菌素致大鼠糖尿病能构建抑郁模型。
糖尿病为临床常见病,相关流行病学研究显示,世界范围内5%~7%人罹患糖尿病[8]。当前,糖尿病所致认知功能受损、抑郁等脑功能障碍逐渐受到关注。WAYHS等[9]研究显示,糖尿病所致抑郁模型动物海马组织的氧化应激指标水平显著增高。此外有研究显示,罗格列酮为临床常用增强胰岛素敏感、治疗胰岛素抵抗类药物,可治疗糖尿病所致抑郁[10]。本实验结果显示,糖尿病模型大鼠前额皮质IL-6、IL-1β表达明显升高,可能与激活炎症反应与氧化应激有关。丙泊酚有抗惊厥作用,氯胺酮具有确切抗抑郁作用,本研究结果显示,经氯胺酮和丙泊酚干预后,大鼠前额皮质IL-6与IL-1β含量降低,与相关研究结果一致[11]。此外,笔者在本研究对氯胺酮与丙泊酚对糖尿病大鼠抑郁症状、相关因子表达改变进行分析。NIBUYA等[12]研究显示,急慢性应激反应均可导致中枢神经系统BDNF表达降低,同时抗抑郁药物能够对BDNF降低起干预作用。本研究结果显示,氯胺酮联合丙泊酚的抗抑郁作用也可能与前额皮质BDNF升高有关。
正常生理情况下,中枢神经TNF-α能够对睡眠、学习记忆和神经元突触可塑性等进行调节,病理状况下,中枢胶质细胞尤其为小胶质细胞可分泌大量TNF-α,参加发生中枢精神障碍性疾病[13-14]。TNF-α参加精神障碍性疾病机制有以下几个因素,一为TNF-α可将相关信号路径激活,造成神经元变性或凋亡,如p38 MAPK、NF-κB、Jnk、ERK等通路;二为导致神经突触抑制性与兴奋性比例不平衡。但JAK/STAT信号转导路径不但为主要跨膜信号转导路径,也是激活机体炎性细胞因子最关键路径。研究表明,TNF-α能借助细胞膜表层gp130蛋白激活JAK/STAT信号通路,进而调节中枢神经系统[15]。本研究结果显示,与正常对照组比较,模型对照组total-STAT3、TNF-α及gp130含量升高;与模型对照组比较,麻醉组大鼠total-STAT3、TNF-α及gp130含量降低,提示氯胺酮联合丙泊酚可降低JAK/STAT信号通路内STAT3蛋白表达,抑制TNF-α过表达,改善大鼠抑郁症状。
综上所述,氯胺酮复合丙泊酚麻醉可显著改善链脲佐菌素所致大鼠抑郁,其作用机制可能与调节JAK/STAT信号路径、降低炎症细胞因子含量有关。本研究仅检测了大鼠STAT3与JAK2蛋白含量改变情况,未检测磷酸化STAT3与JAK2蛋白,一定程度难以反映STAT3与JAK2蛋白活化情况。今后还需对此模型磷酸化STAT3与JAK2蛋白进行探究。
