高稳定性甲基橙的室温合成及其性能研究
2020-07-15李健鹏李险峰陈鸿雁肖定书
李健鹏,李险峰,陈鸿雁,肖定书,2
(1.惠州学院化学与材料工程学院,广东 惠州 516007;2.惠州学院大亚湾化工研究院,广东 惠州 516081)
0 引言


Scheme 1 甲基橙酸碱互变结构式
甲基橙经典的合成方法包括重氮化反应和偶合反应,即对氨基苯磺酸重氮化生成重氮化盐与N,N-二甲基苯胺发生偶合,因此,重氮化反应和偶合反应是甲基橙制备中两个重要的化学反应[2],选择合适的反应条件是获得高稳定甲基橙染料的关键.甲基橙的实验室合成方法为,低温下适量的对甲基苯胺在碱性介质条件下与亚硝酸钠混合配成水溶液,然后滴加低温的无机酸进行重氮化,生成对氨基苯磺酸重氮盐,此过程称为“反重氮法”.将N,N-二甲基苯胺和冰醋酸的混合液在搅拌的条件下,滴入重氮盐,经氢氧化钠溶液调节pH,沉淀析出后,形成橙色的甲基橙.该方法广泛地应用于有机实验教学,存在反应条件苛刻、反应时间长、反应过程较难控制,产率低,获得的甲基橙品质不稳定等缺点.
低温法合成甲基橙的重氮化反应温度为0~10 ℃[3],温度过高会导致重氮盐分解.在重氮化过程中始终要保持pH<2,若酸性不足,会导致氨基苯磺酸的溶解度下降,重氮化速率下降,影响产物的结构稳定性和产率[4-5];若酸性过高,亚硝酸与盐酸作用产生氯气,影响反应进行:
(1)
另外,实验发现:亚硝酸钠的量必须严格控制:重氮化完成后,过量的亚硝酸会使重氮盐缓慢分解,难于与N,N-二甲基苯胺进一步偶合反应;当亚硝酸钠投量不足或供给较慢时,已生成的重氮盐与尚未重氮化的芳伯胺反应,生成氨基类有机物:
(2)
低温法制备甲基橙对反应的温度、反应体系的pH和反应试剂的用量具有严格的要求,在实际操作中难以保证产品的一致性.根据氨基苯磺酸和N,N-二甲基苯胺的分子结构可发现,前者具有强吸电基团的磺酸根,分子具有Lewis酸性质;后者具有两个供电基团的甲基,分子具有Lewis碱性质.因此,在常温下,两者本征的酸碱性反应,形成重氮内盐,而无须添加额外的强酸或强碱以控制产物的形成,而且,亚硝酸来源于亚硝酸钠与对氨基苯磺酸的反应,避免产生过量亚硝酸使重氮盐分解.基于此,本研究采用常温一步法合成甲基橙,即直接将亚硝酸钠与对氨基苯磺酸混合后与N,N-二甲基苯胺反应,无须额外添加的强酸/碱调控反应体系的pH值,得到稳定性较高的甲基橙.由于此方法操作简单,减少可能引起副反应的操作因素,反应条件易控制、时间短,在一定程度上促进实际生产或实验室合成的操作过程简易化.
1 实验部分
1.1 化学药品与试剂对氨基苯磺酸、氢氧化钠、亚硝酸钠、N,N-二甲基苯胺、冰醋酸、氯化钠、无水乙醇、碳酸氢钠均购于广州化学试剂厂;盐酸购于西陇化工有限公司;商用甲基橙、锐钛型纳米二氧化钛购于阿拉丁试剂有限公司;标准甲基橙试剂购于Sigma-Aldrich公司.
1.2 实验设备与仪器NETZSCH热重分析仪,N2氛围中,升温速率为10 ℃/min;日本岛津UV-2550紫外分析仪;布鲁克TENSOR27红外分析仪;广州市深华生物技术PHSJ-3F酸度计;上海舜宇恒平FA2004电子天平,常州市亿能LD-4台式离心机.
1.3 室温合成甲基橙100 mL烧杯中放入2.1 g对氨基苯磺酸晶体和0.8 g亚硝酸钠、30 mL水,室温(~15 ℃)搅拌使之混合溶解.取1.3 mL N,N-二甲基苯胺缓慢滴入上述的混合溶液中,完毕,持续搅拌20 min后,再加入3 mL 5%氢氧化钠溶液,继续搅拌至产物成橙色为止,此时粗的甲基橙细粒沉淀析出.将沉淀物溶于100 mL冷水,静置,使甲基橙溶液析出后,抽滤收集,用饱和NaCl溶液洗涤,接着用无水乙醇洗涤,重复用饱和NaCl溶液和无水乙醇洗涤3次,产品干燥后,称重作进一步测试.
为了作比较,采用实验室常用的反重氮法低温合成甲基橙(低温法),其合成步骤参考文献[6],即取2.1 g对氨基苯磺酸置于100 mL烧杯中,加10 mL 5%氢氧化钠溶液在热水浴中温热使之溶解.冷却至室温后,加0.8 g亚硝酸钠,将上面的混合物在搅拌下缓慢滴入冰冷10%盐酸溶液中,滴完后静置15 min,形成重氮盐.取另一只烧杯加入1.3 mL N,N-二甲基苯胺和1 mL冰醋酸,混合均匀后,滴入重氮盐溶液中,在冷却下搅拌,慢慢加入10% NaOH溶液.反应物变成橙色的细粒状沉淀,经饱和NaCl溶液和无水乙醇洗涤3次后,产品干燥即得.
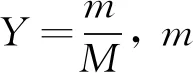

高效液相色谱-质谱(HPLC-MS)检测纯度条件:
HPLC检测条件:采用BEH-C18柱,乙腈-10 mmol/L乙酸铵(20∶80,体积比)混合液为洗脱液,pH=6.8,流速为0.3 mL/min.3 μL样品注入系统中,洗脱液进入紫外-可见检测器、电喷雾电离(ESI)界面,然后进入MS.MS检测条件:喷雾电压为35 000 V,干燥纯N2气流速为25 L/min,干燥气温度为350 ℃,雾化气电压为25 psi,裂解电压为80 eV,离子源:API-ES,负模式.
13C固体核磁共振谱的测试条件:
采用型号为Bruker Aduvance III 400WB的谱仪,弛豫时间为10~60 s,脉冲宽度为4 ms,化学位移参考物质为四甲基硅烷.
1.5 甲基橙的光降解实验3种甲基橙(室温合成、低温合成和商用甲基橙),分别取0.1 g溶于100 mL水制得1 g/L甲基橙溶液备用,经稀释后变成20 mg/L.上述三种甲基橙溶液各取100 mL于 250 mL的烧杯中,各加入锐钛型纳米TiO2粉末 0.05 g作催化剂,暗室中搅拌10 min,然后在搅拌下用卤钨灯在烧杯上方10 cm处垂直照射150 min.每隔30 min取5 mL混合液在紫外光谱仪和分光光度计进行吸收强度测试.
1.6 稳定性测试
1.6.1 酸碱稳定性实验 取的浓度为20 mg/L的甲基橙水溶液,用pH值分别3、7和10的HCl/NaOH水溶液稀释至5 mg/L,在25 ℃放置3 h后进行光学吸收测试.
1.6.2 耐热稳定性实验 取浓度为5 mg/L的甲基橙溶液,分别在25 ℃、60 ℃和90 ℃的水浴锅放置2 h,快速冷却后进行光学吸收测试.
1.6.3 耐紫外光辐射稳定性实验 取浓度为5 mg/L的甲基橙溶液放置于石英培养皿中,距25 W紫外灯下20 cm处分别照射6 h和12 h进行光学吸收测试.
1.6.4 金属离子稳定性实验 取浓度为5 mg/L的甲基橙溶液分别加入1 mL浓度为6 mol/L的Zn(NO3)2、Mg(NO3)2、Al(NO3)3、Fe(NO3)3溶液.在35 ℃水浴锅中保温60 min后,取5 mL进行离心分离,取上清液进行光学吸收测试.
2 结果与讨论
2.1 合成样品的表征图1为3种甲基橙在水中的UV-Vis图谱,由图中可以看出,所有样品在240~340 nm有一个中等强度的吸收峰,在340~560 nm之间有一个强的吸收峰,分别对应着苯环精细结构的吸收峰和甲基橙大分子共轭结构体系的吸收峰.对比低温合成的甲基橙,室温合成的甲基橙其峰值较强,而且中等强度的吸收峰和高强度的吸收峰分别红移了11 nm和10 nm,这是由于较高程度的共轭结构所致;而商用的甲基橙与低温合成的甲基橙曲线几乎一致,但强度略低于后者,表明商用的甲基橙分子在水中的溶解度低于低温合成的样品,这可能由于商用的样品后期纯化处理不彻底所致.
图2为红外光谱图,图中~3 436 cm-1处为 Ar-H的伸缩振动峰;~1 613 cm-1处为苯环的骨架特征峰;~1 385 cm-1处为—CH3弯曲振动吸收峰;~1 120 cm-1处为C—N 的伸缩振动特征峰;~987 cm-1处为—SO3振动特征峰;820~840 cm-1为对二取代的苯基的振动峰,由图2可判断分子中含有甲基橙分子功能基团.值得注意的是,相比于低温合成的样品,室温合成的样品中苯环的骨架特征峰振动位置产生一定的红移,这是由于室温合成的样品强共轭效应,导致双键电子云密度降低,从而降低了振动吸收频率.

图1 不同样品的紫外吸收光谱图

图2 不同样品的傅立叶变换红外吸收光谱图
图3为不同的甲基橙样品的HPLC测试图谱,插图为对应的MS图谱.由图中3a和3b可以看出,低温制备的甲基橙和室温制备的甲基橙的峰位置(保留时间7.58 min)与图3 d的标准样品一致,说明实验室所制得的样品可以确定为甲基橙,通过拟合HPLC峰的积分面积,可以得出低温制备的甲基橙和室温制备的甲基橙的纯度分别为86.24%和94.18%.而商业甲基橙的HPLC图(图3c)出现3个明显的峰,从左到右分别对应着对胺基苯磺酸、N、N-二甲基苯胺和甲基橙的峰,这可能是在后续处理过程中副产物未完全分离所致.插图中对应的MS图谱可以发现,所有的甲基橙在m/z约为304处出现明显的峰,对应着甲基橙脱去Na后的分子碎片,因此可以确定合成的产物为甲基橙.而商业甲基橙除了含有甲基橙外,在m/z为121.2和173.2处还出现分别对应着N、N-二甲基苯胺和对胺基苯磺酸的峰.
2.2 合成反应条件的讨论为了进一步明确反应条件对样品产率和纯度的影响,表1为室温法和低温法在不同的反应温度对甲基橙产率和纯度.在实验过程中,控制偶合阶段的温度(0 ℃、5 ℃、15 ℃、25 ℃和35 ℃),其他反应条件不变,纯度采用可见分光光度计法检测.
从表1可以看出,室温法合成的甲基橙的纯度比低温法高,这是由于室温法合成过程当中,重氮化与偶合过程是同步完成的,减少了重氮盐的副反应.其产率和纯度与温度无关,表明室温法在相当宽的温度范围内都适用,但从上面的数据可以发现,在温度为15 ℃时,其产率和纯度为最高.低温法合成的甲基橙,温度对产品的收率和纯度都有影响,这是因为形成的重氮盐对温度异常敏感,升高温度时,重氮盐会发生分解,影响后续与N,N-二甲橙的偶合反应,因此低温法合成的甲基橙的产率和纯度会随着温度的升高而降低.

图3 不同样品的HPLC图谱(插图为对应的MS图谱)(a)低温法制备的甲基橙;(b)室温法制备的甲基橙;(c)商业的甲基橙;(d)甲基橙标准样品
保持实验条件不变,表2对比了室温法和低温法在偶合阶段不同的反应时间对甲基橙产率和纯度的影响.
从表2看出,室温法合成的甲基橙,在相同时间条件下,其产率比低温法高,这是由于温度较高时,反应速度较快完成,产物较多.室温法和低温法合成的甲基橙的产率随着时间的增加而增加,这是由于增加反应时间,其产物生成越多,但时间越长其增加的趋势越不明显.在搅拌时间为15 min时,室温法和传统法合成的甲基橙,其纯度达到最佳值.因为当反应时间不足时,反应不充分,产物含有一定量的反应物;当时间过长时,过量的重氮盐会与未反应的对氨基苯磺酸反应,生产副产物,因此纯度会降低.综合时间、产率和纯度的考虑,搅拌时间在15 min时,产率和纯度最佳.

表1 反应温度对甲基橙产率和纯度的影响

表2 反应时间对甲基橙产率和纯度的影响
最后,通过HCl、HAC、NaOH溶液调控pH,保持两种方法的反应时间为15 min,表3对比了室温法和传统法在偶合阶段不同的pH值对甲基橙产率和纯度的影响.
从表3可以看出,相同条件下,室温法合成的甲基橙的产率和纯度比低温法高.当反应的pH=2.00时,无论室温法还是低温法合成甲基橙的产率和纯度都最低,当pH=6.00或pH=10.00时,其产率和纯度最高.这是由于当体系处于酸性时,反应物芳胺与酸形成盐,减少了重氮盐的产量,影响后续与芳胺的反应.重氮盐在中性或弱酸性的条件下它的游离铵离子浓度最大,它与N,N-二甲基苯胺反应在此条件下具有最高的产率,生成的甲基橙颜色纯正,杂色少.因此在室温法和低温法中,它们的产率和纯度在这个pH值范围内较佳.

表3 反应pH对甲基橙产率和纯度的影响
为了进一步定性分析所制备的甲基橙的成分,采用13C固体核磁共振光谱(13CNMR)进行分析并对比了标准样品作参考.由图4可以看出,由室温制备的甲基橙和标准样品的13C NMR包含7个明显的共振峰,分别位于152.7,149.4,142.9,126.6,124.8,121.5和111.7处,对应着甲基橙分子式中不同位置的C(见图4c的分子式),图中没有发现甲基C的峰,这是由于该峰与溶剂的DMSO相重合,作背景处理时被扣除.对比两个样品的13C NMR的峰位可以发现室温制备的甲基橙的分子结构与标准样相一致,说明该方法合成的甲基橙纯度较高.

图5 不同样品的热重分析图
从上面的结果可以看出,室温法制备的甲基橙在产率和纯度比低温法制备的和商用甲基橙具有更明显的优势,这是因为:1)在室温中,其酸主要来自于对氨基苯磺酸自身的路易斯酸,不会产生促进重氮盐分解的过量亚硝酸,减少反应副产物生成,而且室温法是一锅法完成重氮化与偶合反应,新生成的重氮盐直接与N,N-二甲基苯胺结合,相比于低温法,减少了操作过程的误差;2)在常温合成法中,N,N-二甲基苯胺以游离的形式存在,两个甲基具有供电子效应,增加了苯环的电子密度,增加其亲核性,以利于与重氮盐正离子反应.在低温法中,酸性条件下N,N-二甲基苯胺的N以正离子的形式存在,其吸电子效应降低苯环的电子密度,也降低了N,N-二甲基苯胺的亲核性[7].综上分析,室温下合成甲基橙的反应有利于减少副反应,新形成重氮盐能够与N,N-二甲基苯胺快速耦合反应,形成稳定的甲基橙.
2.3 稳定性测试图5为不同样品的热重分析,从曲线可以看到,所有样品在100 ℃附近失去表面吸附的水.在370 ℃低温法制备的和商用样品出现断崖式的失重,而室温法合成的甲基橙在390 ℃发生此现象,表明甲基橙在此温度下发生裂解,生成分子更小的物质.在400 ℃后,所有样品的失重变得缓慢,表明苯环结构在此温度区间开始分解转化;在达到800 ℃时,低温合成的样品和商品的甲基橙失重率分别达到65%和67%,而常温合成法的甲基橙样品失重率为60%.基于热重的分析,说明常温下合成的甲基橙的热稳定性比低温下合成的甲基橙更优.
甲基橙是一种无挥发性,色泽牢固的染料,其具有相当高的抗氧化光分解的能力.以TiO2为催化剂,采用光催化降解甲基橙溶液评估其抗光降解的稳定性.图6a为采用吸光光度计测得样品水溶液的吸光度随时间变化曲线,从图中可以看出,随着光降解反应的进行,被测样品溶液中的甲基橙吸光度逐渐降低,对应的浓度也随之下降.商品的甲基橙经过150 min后,其吸光度为原来的19%,而低温法和室温法合成的的甲基橙分别为26%和48%,说明室温合成的甲基橙的稳定性最高.从图6b~6d紫外吸收光谱的强度可以看出,随着光催化降解反应时间的增加,其吸收强度下降.商品的甲基橙经过150 min后,其吸光强度为原来的20%,而低温和室温合成甲基橙分别28%和47%,这与吸光度的变化趋势相近.从图4b~4d的插图可以看到,经过光催化降解150 min后,室温下合成的甲基橙溶液橙色最深,表明其被光催化降解率最低,相对其他两个样品,它的稳定性最高.

图6 (a)不同合成方法的甲基橙在光降解过程中随时间的吸光度以及(b)低温合成的甲基橙、(c)室温合成的甲基橙和(d)商用甲基橙所对应的紫外可见吸收光谱
为了进一步验证室温制备的甲基橙具有较好的稳定性,分别测试甲基橙在酸碱、高温、强紫外照射和金属离子存在下的稳定性.由图7a可以看出,甲基橙在不同的pH值的最大吸收波长发生移动,随着pH的增加,吸收波长发生红移,这是由于酸性和碱性条件下,甲基橙分子式发生改变,吸收波长也随之改变.即使分子结构发生变化,甲基橙在酸性和碱性条件下,经过3 h,吸收强度几乎未发生改变,表明分子结构在酸性和碱性条件下很稳定.图7b为甲基橙溶液在不同的温度静置2 h后的吸收强度,从图中可以看出,在60 ℃以下,甲基橙对温度不敏感;随着温度上升至90 ℃,其最大吸收波长蓝移了14 nm,吸收强度仅下降11.30%,说明在高温下甲基橙发生一定程度的分解,但仍表现出具有较高的稳定性.图7c为甲基橙的耐光稳定性吸收图,从图可知,甲基橙即使经过12 h强紫外光的照射,吸光度几乎没有变化,说明具有优异的耐光性.图7 d为不同的金属离子对甲基橙溶液吸光强度的影响曲线图.选择四种常见的金属离子作为代表,由图可以看出,甲基橙在Mg2+、Al3+和Zn2+存在下,吸光度保持不变,表明与这些金属离子未发生配位、沉淀、分解等反应.然而,当甲基橙溶液含有Fe3+时,产生沉淀不溶于水,上清液的吸光度下降,最大吸收波长变宽,说明甲基橙在Fe3+存在下变得不稳定.从上面的结果可以看出,所制备的甲基橙具有耐酸碱、耐高温和耐紫外光降解的特性,而且在某些金属离子存在时具有较高的稳定性,稳定甲基橙的制备有助开发色泽牢固的染料.

图7 甲基橙溶液在各种条件下的吸光曲线图(a)不同的pH值;(b)不同的温度;(c)在一定光照强度下不同的时间;(d)含有不同的金属离子
3 结论
本研究采用室温法合成了高稳定性的甲基橙,方法操作简单,易于控制,通过紫外光谱、红外光谱和热重表明,室温合成的甲基橙分子具有较高的共轭效应,其稳定性比低温下合成的和商用的甲基橙优.通过光催化降解实验表明,室温下合成的甲基橙具有较高的抗光降解的稳定性.稳定的甲基橙的制备有助开发色泽牢固稳定的染料.
