贵州油茶软腐病病原检测
2020-07-15秦绍钊刘文霞张柱亭
秦绍钊,刘文霞,张柱亭
贵州油茶软腐病病原检测
秦绍钊,刘文霞,张柱亭
凯里学院大健康学院, 贵州 凯里 556011
贵州是我国主要油茶种植省份之一,油茶种植爆发病虫害导致产量与质量急剧下降,其中软腐病最为显著。本文以油茶软腐病中的粉芽孢杆菌为例,结合实时荧光PCR和巢式PCR技术,检测油茶软腐病病原菌。荧光PCR检测过程为:设计反应程序与标准曲线,确定引物浓度、Mg2+浓度,将油茶软腐病病原菌DNA作模板,通过特异性引物对L1/L2实现PCR扩增;在克隆质粒和病原菌XJ8-3-3悬液两种模板中,对比实时荧光PCR和普通PCR的灵敏度;向健康植株叶片注射软腐病粉芽孢杆菌悬液,培养5 d后,采集患病油茶植株根部、球茎等部位检测软腐病病原菌含量。巢式PCR检测病原菌过程为:菌株活化放置PDA平板培养两天并采集病原菌丝;根据油茶软腐病的ITS序列和GenBank中,近似种的ITS序列差异设计B1与B2两种特异性引物,经过预变性、变性等步骤完成扩增,扩增产物用于凝胶检测。检测结果如下:(1)两种模板环境下,实时荧光PCR检测灵敏度优于普通PCR技术100倍,叶柄组织的根部软腐病病原菌含量最少;(2)引物B1与B2检测油茶软腐病病菌得到405 bp左右的条带扩增产物,测序结果显示发病菌株的碱基序列和粉芽孢杆菌序列吻合。结果显示,两种PCR技术均可检测油茶软腐病病原中的粉芽孢杆菌,为防治油茶软腐病提供科学依据。
油茶; 软腐病; 病原检测
油茶是我国特有的油料植物树种,收获期产生大量茶油,茶油属于不饱和脂肪酸油脂范畴,是有益于人体的油脂类型[1]。油茶树除生产茶油以外,还能产生茶枯、茶壳等副产品[2],是医疗、生物医药、化学等领域的重要应用原料。因此,油茶的综合使用价值不可忽视[3,4]。近几年,油茶的种植优惠政策不断出台,国家的政策与财政支持下,油茶种植规模快速增加[5]。贵州是油茶种植大省,栽培的油茶品种一般为霜降、立冬子等系列[6]。大规模种植过程中,油茶病害频发是导致油茶产量与品质降低的关键原因[7]。油茶的病害种类繁多,软腐病为典型的油茶病害,发生频率较高、发病规模较大。在不同栽培环境、气候条件、管理方式影响下,油茶软腐病爆发程度有所差异。油茶软腐病的主要表现为落叶、叶片枯黄,因此又称为叶枯病或者落叶病。软腐病在油茶幼苗中发生的频率较高,造成植株落叶、无花芽分化,最终降低茶油产量。由于茶农不具备良好的软腐病鉴别能力,导致软腐病大规模爆发[8]。因此设计相关检测方法至关重要。
为改善油茶种植品质、提升油茶利用率,本文设计实时荧光PCR与巢式PCR技术,检测油茶软腐病的病原,从预估油茶发生软腐病的角度出发,需了解软腐病病原菌作用机制,掌握油茶软腐病病原信息。本文以油茶软腐病的粉芽孢杆菌为例展开研究,两种PCR技术均可快速、准确检测出油茶软腐病的病原菌,在预防与治理油茶软腐病方面具有重要意义。
1 材料与方法
1.1 材料来源
实验研究对象为贵州某茶园示范基地,按要求采集油茶植株叶片样本作为油茶软腐病病原鉴定材料。收集到供试油茶软腐病病菌在实验室中分离、检测、存储。图1为油茶软腐病发病叶片状态。

图 1 油茶软腐病叶片
1.2 材料处理
粉芽孢杆菌为本次研究的供试菌种,在实验室中完成分离、鉴定和提取,借鉴贵阳科技公司出品的说明书完成细菌总DNA提取。
1.2.1 实时荧光PCR检测技术的反应程序与标准曲线制作在前人研究基础上,改进基于荧光PCR技术检测茶油软腐病病原的反应体系,确定引物浓度为0.1、0.2、0.3 μmol·L-1,Mg2+浓度为2、4、6 mmol·L-1。SYBR Green Ⅰ反应体系包括四部分内容,一是两个由上海生物科技公司生产的SYBR Green Mater Mix,二是0.2 μmol·L-1的引物对L1/L2,三是4 mmol·L-1Mg2+,四是将适量的灭菌ddH2O添加至模板,20 μL时终止。在日本仪器公司生产的荧光PCR仪器中,完成PCR反应扩增。
检测模板为油茶软腐病病原菌总DNA,通过特异性引物对L1/L2实现PCR扩增,对扩增完成的片段回收并纯化,和大连公司生产的pMD18-T载体连接并转化成大肠杆菌DH5α,提取结果中的质粒在上海某生物工程公司测序。质粒标准品为稀释5次后的阳性克隆质粒2.4 ng·μL-1,荧光PCR反应DNA浓度如下:2.4×10-1ng·μL-1、2.4×10-2ng·μL-1、2.4×10-3ng·μL-1、2.4×10-4ng·μL-1、2.4×10-5ng·μL-1。最终构建实时荧光PCR检测的标准曲线横坐标为DNA浓度的对数值,纵坐标为Ct值。
1.2.2 巢式PCR菌株处理油茶粉芽孢杆菌株活化后放置在PDA平板上培养两天,基于CTAB方法采集病原菌丝,提取时需谨慎小心以免破坏菌丝[9]。本次实验提取油茶发病组织方法如下:在每个新发病组织添加0.5 mol/L的NaOH 50μL,以12000 r/min速度对研磨完成的组织试样离心,持续5 min,混合48 μL浓度为0.1 mmol/L的Tris与5 μL上清液,以备后续使用。
1.3 培养与检测
1.3.1 实时荧光PCR技术
(1)实时荧光PCR和普通PCR技术的灵敏度对比基于克隆质粒DNA的灵敏度检测设置:实时荧光PCR检测与普通PCR检测的模板均为配比完成的5种浓度的克隆质粒DNA,检测容量为1 μL,检测完毕基于ddH2O的对照结果判断实时荧光PCR检测技术检测克隆质粒的灵敏程度。
基于病原菌XJ8-3-3悬液的灵敏度检测设置:检测模板为稀释5个梯度的油茶软腐病菌活菌的悬液,体积为3.8×108cfu·mL-1;配比浓度为3.8×107cfu·mL-1、3.8×106cfu·mL-1、3.8×105cfu·mL-1、3.8×104cfu·mL-1、3.8×103cfu·mL-1、3.8×102cfu·mL-1、体积为3 μL的稀释菌液,辅助完成荧光PCR检测和普通PCR检测。
(2)实时荧光PCR发病植株检测采集健康无病患的油茶植株叶片,向健康植株叶片注射软腐病粉芽孢杆菌悬液,容量为1 mL、浓度为108cfu·mL-1,注射部位为植株假茎以下部位,接近于球茎的位置;设置空白对照组叶片,向其注射无菌水,两组样品注射完毕存储在恒温光照培养箱中,温度不高于26.5 °C;以昼夜交替的模式施加光照,培养周期为5 d。5 d后采集两种培养样品,采集患有软腐病的油茶植株的根部、球茎、中部假茎、叶柄、叶尖等部位待检测[10]。提取待检测样品的DNA后,即可开始PCR检测。
1.3.2 巢式PCR检测技术
(1)标准PCR反应体系与反应条件构建基于巢式PCR技术检测油茶软腐病病原时设计了B1与B2两种特异性引物,设计依据为油茶软腐病的ITS序列和GenBank近似种的ITS序列间的差异性,同样在上海某生物工程公司中合成。引物序列如下:B1:5'GGTCCGTAGGTGAACCT3';B2:3'GAGCGCTTCGGCCGGGG5'。

表 1 PCR反应溶液构成
四个阶段的反应条件如下:(1)93 °C环境下预变性4.5 min;(2)37个循环,此时执行93 °C变性1 min,61 °C退火30 s,71 °C延伸1 min;(3)71 °C持续延伸10 min;(4)4 °C保存。
(2)巢式PCR扩增第一轮反应物为ITS区通用的引物ITS1/ITS4,模板为1 µL PCR产物,B1、B2与模板组合完成巢式PCR扩增。表2为详细的反应程序。

表 2 Nested-PCR反应程序
扩增产物存储在4 °C环境中,混合1%的琼脂糖凝胶与3 μL的扩增产物,在28 min的电泳作用下,在凝胶成像系统中检测结果,并提取图像。
2 结果与分析
2.1 油茶软腐细菌实时荧光PCR检测体系的建立
基于实时荧光PCR技术检测油茶软腐病病原时,变化引物的浓度与Mg2+浓度改进检测效果。经过3次循环重复得到如下结果,扩增效率在92%~102%之间的前提条件是:引物浓度为0.1 µmol·L-1、0.2µmol·L-1、0.3 µmol·L-1、Mg2+浓度为4 mmol·L-1。上述结果趋近于理论扩增效率,所以将4 mmol·L-1作为Mg2+的最佳浓度。然后选取最佳引物,设置引物浓度0.1 µmol·L-1时,浓度较低导致模板定量误差增加,因为扩增曲线提前收敛;将引物浓度更改为0.3 µmol·L-1时,扩增效率在108%以上,该引物浓度过高;据此将0.2 µmol·L-1作为引物的适中浓度,此时的扩增效率趋近于1,且处于合理的扩增启动时机。最终将0.2 µmol·L-1、4 mmol·L-1作为改进的引物浓度与Mg2+浓度。
实时荧光PCR扩增体系,完成5个稀释梯度的克隆质粒的荧光PCR扩增,结果如图2所示。由图可知:模板采用2.4×10-1ng·μL-1、2.4×10-2ng·μL-1、2.4×10-3ng·μL-1、2.4×10-4ng·μL-1、2.4×10-5ng·μL-15种DNA浓度时,得到的扩增曲线呈现相对光滑、较大倾斜度的状态,同时循环阈值间隔匀称,呈现规律分布状态;比较之下,灭菌ddH2O未形成扩增曲线,由此得到实时荧光PCR检测体系的检测油茶软腐病病原菌DNA的灵敏度为2.4×10-5ng·μL-1。
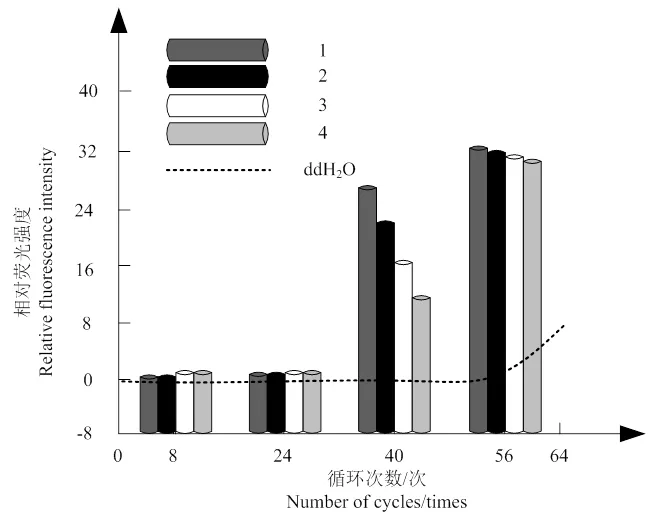
图 2 实时荧光扩增曲线
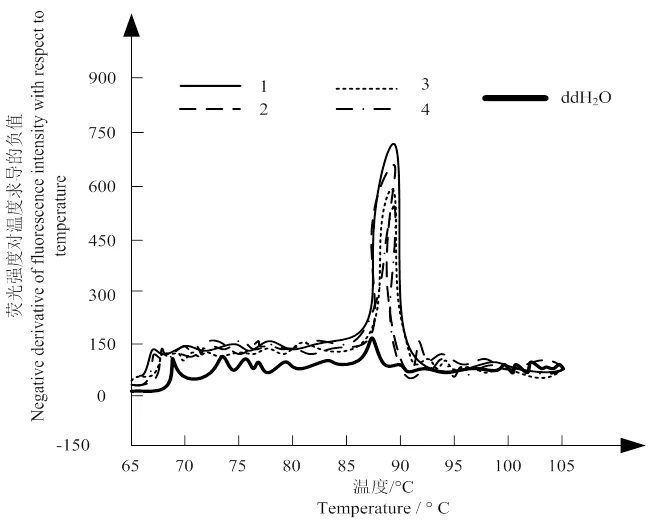
图 3 溶解曲线分析

图 4 标准曲线
图3为深层次溶解的曲线。若出现引物二聚体则表明溶解曲线处于异常状态,影响扩增效果;引物二聚体存在的表现为浓度模板产物的溶解曲线存在多样化的峰值。图3中并未出现多个曲线峰值,仅在温度约为78 °C时出现一次溶解峰值,因此证明该溶解过程中不存在引物二聚体,溶解效果较好。
图4为初始模板量对数和Ct循环数间的关系标准曲线,采用=-3.326+23.41描述标准曲线中克隆质粒DNA浓度的对数值和Ct值间的线性关系,其中,扩增效率与相关系数分别为94.3%、2=0.986。基于图1~3结果可知,本研究确定的实时荧光PCR检测体系、反应环境有效,可用于检测油茶软腐病病原。
2.2 实时荧光PCR技术检测结果分析
2.2.1 实时荧光PCR和普通PCR灵敏度对比图5为普通PCR扩增结果,为扩增模板是克隆质粒DNA 10倍稀释时的检测结果。模板为5个浓度的样品。由普通PCR扩增结果可知,2.4×10-1ng·μL-1、2.4×10-2ng·μL-1、2.4×10-3ng·μL-1三个浓度的样品可扩增出清晰靶带,2.4×10-4ng·μL-1浓度样品扩增的靶带不清晰,2.4×10-4ng·μL-1浓度样品并未扩增出靶带。据此确定普通PCR技术的检测灵敏度为2.4×10-3ng·μL-1,而实时荧光PCR检测的灵敏度为2.4×10-5ng·μL-1,由此可知,实时荧光PCR检测灵敏度约为普通PCR检测的100倍。
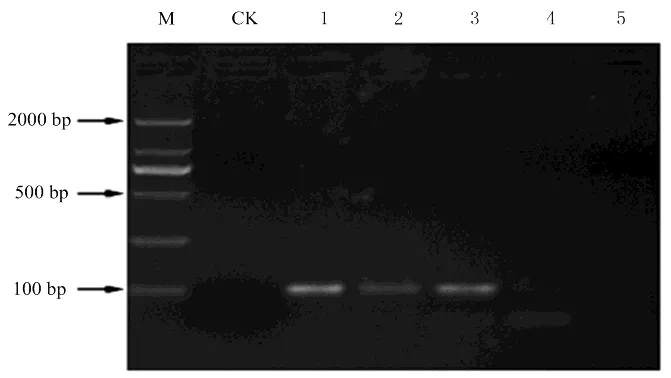
图 5 普通PCR检测灵敏度
变换检测模板,再次对比两种检测技术的灵敏度。普通PCR技术与实时荧光PCR技术灵敏度第二次对比模板为油茶软腐病菌活菌XJ8-3-3悬液,实时荧光PCR和普通PCR检测的软腐病病原菌浓度分别为3.8×104cfu·mL-1、3.8×102cfu·mL-1,所以实时荧光PCR检测灵敏度更强,且优于普通PCR技术100倍。
2.2.2 软腐病病原菌含量检测分析阳性检测样品为发病植株生长点腐烂叶柄组织、根部组织、球茎组织、中部假茎组织、叶片尖部等部分,阳性对照样品为不存在软腐病的健康油茶植株组织,检测对象为植株不同组织部分的DNA。反复测试三次,记录实验结果见表3与表4,表3为油茶植株不同部位组织DNA出现扩增信号时的Ct值,表4为对应的DNA含量。数据显示,叶柄组织的根部软腐病病原菌含量最少,球茎和中部假茎的软腐病病原菌含量较多,约达到93.74 pg·μL-1、96.85 pg·μL-1。
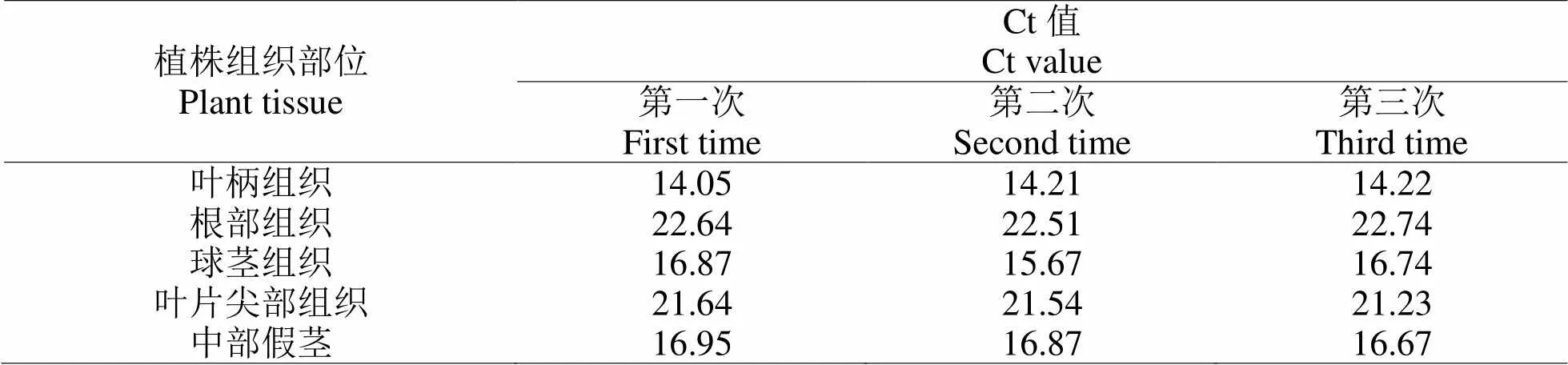
表 3 植株不同组织DNA扩增时的Ct值
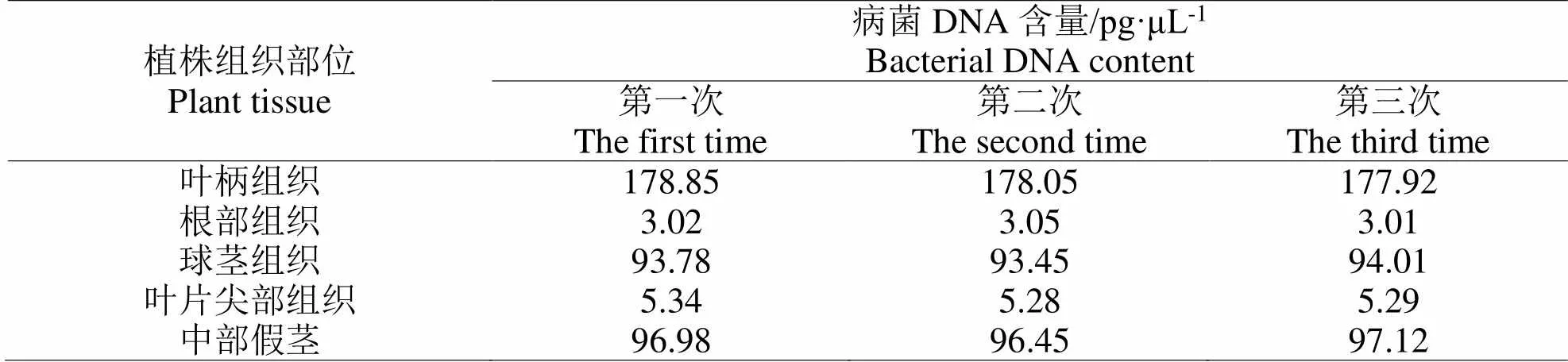
表 4 对应部位的DNA含量
观察软腐病注射5 d后的油茶植株叶片情况,整个叶片基本腐烂呈黑色,球茎内部逐渐发生清晰的褐色病变,假茎部分也呈现部分腐烂状态,相对而言,叶片的根部基本未发生病变,该结果和基于实时荧光PCR检测的病原菌检测结果吻合,病菌DNA含量高的组织发生病变的程度较大。
2.3 巢式PCR技术检测结果分析
2.3.1 引物B1与B2的特异性证明利用引物B1与B2检测油茶软腐病病菌能够得到扩增产物,为405 bp左右的条带,PCR扩增结果如图6所示。由此可知引物B1与B2具有特异性,可用于辨别油茶软腐病病原菌种类。

图 6 特异性引物B1/B2对PCR扩增产物的电泳分析
2.3.2 发病组织病原检测基于巢式PCR技术检测人工接种的油茶软腐病植株DNA,取2个发病样品、4个健康样品,检测结果如下:2个发病样品中扩增出405 bp左右的特异性条带,图7为扩增检测结果;但是健康的样品中并未扩增出条带。对扩增结果切胶回收测序,测序结果显示两个发病菌株的碱基序列一致,和粉芽孢杆菌的序列排列情况吻合。由此可证,巢式PCR技术可迅速检测油茶软腐病病原菌。
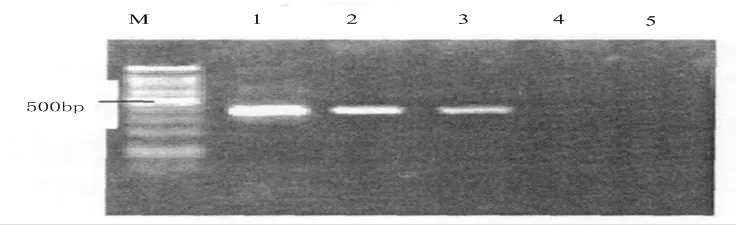
图 7 扩增检测结果
3 讨论
本次研究采用实时荧光PCR技术检测油茶软腐病病原时,以刘鹏等人的检测实验为前提改进PCR扩增体系,构建适合油茶软腐病病原粉芽孢杆菌的检测环境[11]。设置了菌液和克隆质粒两种形式的检测模板验证实时荧光PCR和普通PCR的检测灵敏度,结果显示,实时荧光PCR检测灵敏度约为普通PCR的100倍之多,该结果和以往专家研究结果吻合。另外,基于实时荧光PCR技术检测了油茶软腐病植株的不同组织部位,其中球茎组织和中部假茎组织的软腐病病原菌含量较多[12],约达到93.74 pg·μL-1、96.85 pg·μL-1,而根部组织的DNA含量最低。
基于巢式PCR技术扩增粉芽孢杆菌DNA,同时测定DNA的序列。设计引物B1、B2,联合使用ITS1/ITS4引物对扩增检测软腐病粉芽孢杆菌,测试结果显示,巢式PCR可快速检测油茶软腐病病原的粉芽孢杆菌。基于特异性引物的PCR检测技术是近年来使用频率较高的分子检测技术,普遍应用于植物病源菌的检测研究[13]。真菌核糖体基因ITS序列在不同真菌中呈现较高的变异特性、在真菌种内呈现较优的稳定性,是理想的真菌分子检测靶序列[14]。因此,本次研究基于巢式PCR扩增油茶软腐病病原菌的核糖体ITS基因,以检测软腐病的病原菌,该方式在植物病病原检测中得到广泛应用,取得较好的检测效果[15],为预测油茶软腐病发病状态、趋势提供可靠依据。
4 结论
本次研究以贵州茶园的油茶植株为对象,利用两种差异性PCR技术检测油茶软腐病病原菌,结果证明实时荧光PCR技术和巢式PCR技术均能快速检测到油茶软腐病的粉芽孢杆菌,灵敏度较高。此次研究为检测贵州油茶软腐病粉芽孢杆菌提供了两种可靠的研究途径,根据实验结果向茶农传授更多的油茶软腐病症状表现和防治知识,对于降低油茶软腐病发病几率具有重要意义。
[1] 文亚雄,刘君昂,刘小平,等.不同间作模式对油茶幼林病虫害发生的影响[J].经济林研究,2016,34(1):129-134
[2] 魏蜜,路露,李春琪,等.株油茶病害拮抗真菌的鉴定、生物学特性及拮抗作用研究[J].河南农业科学,2016,45(8):74-80
[3] 李河,李杨,蒋仕强,等.湖南省油茶炭疽病病原鉴定[J].林业科学,2017,53(8):43-53
[4] 陈志伟,龙梦琪,何小勇,等.油茶幼林复合经营系统中3种农作物的生长节律研究[J].浙江林业科技,2016,36(6):52-57
[5] 李杨,李河,周国英,等.油茶新炭疽病原鉴定及致病性测定[J].生物技术通报,2016,32(6):96-102
[6] 吴天乐,陈艺,马力,等.一株油茶炭疽病病原拮抗细菌的分离与鉴定[J].湖南林业科技,2016,43(5):62-66
[7] 龙满生,欧阳春娟,刘欢,等.基于卷积神经网络与迁移学习的油茶病害图像识别[J].农业工程学报,2018,34(18):202-209
[8] 冯洁.植物病原细菌分类最新进展[J].中国农业科学,2017,50(12):2305-2314
[9] Yuan JJ, Wang CZ, Chen HX,. Identification and Detection of AdulteratedAbel. Oils by Near Infrared Transmittance Spectroscopy[J]. International Journal of Food Properties, 2016,19(2):300-313
[10] 白剑宇,宋峰惠,吴正保,等.新疆红枣软腐病病原菌的鉴定[J].新疆农业科学,2017,54(8):1475-1480
[11] Borsu L, Intrieri J, Thampi L,. Clinical Application of Picodroplet Digital PCR Technology for Rapid Detection of EGFR T790M in Next-Generation Sequencing Libraries and DNA from Limited Tumor Samples[J]. Journal of Molecular Diagnostics, 2016,18(6):903-911
[12] 王星,周红宁.我国疟原虫PCR常用检测技术研究进展[J].中国病原生物学杂志,2018,13(3):318-321
[13] 刘学录,童金凤,马振刚.蜜蜂主要病害及其病原PCR检测研究进展[J].南方农业学报,2016,47(1):147-152
[14] Zhao Y,Xia QY,Yin YP,Comparison of Droplet Digital PCR and Quantitative PCR Assays for Quantitative Detection ofSub sp. citri[J]. Plos One, 2016,11(7):e0159004
[15] 程颖超,康华军,石延霞,等.辣椒疫霉菌RT-PCR检测技术的建立及应用[J].园艺学报,2018,45(5):997-1006
Detection of Soft Rot Pathogen ofin Guizhou Province
QIN Shao-zhao, LIU Wen-xia, ZHANG Zhu-ting
556011,
Guizhou is one of the main provinces ofin China. The outbreak of diseases and pests inresulted in a sharp decline in yield and quality, among which soft rot disease was the most significant. Takingas an example, the pathogen of soft rot ofwas detected by real-time fluorescent PCR and nested PCR. The detection process of fluorescent PCR was as follows: designing reaction procedure and standard curve, determining primer concentration and Mg2+concentration, using DNA of soft rot pathogen ofas template, amplifying L1/L2 by specific primers; comparing the sensitivity of real-time fluorescent PCR and ordinary PCR in two templates of cloned plasmid and XJ8-3-3 suspension of pathogen; injectingsuspension of soft rot into healthy plant leaves after cultivation for 5 days, the root and corm of diseasedplants were collected to detect the content of pathogenic bacteria of soft rot. Nested-PCR was used to detect pathogenic bacteria. The strains were cultured on PDA plate for two days and collected pathogenic hyphae. Two specific primers, B1 and B2, were designed according to the ITS sequence difference of the similar species in the ITS sequence ofsoft rot and GenBank. The amplified products were used for gel detection after pre-denaturation and denaturation. The results were as follows: (1) Under the two template environments, the sensitivity of real-time fluorescent PCR was 100 times higher than that of common PCR technology, and the content of pathogenic bacteria of soft rot in petiole tissue was the lowest; (2) primer B1 and B2 were used to detect soft rot pathogen of, and 405 BP band amplification products were obtained. The sequencing results showed that the base sequence of the pathogenic strain was identical with that of Bacillus farinosa. The results showed that both of the two PCR techniques could detectin the pathogen of soft rot of, and provide scientific basis for the prevention and control of soft rot of.
;oft rot; pathogen detection
S794.4
A
1000-2324(2020)03-0420-06
10.3969/j.issn.1000-2324.2020.03.006
2019-03-12
2019-04-05
贵州省科学技术基金(黔科合J字[2015]2132号);贵州省科学技术联合基金(黔科合LH字[2014]7240号)
秦绍钊(1981-),男,博士,副教授,研究方向:植物病害鉴定与综合防控技术研究. E-mail:sz_qin@163.com
