芒果果肉中总黄酮及芒果苷含量的测定
2020-07-14刘常凯杨黎何林飞
刘常凯 杨黎 何林飞

摘要:建立芒果(Mangifera indicaL)果肉中总黄酮及芒果苷含量的测定方法,采用紫外一分光光度计法测定总黄酮;采用高效液相色谱法测定芒果苷。结果表明,总黄酮在17-520 μg/mL浓度范围内呈现良好线性关系(R2=0.999 9),平均回收率为99.03%,RSD为1.42%(n=6);芒果苷在4.0-80.0 μg/mL浓度范围内呈现良好线性关系(R=0.999 9),平均回收率为101.59%,RSD为1.87%( n=6)。该方法简便、准确度高、重复性良好,可用于芒果果肉中总黄酮及芒果苷的测定。
关键词:总黄酮;芒果苷;紫外一分光光度计;液相色谱法
中图分类号:S667.7
文献标识码:A
文章编号:0439-8114( 2020)08-0138-03
D01:10.14088/j.cnki.issn0439-8114.2020.08.031
芒果(Mangifera indicaL-)是著名的热带水果,俗称“热带水果之王”。随着中国现代农业发展越来越迅猛,芒果的总产量已经跃居世界第二[1]。芒果果肉中总黄酮以及芒果苷等可用于功能性和生物活性化合物的含量丰富[2,3],总黄酮属于黄酮类化合物,具有抗炎、抗病毒、抗衰老等作用;而芒果苷是一种天然的清除自由基的抗氧化剂,也是一种天然的辐射保护剂。相关研究表明,芒果苷具有抗菌抗炎和抗菌抗病毒等作用[4,5]以及调节免疫等功效[6]。目前,检测总黄酮含量采用的是紫外分光光度计法。研究表明,高效液相色谱法(HPLC)具有高压、高速、高灵敏度、载液流速快、分析速度快和应用范围广等特点[7],检测芒果苷含量采用的是液相色谱法,但大部分研究是针对芒果的属性部分。因此,本研究采用紫外一分光光度计和液相色谱法分别对桂七芒果果肉中的总黄酮以及芒果苷含量进行了检测,为桂七芒果的进一步研究开发及药用价值提供试验基础。
1 材料与方法
1.1 材料
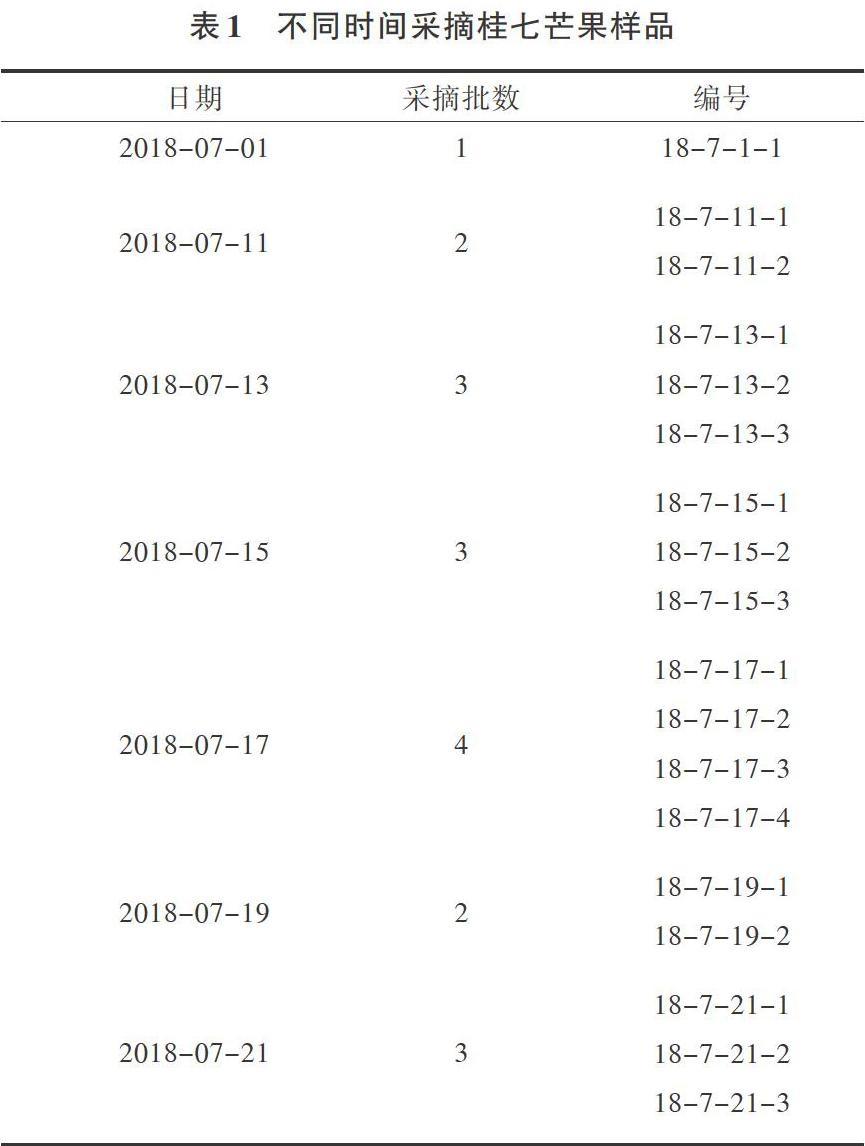
1.1.1 试验材料将百色地区生长成熟的桂七芒果分别按表1中不同时间进行采摘去皮、去核,取出芒果果肉,均质混合均匀。
1.1.2 仪器与试剂 紫外可见分光光度计UV-2700,日本岛津公司;电子天平ML204,瑞士梅特勒一托利多公司;高效液相色谱仪(液相色谱仪)Wa-ters 2695-2998,美国Waters公司。芦丁:批号201409,中国食品药品检定研究院,含量91.9%;芒果苷:批号111607-201704,中国食品药品检定研究院,含量98.1%;甲醇(色谱级)、乙腈(色谱级)、乙酸乙酯(色谱级)厂家均为默克股份两合公司;三氯化铝(分析纯),国药集团化学试剂有限公司;冰醋酸(分析纯),广东光华科技股份有限公司。
1.2 方法
1.2.1 总黄酮含量的测定
1)标准线性的制备。参考文献[8,9],称取12.60mg芦丁对照品置于10mL容量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得浓度为1.157 9mg/mL的标准储备液,已按91.9%计算,再精密量取1.50mL至10 mL容量瓶中,加甲醇溶液稀释至刻度,制得到浓度为173.685 μg/mL的标准工作液,吸取0、0.5、1.0、2.0、3.0、4.0、5.0 mL蘆丁标准溶液,分别置于10mL的具塞比色管中,加入2.0 mL三氯化铝溶液( 2.5 g/100mL)混匀,标准管加水定容,静置,在30 min内用1 cm比色皿,以零管调零,于波长415 nm处测定吸光度,以试剂空白作为参照。
2)样品处理。称取5 g经过均质的芒果样品,10 000 r/min离心10 min,后取上清液备用。吸取上述溶液1.0 mL于10 mL的具塞比色管中,分别加入2.0 mL三氯化铝溶液(2.5 g/100mL)混匀,静置,在30 min内用1 cm比色皿,以零管调零,于波长415nm处测定吸光度。
3)最大吸收波长的确定。精密吸取芦丁标准工作液1.0 mL置于10 mL容量瓶中,加入甲醇溶液稀释至刻度,以试剂空白作为参照,利用紫外可见分光光度计在波长350-500 nm进行扫描,芦丁对照品在415 nm吸收度最大。
1.2.2 芒果苷含量的测定
1)色谱条件。C18柱( IntertSustain,4.6mm×250mm,5μm),柱温30℃,流速1.0 mUmin,进样体积10.0 μL,检测器紫外检测器,检测波长280 nm。流动相:(A)乙腈,(B)质量分数0.3%乙酸溶液,采用的梯度洗脱程序:0-5 min,20%A;5.01-10.00 min,90%( A); 10.01-15.00min, 10%A;15.01-25.00min,20% A.
2)芒果苷标准储备液的制备。称取芒果苷标准品10.00 mg,置于25 mL容量瓶中,用30%乙腈溶液定容、摇匀,制成400.00 μg/mL芒果苷标准品储备液。
3)样品前处理。称取均质过芒果样品2.50 9,加入1mL 6 mol/L的HCI溶液,捣碎,加入20 mL蒸馏水,加20mL的乙酸乙酯,萃取2次,涡旋5 min后离心,分离出酯相和水相,将酯相合并,40℃旋蒸至于,再用5mL 30%乙腈溶液定容。
4)测定。在最佳测定条件进行HPLC分析,进样量为20 μL,根据测得各组分保留时间与标准溶液对比,对芒果苷进行定性分析,依据峰面积,利用标准品回归方程计算样品浓度。
2 结果与分析
2.1 总黄酮含量的测定结果
2.1.1 线性关系结果以吸光度为纵坐标,芦丁对照品的质量浓度(μg/mL)为横坐标绘制标准曲线,得到回归方程为y=0.002 847x+0.013 50,r=0.999 9(n=6),表明芦丁在质量浓度17-520 μg/mL,呈良好的线性关系。
2.1.2 精密度精密量取芦丁标准工作液1.0 mL置于10 mL容量瓶中,加甲醇溶液稀释至刻度,显色后连续测定6次,测定浓度平均值为17.16 μg/mL,RSD为0.51%,表明精密度良好。
2.1.3 重复性称取6份同一批次样品5 9,经处理后吸取上述样品1.0 mL于50 mL的具塞比色管中,显色后分别测定RSD为1.14%,表明重复性良好。
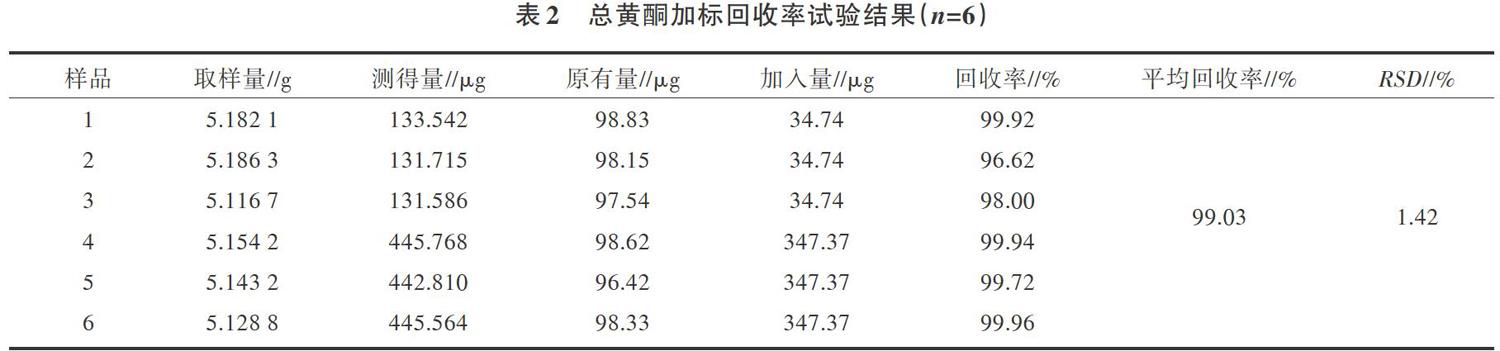
2.1.4 回收率试验称取已知总黄酮含量(57.18mg/kg)的6份芒果果肉样品5 9,分别按高低添加浓度加入芦丁标准溶液制备供试品试液,吸取上述1.0mL于10mL的具塞比色管中,显色后进行测定,平均回收率为99.03%,RSD为1.42%,表明该方法回收率较高(表2)。
2.1.5 实际样品测定吸取供试品溶液1.0mL于50mL的具塞比色管中,显色后进行测定,所得吸光度代入标准曲线中计算样品中总黄酮含量,其结果见表3。
2.2 芒果苷分量的测定结果
2.2.1 线性关系的考察精密量取标准储备溶液0.1、0.25、0.5、1.0、2.0mL,分别置于10mL容量瓶中,加30%乙腈溶液定容,即得4、10、20、40、80 μg/mL标准溶液,以峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,得到回归方程为y=9.428 x103x-5.055 1x103,R2=0.999 9(n=5),表明芒果苷在质量浓度4.0-80.0 μg/mL与峰面积呈良好的线性关系。
2.2.2 精密度试验精密吸取浓度为20 μg/mL中间浓度的芒果苷溶液,按上述最佳色谱条件,连续进样6次(n=6),RSD为0.66%,表明精密度良好。
2.2.3 重复性试验取同一批次样品共6份,制备2份供试品溶液,按上述最佳色谱条件进样测定,RSD为1.22%,表明重复性良好。
2.2.4 稳定性试验取同一供试品溶液,分别在0、2、6、8、12、24 h进样测定,RSD为0.54%,表明芒果供试品溶液在24 h内是稳定的。
2.2.5 回收率试验 称取6份已知芒果苷含量( 2.395 mg/kg)的芒果果肉样品5 g,分别添加高浓度(40 μg/mL)和低浓度(10 μg/mL)芒果苷标准溶液制备供试品试液(表4)。结果表明,平均回收率为101.59%,RSD为1.87%,该方法回收率较好。
2.2.6 实际样品测定分别称取5 9样品,制备2份供试品溶液,进行高效液相色谱检测,结果见表5。
3 结论
本试验建立了紫外一分光光度计比色法检测总黄酮含量及高效液相色谱法测定芒果苷含量,经过方法学验证,检测方法结果可靠,准确性高,精密度和重复性良好,对广西百色地区桂七芒果中总黄酮和芒果苷检测具有一定参考意义“叫。
参考文献:
[1]李日旺,黄国弟,苏美花,等.我国芒果产业现状与发展策略[J].南方農业学报,2013,44(5):875-878.
[2] LOPEZ-COBO A,VERARDO V. DIAZ-DE-CERIO E,et al.Useof HPLC-and GC-QTOF to determine hydrophilicand lipophilicphenols in mango fruit(Mangzfera indicaL.)and its hy-products[Jl. Food research international, 2017. 100(3):423-434
[3] ASIF A, FAROOQ U,AKRAM K, et al.Therapeutic potentials ofbioactive compounds from mango fruit wastes[J].Trends in food sci-ence& technology, 2016.53: 102-112.
[4]刘颖,郭明哗,白根本.绿原酸的研究进展[J].中药材,2012,35(7):1180-1185.
[5]杨海光,方莲花,杜冠华.芒果苷的药理作用研究进展[J].中国药理学通报,2016(1):5-8
[6]陈娟,胡刚,张宇,等,四氮杂大环镍配合物催化的BR振荡体系的新应用:检测咖啡酸[J].阜阳师范学院学报,2016,33(1):31-36.
[7]李晓波,屠鹏飞,中药材指纹体系[J].中草药,2003,34(5):385-387.
[8]王小明,陈碧,钟翠娟,等.均匀设计法优化甜茶叶中总黄酮提取工艺[J].食品研究与开发,2018,39( 24):55-62
[9]牛丽亚,刘宛玲,肖建辉,等.黑曲霉发酵法提取麦胚黄酮工艺的研究[J].食品工业,2015,36(11):1-3.
[10]李开通,张艺轩,曹阳,等HPLC法测定不同产地和品种石韦中绿原酸和芒果苷的含量[J].中国中药杂志,2010,36(2):104-107
作者简介:刘常凯(1986-),女,广西博白人,主管药师,主要从事食品药品质量与安全研究工作,(电话)15296388369(电子信箱)373719196@qq.com;通信作者,何林飞,主管药师,主要从事食品药品质量与安全研究工作,(电子信箱)2960215496@qq.com。
