Argonaute蛋白结构及其在植物中的研究进展
2020-07-14谷少伟
摘要:在真核细胞中,许多小的非编码RNA与Argonaute蛋白结合形成RNA诱导沉默复合体,并通过识别互补的靶标RNA来调控基因表达,此过程叫RNA干扰。在植物的RNA干扰途径中,Argonaute-sRNA复合物可以通过多种不同的机制发挥作用,进而参与病原体防御、植物发育调控等关键的生物过程。综述了Argonaute蛋白的分类和结构特征、在植物体中参与RNA干扰的机制及生物学功能等研究进展。
关键词:Argonaute蛋白;结构;RNA干扰;功能
中图分类号:Q51
文献标识码:A
文章编号:0439-8114( 2020) 08-0011-06
D01:10.1408 8/j .cnki.issn0439-8114.2020.08.002
开放科学(资源服务)标识码(OSID):
小的非编码RNA是原核生物和真核生物中基因表达控制的重要参与者。在真核生物中,几类小的非编码RNA通过特异性识别互补的靶标RNA来调节基因表达,并保护细胞免受外源性和内源性有害遗传物质的影响。Argonaute蛋白是RNA诱导沉默复合体( RISC)的核心蛋白,是表观遗传调控的主要参与者,在RNAi中通过剪切靶向mRNA、翻译抑制、DNA甲基化等方式发挥作用。本研究综述了Argonaute蛋白的分类和结构特征、在植物体中参与RNA干扰的机制及生物学功能等研究进展,旨在为后期研究提供基础。
1 Argonaute蛋白的分类和结构特征
Argonaute蛋白在拟南芥突变体的研究中被首次提及[1],后来发现该蛋白是真核生物中RNA干扰( RNA interference,RNAi)途径的关键参与者。最近对原核生物基因组分析的结果显示,Argonaute蛋白同时也存在于古细菌(约30%)和细菌(约10%)中[2.3]。
1.1 Argonaute蛋白的分类
Argonaute蛋白在各种生物中广泛存在,而且在不同的物种之间存在较高同源性,这表明它们在进化过程中具有古老的起源和高度保守性[2]。基于结构特征和作用机制,所有真核Argonaute蛋白可分为3个主要的进化枝,AGO、PIWI( P-element in-duced wimpy testis)、WAGO (Worm-specific Argo-nautes)。AGO进化枝蛋白可与microRNA( miRNA)或siRNA( small interfering RNA)结合诱导特异性的RNAi;PIWI进化枝蛋白仅发现于动物中,并通过piRNA( piwi-interacting RNA)调节转座子的活性[4];WAGO进化枝蛋白特异存在于线虫,如秀丽隐杆线虫(Caenorhabditi_s elegans)。
在进化过程中,Argonaute基因的数量和功能的多样化均有增加的趋势,尤其是开花植物所属的AGO进化枝。如人类中有4种AGO和4种PIWI,果蝇中有2种AGO和3种PIWI,而拟南芥(Arabi-dopsis中有10种ACO,杨树中有15种、玉米中有17种、水稻中有19种[5]。迄今为止,植物中发现的Argonaute蛋白均属于AGO进化枝。开花植物中AGO可分为3个主要分类:AG01/5/10、AG02/3/7和AG04/6/8/9。此外,禾本科植物中的AG018被划分人AG01/5/10进化枝中[6]。但也有一些真核生物中不存在Argonaute蛋白,如酿酒酵母(Saccharo-mVces cerevLsrae),这可能是RNA干扰系统二次损失的结果[7]。
1.2 Argonaute蛋白的结构特征
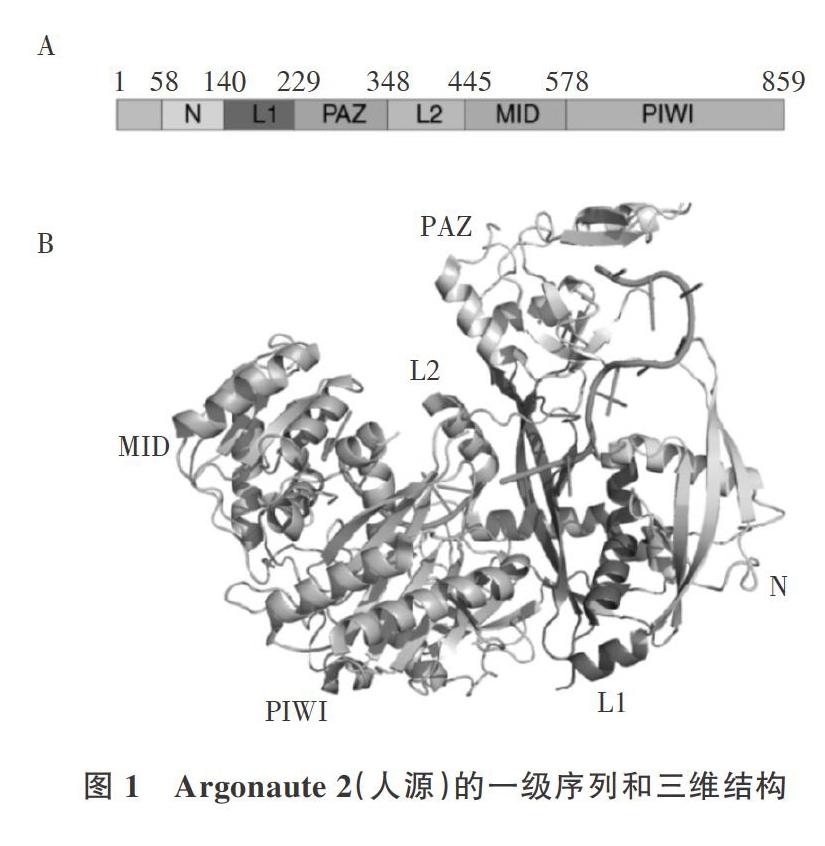
Argonaute蛋白属于PIWI蛋白超家族,其由PI-WI结构域的存在来定义。真核Argonaute蛋白在结构上是非常保守的,包括N末端、PAZ( PIWI-Ar-gonaute-Zwille)、MID( Middle)和PIWI 4个结构域,其由N末端、MID和PIWI 3个结构域形成新月形的底部凹槽,PAZ结构域位于凹槽正上方(图1)。其中,N端和PAZ结构域通过L1 (Linker l)连接,PAZ和MID结构域通过L2(Linker 2)连接,核酸结合在由N-PAZ和MID-PIWI形成的双叶通道中[8]。Argonaute蛋白的活性中心位于具有核糖核酸酶H( Ribonuclease H,RNase H)的PIWI结构域,其催化中心的氨基酸四联体Asp-Clu-Asp-His/Asp( DEDH/D)可以与金属离子配位,并且是RNA切割所必需的[9,10]。MID结构域含有容纳RNA指导链5 7末端核苷酸的口袋[11],PAZ是RNA指导链3'末端核苷酸的结合域,N端结构域参与RNA双链体的解旋并在RNA切割过程中起辅助作用[12,13]。迄今为止,已确定三维结构的真核Argonaute蛋白包括KpAgo,Human Agol、2、3及PIWI进化枝的SIWIll41(图IA、B均以Human Ag02为例,PDB为4W5N)。
原核Argonaute( pAgo)蛋白可分为2个大的系统发育组[15,16]。长pAgo含有与真核Argonaute( eA-go)蛋白相同的结构域(但AfAgo等缺失N-PAZ结构域),而短pAgo仅含有MID和PIWI结构域。目前,研究的真核Argonaute蛋白和长pAgo都有双叶结构,这些含有完整四分体的Argonaute蛋白一般都具有切割活性,但许多pAgo(含所有短pAgos)因存在必需催化残基取代而缺乏核酸内切酶活性。
2 植物Argonaute蛋白与RNAi途径
2.1 RNA诱导的沉默复合体
与真核Argonaute蛋白結合的小RNA包括miRNA、siRNA和piRNA。其中,miRNA和siRNA都需要经历核糖核酸内切酶Dicer的处理,但miR-NA必须首先被核酸内切酶Drosha加工成miRNA前体(precursor miRNA,pre-miRNA)[17]。之后成熟的RNA双链体结合到Argonaute蛋白上,并伴随着RNA双链的展开和siRNA、miRNA乘客链的解离,而siRNA、miRNA则通过糖一磷酸主链与Argonaute蛋白保持结合状态,形成RNA诱导的沉默复合体( RNA-induced silencing complex, RISC)[18].piRNA发现于后生动物中,它可以是单链且不依赖于Dicer和Drosha的切割[19]。与miRNA和siRNA不同,piRNA仅与PIWI进化枝蛋白结合,发挥对宿主基因表达、转座子抑制或抗病毒感染的调节作用[20]。
2.2 Argonaute在RNAi途径中的机制研究
植物中,Argonaute-sRNA复合物通过转录后基因沉默( Post-transcriptional gene silencing,PTCS)或转录基因沉默(Transcriptional gene silencing,TGS)的方式靶向互補DNA或RNA,从而在2个水平上影响基因表达:①转录后水平,在细胞质中,通过对靶标mRNA切割或抑制其翻译[21];②转录水平,在细胞核中,调节组蛋白或靶标DNA的甲基化[22,23]。此外,拟南芥中的AG01-miRNA与miR161和miR173基因座处的染色质相互作用,在盐胁迫条件下对miRNA基因进行转录调控[24];AC02还可以参与DNA双链断裂修复[25]。
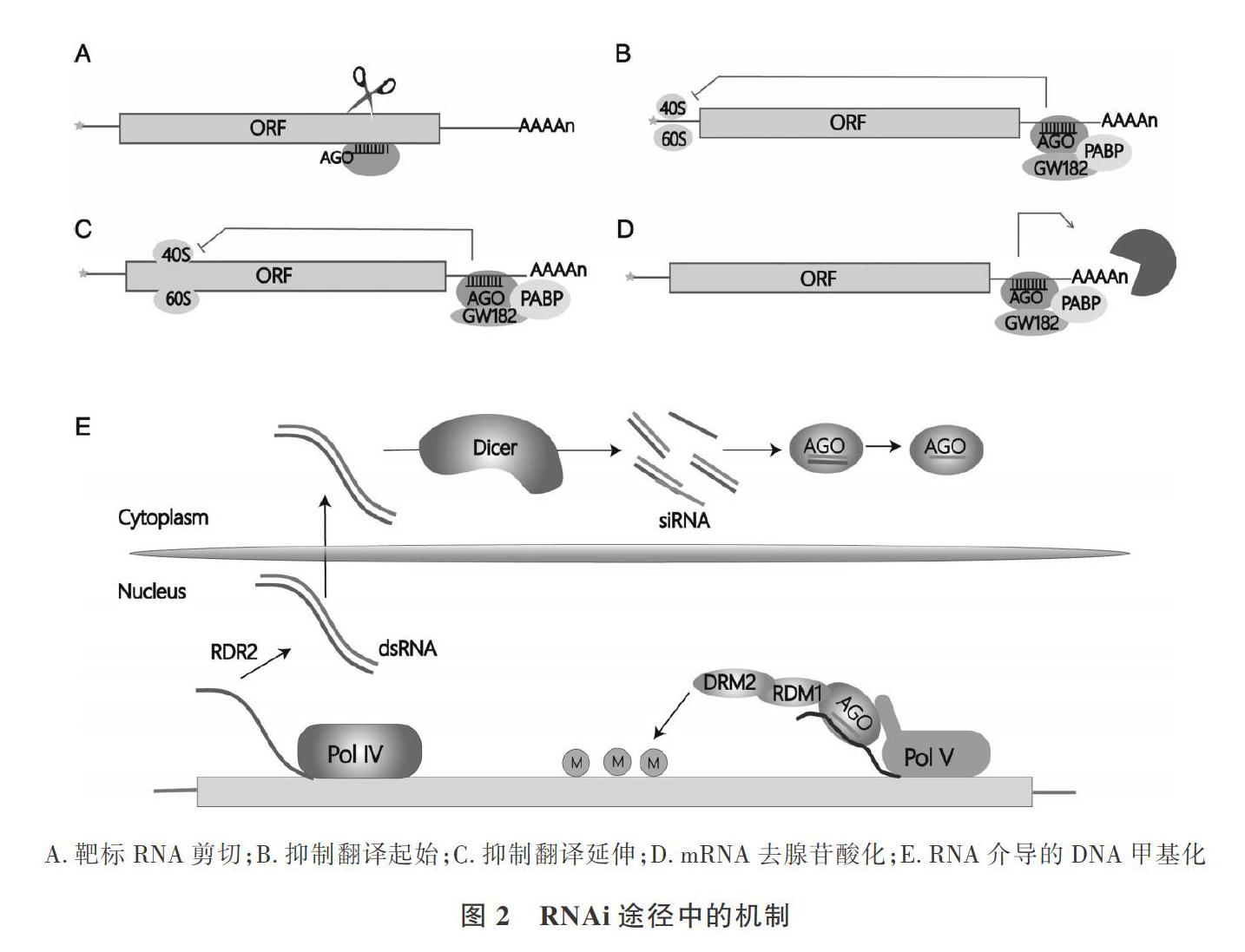
2.2.1 转录后基因沉默水平上的机制 在植物RNAi途径的转录后基因沉默水平上,Argo-naute-sRNA复合物与靶标mRNA结合后可能发生靶标RNA切割或翻译抑制。靶标RNA切割是siR-NA发挥作用的主要机制(图2A),而miRNA-RNA双链体只有在完全互补时才会发生靶标RNA切割[26]。因此,sRNA-RNA双链体中的链互补性在RNAi途径的机制选择中起重要作用。研究表明,拟南芥中AG01、AG02和AG07的剪切活性分别对植物发育、抗病毒活性和幼年至成年期转变的过程至关重要[27]。对野生型和AG01剪切活性缺失的拟南芥进行分析,发现AC01的剪切活性对反式作用干扰小RNA( trans-acting siRNA,tasiRNA)也十分重要[28]。
Argonaute-miRNA复合物在无法进行靶向切割的情况下,可以选择通过翻译抑制的方式调节基因的表达,这个过程通常伴随着mRNA降解以抑制复合物形成[29.30]。目前,尚不清楚翻译抑制是从哪一步发生的(翻译起始或延伸),但研究显示翻译起始可能是Argonaute-miRNA复合物发挥作用的主要位点(图2B、C)[31]。一种可能的机制是Argo-naute-miRNA复合物与elF4F的结合阻止了翻译起始复合物的组装[32];此外,miRNA-Argonautes复合物还可以募集GW182蛋白到靶标RNA 3非翻译区,结合多聚腺苷酸结合蛋白(poly A-binding pro-tein,PABP)抑制翻译起始,并且mRNA对去腺苷酸化也变得更敏感(图2D)[33]。研究表明,几种拟南芥突变体在miRNA介导的RNAi途径中出现了蛋白质而非mRNA水平的受损[34.35]:AG010(AG01进化枝的另一成员)也具有翻译抑制几种拟南芥miRNA靶基因的能力。最近,Hou等[36]发现AG07-iR390与miR390靶位点的结合导致了核糖体堆积并随后抑制翻译的延伸。目前,对翻译抑制的机制已有一些初步研究,但深入理解仍需要进一步研究。
2.2.2转录基因沉默水平上的机制 小RNA介导的转录沉默首先在裂殖酵母( Schizosaccharomycespombe)中被发现[37]。2017年,Jih等[38]发现H3K9me3是H3K9me结构域通过募集Clr4到异位点后建立表观遗传所必需的。因此,组蛋白的H3K9me状态不仅决定异染色质内的沉默机制,还决定其潜在的表观遗传性。
另外一种实现RNA干扰途径的机制为RNA介导的DNA甲基化(RdDM),最典型的是植物中的AG04-siRNA复合物[23]。它首先是由PolIV (RNA聚合酶IV)和RDR2(RNA依赖性RNA聚合酶2)的协同作用合成双链RNA[39],之后在核酸酶DCL3(Dicer like protein 3)的作用下将前体dsRNA切割成24 nt siRNA,然后将siRNA转运到细胞质与AC04结合[40]。AG04-iRNA复合物定位到细胞核后,通过与PolV转录物配对被募集到靶基因座,同时AG04-siRNA复合物募集DRM2蛋白使靶DNA甲基化(图2E)[41]。因此,RNA介导的DNA甲基化在真核细胞的遗传调节中起重要作用。最近,研究者提出AG06可同时与AG04介导大多数靶基因座的甲基化[42]。此外,AG06还可与RDR6介导的21-22 nt sRNA结合来指导拟南芥中转运子的甲基化[43]。
所有真核生物都含有小的非编码RNA和Argo-naute蛋白,参与mRNA转录和翻译的调控,控制移动遗传元件的活性,并参与染色质重组。而事实上,真核Argonaute只是原核Argonaute蛋白上形成的一个小分支,所以原核Argonaute实际上比真核Ar-gonaute在功能上更加多样化[2,44]。近年来,对原核Argonaute蛋白的结构和生化研究,特别是关于嗜热古细菌中Argonaute的研究揭示了引导链结合、靶标识别和剪切活性的详细途径,这为真核生物中RNAi的分子机制提供了重要的见解。
3 Argonaute在植物中的生物学作用
3.1 植物Argonaute与病原体防御
微生物病原体会导致作物严重的产量损失,由sRNA介导的RNA干扰(RNAi)在植物抗病毒防御的免疫应答中起关键作用[4副,Argonaute蛋白的功能障碍与许多动物和植物疾病有关[46]。在抗病毒中起作用的AGO进化枝蛋白包括拟南芥AG01、AG02、AG04、AC05、AC07和AG010,本生烟草(Nicoti-aha bentharniana)AC01和AG02以及水稻AGOI和AG018。如vsiRNA(病毒来源的RNA或dsRNA被植物DCL加工成病毒衍生的21-24 nt siRNA)与特异性Argonaute结合后,通过剪切或翻译抑制等方式增强抗病毒防御,从而靶向和抑制同源病毒RNA[47];此外,植物AGO还可以结合来自类病毒的sRNA减少体内类病毒的积累[48]。研究表明,拟南芥AG04独立于其RdDM功能,而对车前草花叶病毒(Ptantago asiatica mosarc VLrus)具有直接的抗病毒活性[49]。除了众所周知的抗病毒防御作用外,几种拟南芥AGO还具有抗菌活性,如AG02结合miR393b翻译抑制高尔基体定位的MEMB12基因,导致具有高抗菌活性PRl( Pathogenesis-related pro-tein)的胞吐作用[50]。
3.2 植物Argonaute在調控发育中的作用
在拟南芥中,首次被表征的AG01突变体使其表现出矮化、不育等发育缺陷[1]。之后,在拟南芥的发育筛选中鉴定出一系列造成发育缺陷的AC01等位基因,这些突变体的鉴定强调了AG01在叶极性和侧生器官发育中的作用,同时AC01突变体也在水稻上显示出侏儒症、卷叶和低结实率等发育缺陷特征51.52]。而拟南芥突变体AC07或AG010只显示出有限的影响发育缺陷的能力。其中,AG07与miR390结合后,靶向TAS3转录物并启动基于TAS3的tasiRNA合成,参与拟南芥侧生器官发育的调节;AG07参与苔藓、水稻和玉米等植物中TAS3介导的tasiRNA合成,这表明植物中AG07在ta-siRNA合成和植物发育中具有重要作用[50]。与普遍表达的AG01不同,AG010主要在近轴面叶原基和分生组织中表达,其突变体使拟南芥表现出异常的SAM发育,且观察结果表明,AG010可以从AG01中螯合miR165huiR166来调节SAM发育[53,54]。
3.3 植物Argonaute在减数分裂和配子发生中的作用
植物AGO在有性生殖过程中起关键作用,特异性的ACO蛋白优先表达于生殖组织并富含于生殖细胞中b副。在水稻中,减数分裂调控基因MEL1(Meiosis arrested at leptotene J)是5种AG05同源物之一,它的突变不仅诱导了减数分裂停滞和雄性不育,还诱导了异常的绒毡层和花粉母细胞[56]。在拟南芥中的研究表明[57],AG09介导的转座子和异染色质修饰对于其子房中特异性细胞的生存至关重要,它的突变导致了多个具有形成配子能力的细胞分化;在玉米中,AG09突变体在减数分裂期间阻止了染色体的分离。拟南芥和玉米AG09都在体细胞中起作用以非细胞自主方式调节细胞,拟南芥AC09抑制体细胞中的生殖细胞[57],而玉米AC09抑制生殖细胞中的体细胞[58]。在水稻中,OsAC02在花药中高表达并参与调节水稻花药的发育。Zheng等[59]发现在OsAG02表达下调的水稻中,己糖激酶l(OsHXKl)的过度表达导致ROS的过度积累,并诱导了过早的绒毡层程序性细胞死亡(PCD)和花粉败育。
4 小结
除上述内容外,植物中的AGO蛋白也可在非生物或生物胁迫下诱导产生。如水稻AG018积累是病毒感染诱导的结果;AG02是γ辐射、细菌感染诱导的结果;AG03是盐胁迫诱导的结果。不同AGO成员在时空上的差异及某些AGO对应激的反应表明存在一些调节AGO转录的因子,如拟南芥AG010的表达被转录因子LBD12-1抑制。但目前关于植物中AGO蛋白的转录调节因子尚不清楚。尽管已经对植物AGO有了较多的研究,但在未来的研究中需致力于发现其新的生物学功能。如AGO-sRNA复合物的靶标RNA在植物中是否高度保守,AGO蛋白中是否存在其他结合位点可以对小分子RNA进行特异性结合,互补程度少于多少才会使AGO-miRNA执行翻译抑制,不同的sRNA如何对AGO蛋白进行选择,植物中是否存在PIWI进化枝蛋白及piRNA等。其次,目前并未获得植物中AGO-sRNA复合物的晶体结构,而对晶体结构的研究有利于研究者掌握引导链结合、靶标识别和参与RNAi的机制,这将为真核生物中RNAi的分子机制和各种生物学功能的研究提供见解。
参考文献:
[1] BOHMERT K. CAMUS I, BELLINI C, et al_ AG01 defines a novellocus of Arabidopsis controlling leaf development[J]. Embo J, 1998,17(1):170-180.
[2] SWARTS DC. MAKAROVA K,WANG Y.et al.The evolutionaryjourney of Argonaute proteins[J]. Nat Struct Mol Biol. 2014. 21(9):743-753.
[3] KOONIN E V.Evolution of RNA-and DNA-guided antivirus de-fense sVstems in prokaryotes and eukaryotes: Common ancestrV vsconvergence[Jl. Biol Direct, 2017. 12(1):5
[4] ZARATIEGUI M,IRVINE D V,MARTIENSSEN R A.NoncodingRNAs and gene silencing [Jl. Cell, 2007. 128(4j:763-776.
[5] OLINA A V,KULBACHINSKIY A V,ARAVIN A A,et al.Argo-naute proteins and mechanisms of RNA interference in eukarvotesand prokaryotes[J]. Biochemistry (Mosc), 2018.83(5):483-497.
[6] ZHANG H, XIA R, MEYERS B C,et al.Evolution. functions. andmysteries of plant ARGONAUTE proteins[J].Curr Opin Plant Bi~ol,2015,27:84-90.
[7] DRINNENBERG I A,WEINBERC D E,XIE K T,et al.RNAi inbudding yeast[Jl. Science. 2009. 326( 5952): 544-550.
[8] TOLIA N H,JOSHUA-TOR L. Slicer and the Argonautes[J]. NatChem Biol. 2007.3(1):36-43.
[9] RIVAS FV,TOLIA N H.SONC J J,et al_Purified Argonaute2 andan siRNA form recombinant human RISC [Jl. Nat Struct Mol Biol.2005,12(4J:340-349.
[10] SONG J J,SMITH S K,HANNON G J,et al.Crvstal structure ofArgonaute and its implications for RISC slicer activity [Jl. Sci-ence. 2004. 305( 5689): 1434-1437.
[11] FRANK F. SONENBERG N. NAGAR B. Structural basis for5'-nucleotide base-specific recognition of guide RNA by humanAG02 [J]. Nature . 2010, 465 ( 7299) : 818-822.
[12] HAUPTMANN J, DUECK A.HARLANDER S. et al. Turning cata-lytically inactive human Argonaute proteins into active slicer en-zymes[Jl. Nat Struct Mol Biol. 2013, 20( 7) : 814-817.
[13] KWAK P B, TOMARl Y. The N domain of Argonaute drives du-plex unwinding during RISC assembly [J]. Nat Struct Mol Biol. 2012 . 19( 2) : 145-151.
[14] LISITSKAYA L.ARAVIN A A. KULBACHINSKIY A. DNA inter-ference and beyond: Structure and functions of prokaryotic Argo-naute proteins[Jl. Nat Commun. 2018. 9( 1) : 5165.
[15] HEGGE J W.SWARTS D C .VAN DER OOST J. Prokaryotic Argo-naute proteins : Novel genome-editing tools? [ J] . Nat Rev Microbi-01. 2018. 16( 1) : 5-11.
[16] WILLKOMM S. MAKAROVA K S. GROHMANN D. DNA silenc-ing by prokaryotic Argonaute proteins adds a new layer of defenseagainst invading nucleic acids [Jl. FEMS Microbiol Rev. 2018,42(3) :376-387.
[17] DENLI A M. TOPS B B . PLASTERK R H. et al. Processing of pri-mary microRNAs by the microprocessor complex [Jl. Nature,2004.432( 7014) : 231-235.
[18] MEIJER H A. SMITH E M. BUSHELL M. Regulation of miRNAstrand selection: Follow the leader? [Jl. Biochem Soc Trans.2014. 42( 4) : 1135-1140.
[19] HUANC X. FEJES TOTH K. ARAVIN A A. piRNA biogenesis indrosophila melanogaster [Jl. Trends Genet, 2017, 33 (11) : 882-894.
[20] MUSSABEKOVA A.DAEFFLER L. IMLER J L. Innate and intrin- sic antiviral immunity in Drosophila [J]. Cell Mol Life Sci. 2017 ,74(11) : 2039-2054.
[21] WANG Z, WANG Y . LIU T . et al. Effects of the PIWI/MID domainof Argonaute protein on the association of miRNAi's seed basewith the target [J]. Rna.2019, 25( 5) : 620-629.
[22] ROCERS K. CHEN X. Biogenesis. turnover. and mode of actionof plant microRNAs[J]. Plant cell, 2013 .25 ( 7) : 2383-2399.
[23 ] LAW J A, JACOBSEN S E. Establishing . maintaining and modify-ing DNA methylation patterns in plants and animals [Jl. Nat Rev Genet.2010. 11 ( 3 ) : 204-220.
[24] DOLATA J. BAJCZYK M . BIELEWICZ D. et al. Salt stress revealsa new role for ARGONAUTEl in miRNA hiogenesis at the tran-scriptional and posttranscriptional levels [J] . Plant Physiol. 2016 ,172 ( 1) : 297-312.
[40] XIE Z X, JOHANSEN L K, GUSTAFSON A M. et al. Genetic andfunctional diversification of small RNA pathways in plants [J].PLoS Biol. 2004. 2(5) : e104.
[41 ] ZHONG X. DU J. HALE CJ. et al. Molecular mechanism of actionof plant DRM de novo DNA methyltransferases [Jl. Cell, 2014,157(5 ) : 1050-1060.
[42] DUAN C G. ZHANC H. TANG K. et al. Specific but interdepen-dent functions for Arabidopsis AG04 and AC06 in RNA-directedDNA methylation[J]. Embo J.2015 , 34( 5 ) : 581-592.
[43] MCCUE A D. PANDA K. NUTHIKATTU S. et al. ARCONAUTE6 bridges transposable element mRNA-derived siRNAs to the es-tablishment of DNA methylation LJl. Embo J. 2015. 34 (1) :20-35.
[44] MAKAROVA K S. WOLF Y I. VAN DER OOST J, et al. ProkarV-otic homologs of Argonaute proteins are predicted to function as key components of a novel system of defense against mobile genet-ic elements [J]. Biol Direct . 2009. 4 : 29.
[45] CARBONELL A . CARRINGTON J C. Antiviral roles of plant AR-GONAUTES [J]. Curr Opin Plant Biol. 2015. 27 : 111-117.
[46] FANC X. QI Y. RNAi in plants : An Argonaute-centered view [J]. Plant cell, 2016. 28( 2) : 272-285.
[47] SZITTYA G. BURGYAN J. RNA interference-mediated intrinsicantiviral immunity in plants [J]. Curr Top Microbiol Immunol.2013. 371: 153-181.
[48] MINOIA S. CARBONELL A. DI SERIO F. et al. Specific Argo-nautes selectively bind small RNAs derived from potato spindle tu-ber viroid and attenuate viroid accumulation in vivo [J]. J Virol,2014. 88( 20) : 11933-11945.
[49] BROSSEAU C .EL OIRDI M.ADUROGBANCBA A . et al. Antivi-ral defense involves AC 04 in an Arabidopsis-potexvirus interaction[Jl. Mol Plant Microbe Interact.2016. 29 ( 11 ) : 878-888.
[50] CARBONELL A. Plant ARCONAUTEs : Features . functions. and unknowns[J]. Methods Mol Biol. 2017 . 1640 : 1-21.
[51] WU L, ZHANG Q.ZHOU H. et al. Rice microRNA effector com-plexes and targets [J]. Plant cell. 2009. 21( 11 ) : 3421-3435.
[52] YANG L.HUANC W, WANC H . et al. Characterizations of a hypo-morphic Argonautel mutant reveal novel AG01 functions in Arabi-dopsis lateral organ development[J]. Plant Mol Biol. 2006. 61 ( 1-2) :63-78.
[53] LYNN K, FERNANDEZ A. AIDA M. et al. The PINHEAD/ZWILLE gene acts pleiotropically in Arabidopsis development andhas overlapping functions with the ARCONAUTEl gene IJl. De-velopment. 1999. 126( 3) : 469-481.
[54] ZHU H , HU F. WANG R. et al. Arabidopsis Argonautelo specifi-cally sequesters miR166/165 to regulate shoot apical meristem de-velopment[J]. Cell. 2011 . 145 ( 2) : 242-256.
[55] BORGES F. MARTIENSSEN R A. The expanding world of smallRNAs in plants [Jl. Nat Rev Mol Cell Biol. 2015. 16 (12) :727-741.
[56] NONOMURA K. MOROHOSHI A . NAKANO M, et al. A germ cellspecific gene of the ARGONAUTE family is essential for the pro-gression of premeiotic mitosis and meiosis during sporogenesis inrice[J]. Plant cell. 2007 . 19( 8) : 2583-2594.
[57] OLMEDO-MONFIL V. DURAN-FIGUEROA N. ARTEACA-VAZQUEZ M. et al. Control of female gamete formation by a smallRNA pathway in Arabidopsis [J]. Nature. 2010. 464 (7288) :628-632.
[58] SINCH M . COEL S. MEELEY R B .et al. Production of viable gam-etes without meiosis in maize deficient for an ARGONAUTE pro-teinEJl. Plant cell. 2011 .23 ( 2) : 443-458.
[59] ZHENG S. LI J. MA L. et al. OsAC02 controls ROS productionand the initiation of tapetal PCD by epigenetically regulating Os-HXKl expression in rice anthers [J]. Proc Natl Acad Sci USA.2019 .116(15) : 7549-7558.
作者簡介:谷少伟(1993-),女,河北石家庄人,在读硕士研究生,研究方向为结构生物学,(电话)13716765867(电子信箱)ladiosa9310@163.com。
