SIRT1/p53和SIRT1/FoxO3a信号通路在COPD患者Ⅱ型肺泡上皮细胞衰老中的作用研究
2020-07-14顾超肖琴锋应樱陶峰张齐曹林峰
顾超 肖琴锋 应樱 陶峰 张齐 曹林峰
肺泡结构的破坏、肺组织降解以及气腔的扩大是导致慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)中气流受限重要原因[1]。目前为止,尚无足够有效的药物能够阻止COPD患者肺功能的下降[2]。修复已经损伤的肺组织,并且使丢失的肺泡组织再生是目前COPD治疗的关键及难点问题。Ⅱ型肺泡上皮细胞(AECⅡ)可以补充自身数量,也可分化为AECI,并合成以及分泌肺泡的表面活性物质,以及进一步维持肺泡内外液体的平衡等[3]。Sirtuins是Ⅲ型组蛋白的去乙酰化酶,可以对多种非组蛋白进行去乙酰化,并且在基因转录、能量代谢和细胞衰老中起重要作用[4]。本研究通过SIRT1/p53和SIRT1/FoxO3a信号通路检测其在COPD患者AECⅡ衰老中的相关作用。
1 材料与方法
1.1 一般资料 (1)患者入组:2017年1月至2018年12月在本院行手术治疗的非小细胞肺癌且不伴COPD患者(A组)及COPD伴非小细胞肺癌(NSCLC)患者(B组)各20例。COPD伴NSCLC患者入选标准:符合COPD诊断标准,且第一秒用力呼气量占所有呼气量比值(FEV1/FVC)<70%,50%≤一秒用力呼气容积(FEV1)<80%的预计值;符合NSCLC诊断标准,TNM分期为Ⅰa-Ⅱb期;拟行肺癌手术治疗;2周内无COPD急性加重史;无支气管哮喘。NSCLC且不伴COPD患者入选标准:符合国际肺癌研究协会(IASLC)2009年NSCLC诊断标准,TNM分期为Ia-IIb期;无COPD、支气管哮喘等慢性气道疾病;拟行肺癌手术治疗。排除标准:存在除NSCLC以外其他恶性肿瘤史者;存在心、肝、脑等重要脏器功能不全的患者;有血液系统的相关疾病或者严重的凝血功能障碍患者;使用全身糖皮质激素者;使用化疗药物治疗者。所取标本选自距肺癌病灶手术切除边缘阴性5cm以外的肺组织,大小约1cm3,于-80℃保存。本项目由嘉兴市第一医院伦理委员会批准,所有患者均签定知情同意书。(2)主要试剂:兔抗人的FoxO3a抗体(购于美国的Cell Signaling Technology公司);细胞衰老的β-半乳糖苷酶染色盒及兔抗人p53抗体(购于江苏碧云天公司);TRIzol(购于美国的Invitrogen公司);兔抗人SIRT1、SPA及SPC抗体及羊抗兔的IgG二抗(购自美国的Santa Cruz公司);SIRT1去乙酰化酶检测试剂盒(美国Enzo Life Sciences公司)。
1.2 方法 (1)肺组织的病理学测定:两组患者的肺组织,于4%的甲醛中固定,脱蜡至水,后行HE染色,并按照本课题组前期的方法[5],分析平均肺泡面积(MAA)和肺泡的平均内衬间隔(MLI)。(2)采用 Real-time PCR测 定 SIRT1、p53及 FoxO3a mRNA水平:收集两组患者肺组织,GAPDH作为内参;并以2-ΔΔCt来分析目的基因的相对表达差异。引物序列:SIRT1正义链5'-GCAGATTAGTAGGCGGCTTG-3',反 义 链 5'-ACTTTCATCCTCCATGGGTTC-3';p53正义 链5'-ACCACCATCCACTACAACTACAT-3', 反 义链 5'-CAGGACAGGCACAAACACG-3';FoxO3a正义 链5'-TGGCAAGCACAGAGTTGGATGA-3', 反 义链 5'-TGGCGGGAGCGTGATGTTAT-3'。GAPDH 正义链5'-TGAAGGTCGGAGTCAACGG-3',反义链5'-CTGGAAGATGGTGATGGGATT-3'。(3) 采 用Western blot检测SIRT1、p53及FoxO3a的蛋白表达:取新鲜的肺组织100g来用于提取总蛋白,取含有20μg蛋白的样品变性上样,后行电泳、转膜后予封闭,加入兔抗人SIRT1、p53及FoxO3a抗体孵育,之后加入山羊抗兔IgG孵育,凝胶成像系统扫描。(4)免疫组化法测定SPA及SPC蛋白的表达水平:肺组织切片,山羊血清予封闭,加入SPA或SPC抗体进行孵育,后加入抗兔IgG孵育,最后采用DAB显色以及苏木素复染后封片。(5)SA-β-gal活性测定:采用染色法测定患者的肺组织SA-β-gal的活性,按照试剂盒说明操作。(6)SIRT1去乙酰化酶活性测定:采用比色法检测两组患者的肺组织SIRT1去乙酰化酶活性,按照试剂盒说明操作。
1.3 统计学方法 采用SPSS 20.0统计软件。计量资料以()表示,采用方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 肺组织的病理学变化 两组患者肺组织HE染色,B组患者的肺组织中呈现肺气肿的表现:包括部分肺泡囊状的扩张,并且肺泡腔不规则,以及相同视野内的肺泡数目减少,肺泡间隔出现断裂,相邻肺泡融合,见图1。半定量分析显示,B组患者的肺组织中的MAA和MLI明显高于A组(P<0.05),见表1。
表1 两组患者肺组织MLI及MAA变化(,n=20)

表1 两组患者肺组织MLI及MAA变化(,n=20)
注:与A组比较,*P<0.05
组别 MLI(μm) MAA(μm2)A组 38.43±3.14 3212.68±126.36 B组 190.12±15.22* 21008.14±771.63*
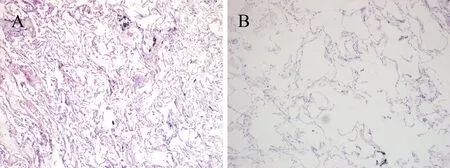
图1 两组患者肺组织病理学变化(HE染色,×100)
2.2 SIRT1、p53及FoxO3a表达水平 Real-time PCR及 Western blot分 别 测 定 SIRT1、p53及 FoxO3a的mRNA及蛋白表达水平,结果显示,与A组比较,B组患者肺组织中SIRI1及FoxO3a的mRNA及蛋白表达显著降低(P<0.05),而p53的mRNA及蛋白表达增加(P<0.05),见图 2、3。
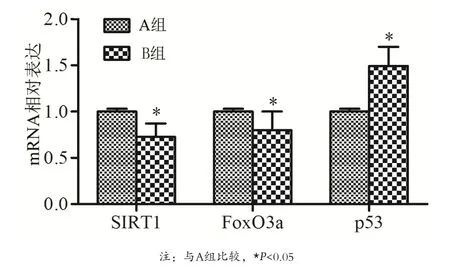
图2 两组患者肺组织SIRT1、p53及FoxO3a mRNA相对表达变化
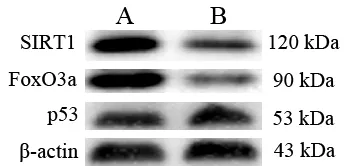
图3 两组患者肺组织SIRT1、p53及FoxO3a 蛋白表达变化
2.3 SPA和SPC蛋白的表达水平 SPA及SPC蛋白阳性细胞呈现胞浆着黄棕色,位于肺泡角部的AECⅡ,与A组比较,B组患者肺组织中SPA及SPC阳性细胞明显减少,见图4、5。
2.4 SA-β-gal的活性变化 在肺组织中被染色成蓝色的细胞被认为是SA-β-gal阳性,即为衰老的细胞,主要位于肺组织肺泡的角部。与A组比较,B组患者中SA-β-gal阳性的细胞增加,见图6。
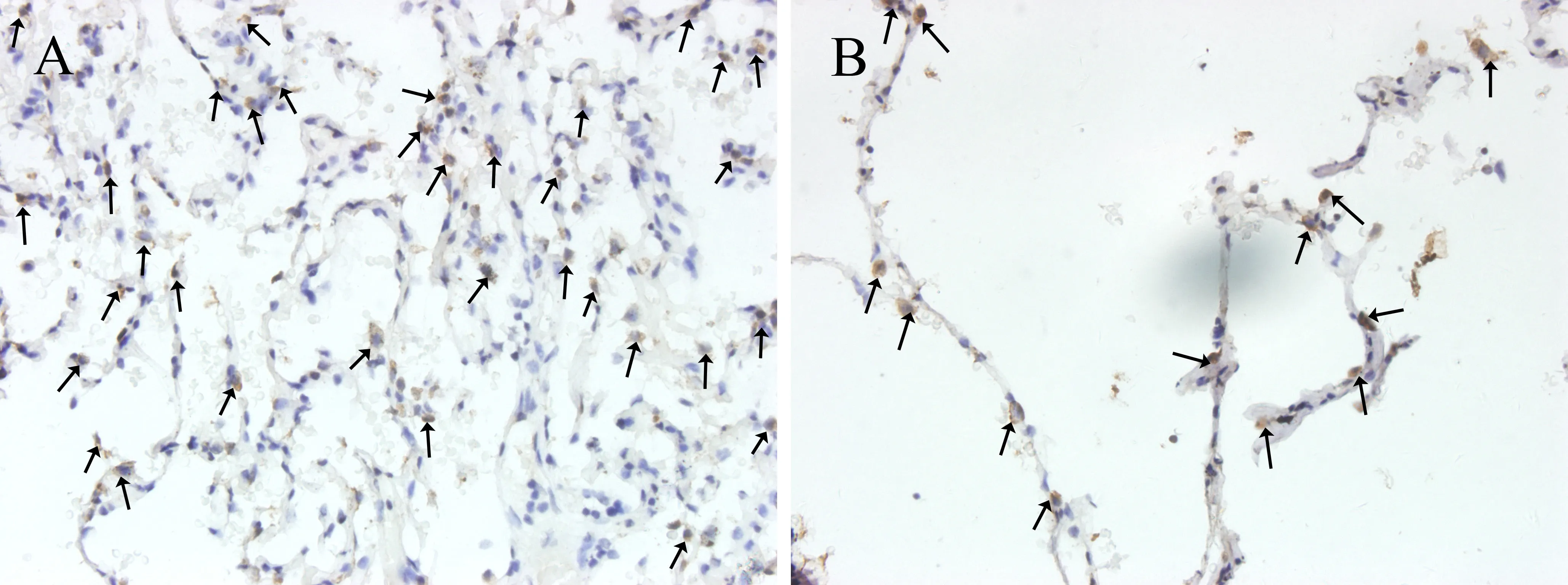
图4 两组患者肺组织SPA蛋白表达(×400)注:黑色箭头示SPA阳性细胞
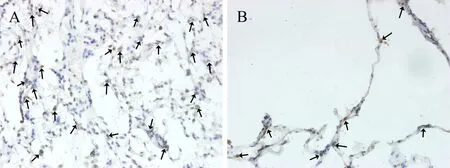
图5 两组患者肺组织SPC蛋白表达(×400)注:黑色箭头示SPC阳性细胞
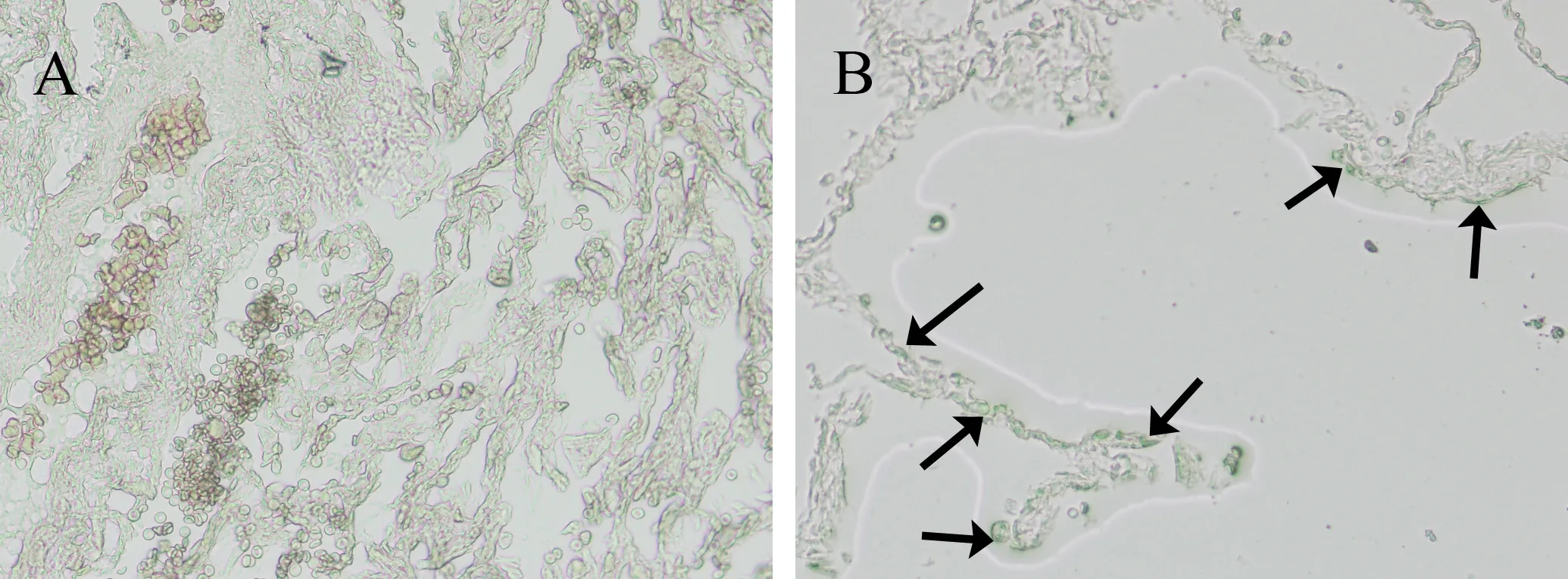
图6 两组患者肺组织SA-β-gal活性变化(×400)注:黑色箭头示SA-β-gal阳性细胞
2.5 SIRT1去乙酰化酶活性改变 采用比色法测定两组患者肺组织中SIRT1去乙酰化酶的活性,结果显示,与A组比较,B组患者肺组织中SIRT1去乙酰化酶活性明显降低(P<0.05),见图 7。
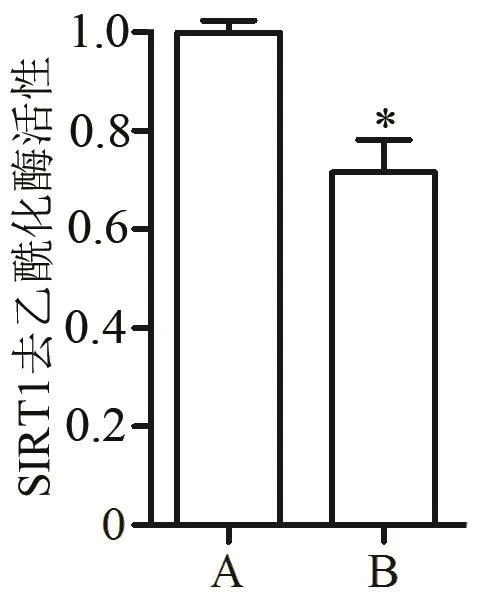
图7 两组患者肺组织SIRT1去乙酰化酶活性比较(注:与A组比较,★P<0.05)
3 讨论
目前为止,COPD被认为是全球死亡原因的第 4 位[2,6],在我国 >40 岁患病率达到 8.2%[7]。肺泡结构的破坏及丢失和气腔扩大、肺弹性组织降解以及小气道阻塞是COPD特征的病理表现,并且也是肺功能下降关键性原因[2]。本研究中,COPD患者肺组织中的部分肺泡囊状扩张,肺泡腔的不规则,相同视野里的肺泡数目减少,肺泡间隔出现断裂,相邻的肺泡融合,符合COPD肺组织病理学表现。AECⅡ覆盖肺泡总面积的5%,虽然AECI数量是AECⅡ的一半,但覆盖了肺泡总面积95%。AECⅡ也能合成并分泌肺泡的表面活性等物质。AECⅡ对于维持肺泡正常结构及功能具有重要的意义。SPA及SPC是由AECⅡ特异性地分泌,其在减小肺泡表面的张力中起到重要的作用。AECⅡ是AECI的祖细胞,当AECⅡ严重受损时会导致肺泡结构受损和阻碍肺泡的修复[8-9]。在本研究中,COPD患者肺组织中的SPA以及SPC蛋白表达的水平明显降低,表明肺组织中AECⅡ存在受损情况。
相关研究显示:在COPD患者中的细胞衰老加速,进一步促进COPD的发生和发展[10]。因此,肺泡上皮细胞的异常表达可能与其过早衰老有关,AECⅡ衰老可能促进COPD发展,而深入研究AECⅡ衰老的调控机制可能为COPD治疗提供新靶点。SIRT1目前被认为是人类的长寿相关基因。SIRT1可以将H1、H3的组蛋白进行去乙酰化,还能将p53和叉头框蛋白O等非组蛋白去乙酰化,并在细胞衰老、基因转录及能量代谢中具有重要的作用[4]。吸烟人群外周肺组织中的细胞核SIRT1水平明显降低;并且SIRT1表达下调可以促进COPD患者内皮祖细胞出现衰老以及功能异常[11]。p53是最早发现的SIRT1非组蛋白底物,其可激活靶基因p21转录,将细胞周期阻滞在G1/S期,进而抑制细胞增殖以及进一步促进细胞衰老[12]。SIRT1则可使p53特异位点赖氨酸残基去乙酰化或作用于p53靶基因启动子,抑制p53活性、延缓细胞衰老。FoxO3a是insulin、IGF等信号通路关键性下游调节靶点;在insulin或IGF刺激下,FoxO3a发生磷酸化,SIRT1与其形成蛋白复合物,使其去乙酰化、转位出核,抑制p27等基因表达、促进细胞存活[13-14]。COPD患者气道组织中核内FoxO3a的表达亦与其细胞衰老水平一致[15]。SA-β-gal是细胞衰老的重要相关标记[16]。在本研究中,B组患者肺组织中SIRI1及FoxO3a mRNA及蛋白表达明显低于A组,而p53 mRNA及蛋白表达高于A组;并且肺组织中的SA-β-gal阳性的细胞显著增加,SIRT1去乙酰化酶活性明显降低。
综上所述,SIRT1/p53和SIRT1/FoxO3a信号通路通过下调SIRT1和FoxO3a的表达及上调p53的表达来调控COPD患者Ⅱ型肺泡上皮细胞的衰老。但是,FoxO3a与p53信号通路之间的交汇对话机制仍需进一步研究。
