超声联合CT检查在肝恶性肿瘤射频消融治疗中的应用价值探讨*
2020-07-10宣之东张丽静
郑 雪,宣之东,王 玉,张丽静
肝癌是一种具有恶性程度高、进展迅速和预后差等特点的全球性疾病,其发病率和死亡率均居恶性肿瘤的前五位[1]。大多肝恶性肿瘤患者会合并肝硬化,加上其发病往往比较隐匿,早期症状不典型,大多数肝癌患者在就诊时已是中晚期而失去了根治性手术切除的机会,预后较差[2]。射频消融术(radiofrequency ablation, RFA)是近年来兴起的一种新的在影像学设备引导下进行的微创性原位治疗肿瘤手术,已被大量临床报道证实其治疗肝癌的局部疗效和安全性好[3]。目前,临床上广泛开展的引导RFA治疗的影像学方法主要有计算机断层扫描(computed tomography, CT)引导和超声引导。然而,单独采用CT平扫或超声引导,由于可能存在应用死角和盲区,导致特殊部位的肿瘤显示不清,影响RFA的治疗效果[4]。本研究尝试采用超声联合增强CT检查引导RFA治疗,观察了治疗疗效情况,现报道如下。
1 资料与方法
1.1 临床资料 2017年3月~2019年1月我院收治的肝恶性肿瘤患者96例,男性47例,女性49例;平均年龄为(57.69±5.78)岁。所有患者均经血清和影像学检查诊断为肝恶性肿瘤,符合我国2017年发布的原发性肝癌诊疗规范[5]的标准。纳入患者自愿接受RFA治疗,单发肿瘤最大直径<5 cm或多发肿瘤数目不多于3个,且肿瘤最大直径不超过3 cm,无门静脉癌栓形成。排除标准:肿瘤巨大或弥漫性肝癌、存在严重的凝血功能障碍或严重的感染。将患者分成A组和B组,在行RFA治疗时,分别采用超声联合CT或仅超声引导。本研究在医学医学伦理委员会审批后开始实施,所有患者及其家属签署知情同意书。
1.2 RFA治疗方法 使用德国西门子公司生产的16排螺旋CT,扫描层厚为5 mm,管电流为13 mA,管电压为130 kv。使用PhilipsHD3超声诊断仪,配置超声引导装置(multi-pro2000TM needle guidance system)。使用美国RI-TA1500X射频消融仪和美国RITA Starburst XL多极电极针。在术前,进行肝肾功能、血常规和凝血功能检查。在全身麻醉后,患者取仰卧位,在超声引导组(B组):行常规超声检查,在RFA术前确定肿瘤的大小、回声、周围重要解剖结构。在超声引导下确定进针入路,选定穿刺点,以穿刺点为中心常规消毒、铺单,在超声引导下将消融针刺入肿瘤组织,调整方向,确认准确无误后,打开子针,再次确认有效消融体积能完全覆盖至肿瘤边缘1 cm,进行热消融。依据病灶大小和位置,确定每个肿瘤病灶的射频治疗次数,确保每针治疗范围叠加且总体覆盖范围满意;在超声联合CT引导组(A组):在超声实时引导下,确定肿瘤大小、回声和周围重要解剖结构,将消融针刺入肿瘤组织内部,打开子针。然后,行增强CT扫描,在注射对比剂前获得平扫图像,在注射对比剂后35 s、70 s和183 s分别获得动脉期、静脉期和延迟期图像,增强对比剂为碘帕醇,使用高压注射器经患者桡静脉以2.5 ml/s的速度注入,注射时间约为28 s。观察射频针与肿瘤的空间位置,调整射频针,确认有效的消融体积能完全覆盖至肿瘤边缘1 cm且不会损伤周围脏器。开始射频消融治疗,保证消融针发热点位于病灶的中央。在消融病灶后,再行增强CT检查,了解消融区周边是否已无异常强化灶。当消融边缘有异常强化灶,则认为有病变肿瘤残留[6],再进行补充消融治疗。每次进针干预,均在超声引导下调整,保证进针的位置、角度和干预范围合适。在消融干预结束后,拔出消融针。在手术过程中,给予心电监护,密切观察患者的生命体征变化。
1.3 疗效评价 在RFA治疗后,随访3个月,行增强MRI检查,评估肿瘤消融情况和是否有肿瘤残留。评价标准为[7]:完全缓解(CR):经检查未见肿瘤或可见条索状阴影;部分缓解(PR):肿瘤缩小,其长宽乘积较治疗前缩小≥50%,并至少维持1个月,且无任何病灶进展或新病灶出现;稳定(NC):肿瘤乘积较治疗前减少<50% 或增大<25%;恶化(PD):肿瘤较治疗前增大≥25%。总有效率=完全缓解率+部分缓解率。

2 结果
2.1 两组一般资料比较 在A组,共有64个病灶,单发42例,多发8例,平均直径为(2.71±0.98)cm,其中肝细胞癌36例,胆管细胞癌5例,血管肉瘤4例,肝转移癌5例;在B组共有58个病灶,单发39例,多发7例,平均直径为(2.66±1.03)cm,其中肝细胞癌38例,胆管细胞癌2例,血管肉瘤2例,肝转移癌4例。两组一般资料比较差异无统计学意义(P>0.05)。
2.2 两组RFA治疗后疗效比较 在RFA治疗后3个月,A组有效率显著高于B组(P<0.05,表1、图1)。
2.3 两组术后并发症发生情况比较 两组在RFA治疗后并发症发生率比较无显著性差异(P>0.05,表2)。
2.4 两组血清肌酐和AFP水平变化比较 经RFA治疗后,两组血清AFP水平降低,血清肌酐水平无显著性变化(表3)。
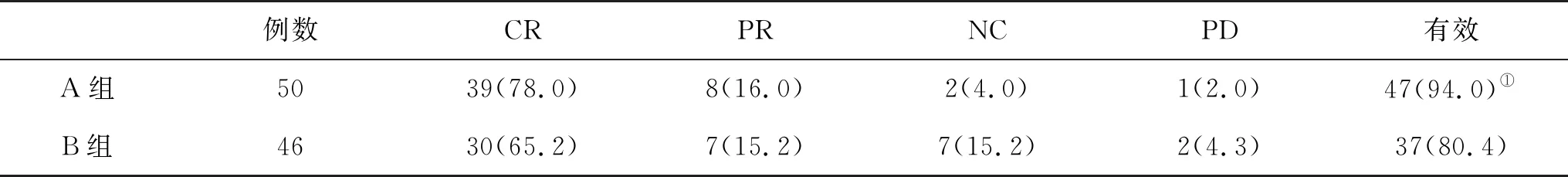
表1 两组疗效(%)比较
与B组比,①P<0.05
图1 肝恶性肿瘤患者超声和CT检查表现A:在超声引导下确认消融针进入肿瘤组织内(箭头);B:CT扫描确认消融针进入肿瘤组织;C:在消融病灶后,行术中增强CT检查,发现病变消融完全;D:在消融术后3个月,复查MRI,见肝右前叶病灶边缘结节状强化(箭头),考虑肿瘤残留
表2 两组术后并发症发生率(%)比较

例数发热恶心肝功能损伤针道出血气胸小计A组501(2.0)1(2.0)0(0.0)0(0.0)0(0.0)2(4.0)B组462(4.4)1(2.2)0(0.0)2(4.4)1(2.2)6(13.0)
表3 两组血清肌酐和AFP水平比较
3 讨论
RFA作为一种热消融治疗方法,具有微创、安全、有效、经济、痛苦较轻、可重复性操作等优点,目前已成为治疗肝恶性肿瘤的一项重要的治疗方法[8]。国外有学者在研究报告中指出,采用RFA局部消融治疗单发的直径小于5 cm的肝细胞癌患者效果好,可以达到近似手术切除的治疗效果[9]。在行RFA治疗时,其影像学引导方法主要有超声和CT两种,两者各有自身的优劣势。目前,国内外关于超声联合增强CT扫描在肝恶性肿瘤的RFA治疗过程中的应用研究已取得一些成果,本研究探讨了两者联合引导RFA治疗的应用价值,发现其具有一定的创新性,并且与单纯使用超声引导相比具备明显的优势。
本研究结果显示,经RFA治疗3个月后,超声联合CT引导组总有效率为94.0%,显著高于超声引导组的80.4%,表明超声联合CT引导RFA治疗肝恶性肿瘤有更好的治疗疗效。目前,一些临床医师习惯在超声引导下进行肝恶性肿瘤的RFA治疗,而很多介入放射学医师则习惯采用CT引导下RFA穿刺治疗。采用超声和CT联合引导RFA治疗的安全性和有效性已有一些文献报道,充分利用它们自身的优势,避免不足。超声引导下的RFA治疗可以实时监测射频消融干预针的走行、位置、治疗范围,安全快捷,但由于治疗后局部肝组织气化呈强回声,导致肿瘤的边界模糊,且易受气体和骨骼的影响,造成特殊部位的肿瘤显示不清,可能使病灶难以完全消融,影响治疗效果[10]。超声联合CT引导RFA治疗的优势在于增强CT引导RFA,相比较平扫CT来说可以更加全面、准确地掌握目标病灶的具体位置、大小、形态、数目、血供、与邻近血管和胆管等结构的关系等,可由此制定RFA治疗的最佳穿刺方案和消融参数[11]。CT引导也存在穿刺时需反复多次扫描确认射频针是否准确进入肿瘤而导致治疗耗时较长,且不能实时观察穿刺过程和肿瘤消融情况,可能造成血管或胆管的损伤[12]。将超声与CT联合应用于RFA治疗的引导,既可以达到超声引导的实时、损伤小,穿刺准确,术后恢复快等优势,还可以做到直观、无盲区和不受肠气干扰地引导RFA治疗,能在超声定位的基础上精确地测出病灶距重要脏器和血管的距离,由此精确指导布针,设置消融参数[13]。另外,在消融停止后,可即刻行增强CT检查是否有残留肿瘤,并立即予以补充消融治疗,降低了术中病灶消融残留率,因而具备更好的消融治疗疗效。
AFP是肝癌重要的血清标志物,其水平的升高提示肿瘤局部增生处于活跃的状态[14-18]。血清肌酐水平是临床上常用于检查肾功能的指标,由于接受增强CT检查的患者在检查过程中注射造影剂可能会对肾功能产生一定的负面影响,可通过检测血清肌酐做出判断[19-22]。本研究结果显示,在RFA治疗后,两组并发症发生率比较无显著差异,且经RFA治疗后两组患者血清AFP水平均大幅降低,提示RFA治疗的有效性和较好的安全性。超声联合CT引导组患者在一次RFA治疗过程中往往行增强CT扫描2~3次,所应用的造影剂总量约为150~200 ml。本研究未发现本组患者在应用造影剂后出现相关严重的不良反应,提示治疗是安全、有效的。
综上所述,相比常规超声引导,采取超声联合CT引导下RFA治疗肝恶性肿瘤患者可获得更好的疗效,并且术后并发症发生率低,安全性好,具有很大的临床应用价值。
