实时超声造影和融合影像导航下微波消融与手术治疗小肝癌患者疗效比较*
2020-07-10全亚宁商晓杰高榆秀
全亚宁,商晓杰,孟 璇,高榆秀
肝癌作为临床常见恶性肿瘤之一,发病隐匿,生长速度迅速,恶性程度高,易出现浸润转移,晚期易伴严重的并发症,死亡率较高[1]。手术切除是治疗肝癌最有效的手段之一,但基于肿瘤进展程度、患者全身状况和肝功能状况等因素的影响,临床仅10%~20%转移性肝癌和30%原发性肝癌(PLC)患者可满足手术切除的条件[2]。近年来,微波消融作为一项新型微创治疗手段,具有易操作、创伤轻微、并发症少、可重复操作等优势,已被广泛用于肝癌的治疗[3]。但有报道显示,部分小肝癌生长位置较为特殊,处于肝门区、肝包膜下或邻近大血管、膈肌、胆囊等位置,常规超声定位难度较大,治疗困难。另外,某些病灶与周围肝实质回声差异相对较小,周围实质回声杂乱,导致病灶界限不清,常规超声检查病灶显示较为困难,难以确保完全消融[4]。有研究认为,实时超声造影可有效、实时、清晰地显示肿瘤血管和血流灌注情况,即时判断微波消融的效果。基于超声造影结合融合影像导航条件下实施微波消融,可实现特殊部位肝癌的准确定位,有效辅助引导消融治疗[5,6]。我们采用超声新技术引导下微波消融治疗小肝癌患者,现报道如下。
1 资料与方法
1.1 一般资料 2013年12月~2016年12月我院收治的原发性肝癌患者142例,男90例,女52例;年龄29~73岁,平均年龄为(46.7±7.7)岁。诊断参考《原发性肝癌诊疗规范(2011年版)》[7],最大结节直径≤3 cm,结节数目≤3个;特殊部位肿瘤指位于膈顶、肋骨后或毗邻心脏、腔静脉等处的肿瘤,肿瘤离肝内较大血管或胆管10 mm及以下,距肝包膜5 mm及以下,距离肺、心脏、胆囊、胃肠道或右肾10 mm及以下;肝功能Child-Pugh A/B级;无血管和周围脏器侵犯或肝外转移;凝血酶原活动度大于70%;入组前6个月内未接受过外科相关手术治疗。排除标准:(1)肝功能Child-Pugh C级;(2)合并门静脉癌栓、肝外转移;(3)严重的凝血功能障碍;(4)肺、肝等重要脏器功能障碍;(5)转移性肝癌或其他恶性肿瘤;(6)合并顽固性腹水、有食管胃底静脉曲张破裂出血或肝性脑病史;(7)妊娠或哺乳期妇女,或对超声造影剂过敏者。采用随机抽签法将患者分为两组,每组71例,两组一般资料比较差异无统计学意义(P>0.05,表1)。患者签署知情同意书,本研究获得我院医学伦理委员会批准。
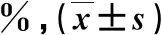
表1 两组一般资料【】比较
1.2 治疗方法 在观察组,实施实时超声造影和融合影像导航下微波消融治疗。使用Esaote Mylab90型彩色多普勒超声诊断仪(探头频率为2.0~5.0 MHz,内置于超声仪内有Virtual Navigator一体化工作站的实时虚拟导航系统)、GE公司SIGNA 1.5 TL×MRI、飞利浦64排螺旋CT和南京亿高公司生产的ECO-100A1型微波治疗仪(功率为0~100 w,频率为2450 MHz)。先行常规CT/MRI检查,获取薄层DICOM格式影像数据资料,采用医学影像存档和传输系统借助光盘或U盘将数据资料导入虚拟导航系统。选择血管与病灶同时显示相对清晰的 CT/MRI时相,标记CT/MRI上病灶边缘,行三维渲染显示。根据血管走行或轮廓将CT/MRI图像与实时超声图像进行注册、微调,完成二者联动,并不断行不同切面上对应解剖结构的影像融合验证。对出现错位者,予以微调校正。利用影像融合导航,对CT/MRI上病灶信息判断病灶在实时超声图像中所处的位置。经虚拟导航完成病灶定位后,选择病灶显示最为清晰的切面并固定,通过肘部静脉快速团注对比剂2.4 mL,再以生理盐水5.0 mL冲管,实时观察超声图像上相应病灶的血流灌注变化,进一步明确病灶部位、大小和与周边重要脏器的解剖位置关系。常规消毒、铺巾,用1%利多卡因皮下注射局部麻醉,术中给予舒芬太尼静脉注射镇痛。在实时超声造影和融合影像导航下同时显示病灶,将微波消融针刺入病灶,确保微波针针头处于病灶的中心处。将微波仪功率调节至40~80 w,维持5~10 min,行微波消融治疗。在实施消融过程中,在超声引导下实时监测病灶的消融情况,并监测消融区内回声变化,对气化区域行消融范围预估。在消融结束时,确保消融范围达到病灶周边的0.5 cm。术后10 min,即行实时超声造影评估,探查原病灶动脉期是否存在强化,整体评估消融效果。对超声造影提示局部存在肿瘤残留者,再次行微波消融治疗,补充消融5~10 min。术后,予以对症治疗;在对照组,实施手术切除治疗,包括局部肝切除术或解剖性肝切除。全身麻醉,开腹或于腹腔镜下切除病灶,确保手术切缘大于肿瘤边缘的2.0 cm以上。对于处于表浅部位的肿瘤,且与重要胆管或血管无密切联系者,选择肝癌局部切除术。对于肿瘤位置较深,与主要胆管或血管联系密切,则实行解剖性肝切除术,包括单肝段切除或联合肝段切除。在治疗3个月后,所有患者在门诊行超声造影或增强CT等检查。在随访过程中,对消融过的病灶再次明显增大,或出现与消融或手术切缘分界不清的新发病灶,判断为局部进展,对肝内其他区域有新发病灶出现者,则判断为再发[7]。
1.3 检测方法 使用美国雅培公司生产的ARCHITECT I2000SR型全自动化学发光免疫分析仪和酶速率法测定血清α-L-岩藻糖苷酶(α-L-fucosidase,AFU)水平(北京科美生物技术有限公司);采用ELISA法测定血清甲胎蛋白(alpha fetal protein,AFP)水平(北京热景生物技术有限公司);采用免疫放射法测定血清糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平(天津九鼎医学生物工程有限公司)。

2 结果
2.1 两组基本治疗情况 术后3个月复查,观察组71例患者96个病灶中90个病灶(93.8%)完全消融,6个病灶残留,对照组71例患者99个病灶全部被切除,未发现局部残留(图1、图2)。在随访1年时,观察组23例(32.4%)出现局部肿瘤进展,对照组20例(28.2%)出现肝内肿瘤再发,两组差异无统计学意义(x2=0.300,P=0.584)。
2.2 两组血清肿瘤标记物水平比较 在治疗后3月末,两组血清AFP、AFU和CA19-9水平无统计学差异(P>0.05,表2)。
2.3 两组并发症发生情况比较 在术后3月末,观察组并发症发生率显著低于对照组(P<0.05,表3)。
2.4 两组远期生存率比较 随访3~36个月,中位随访18个月。观察组累积生存率为73.2%(52/71),对照组为71.8%(51/71),两组差异无统计学意义(Log-rank值=0.086,P=0.763,图3)。
图1 原发性肝癌患者腹部实时超声造影表现 ①64岁男性,病灶位于肝左叶;②同一患者,微波消融治疗前动脉期肿瘤迅速增强,治疗后动脉期强化明显减弱
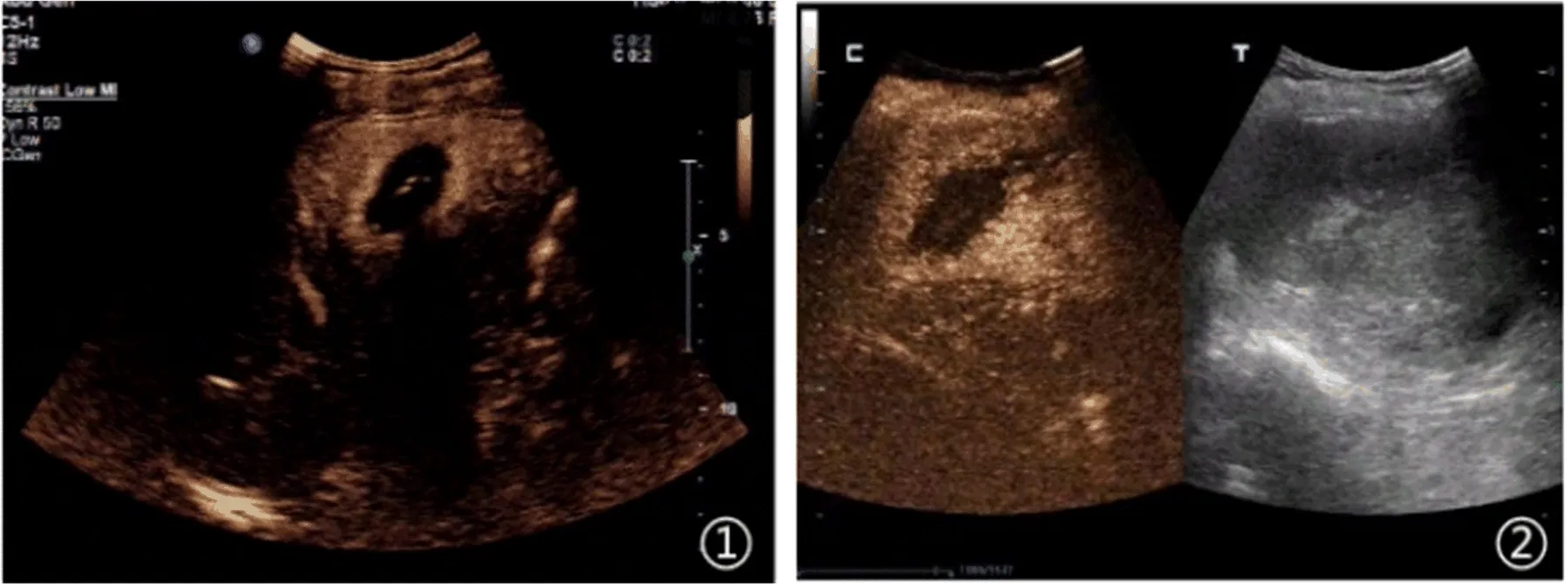
图2 原发性肝癌患者腹部实时超声造影表现①60岁女性,病灶位于肝左叶;②同一患者,微波消融治疗前动脉期有回声,治疗后动脉期显示无回声,边缘清晰
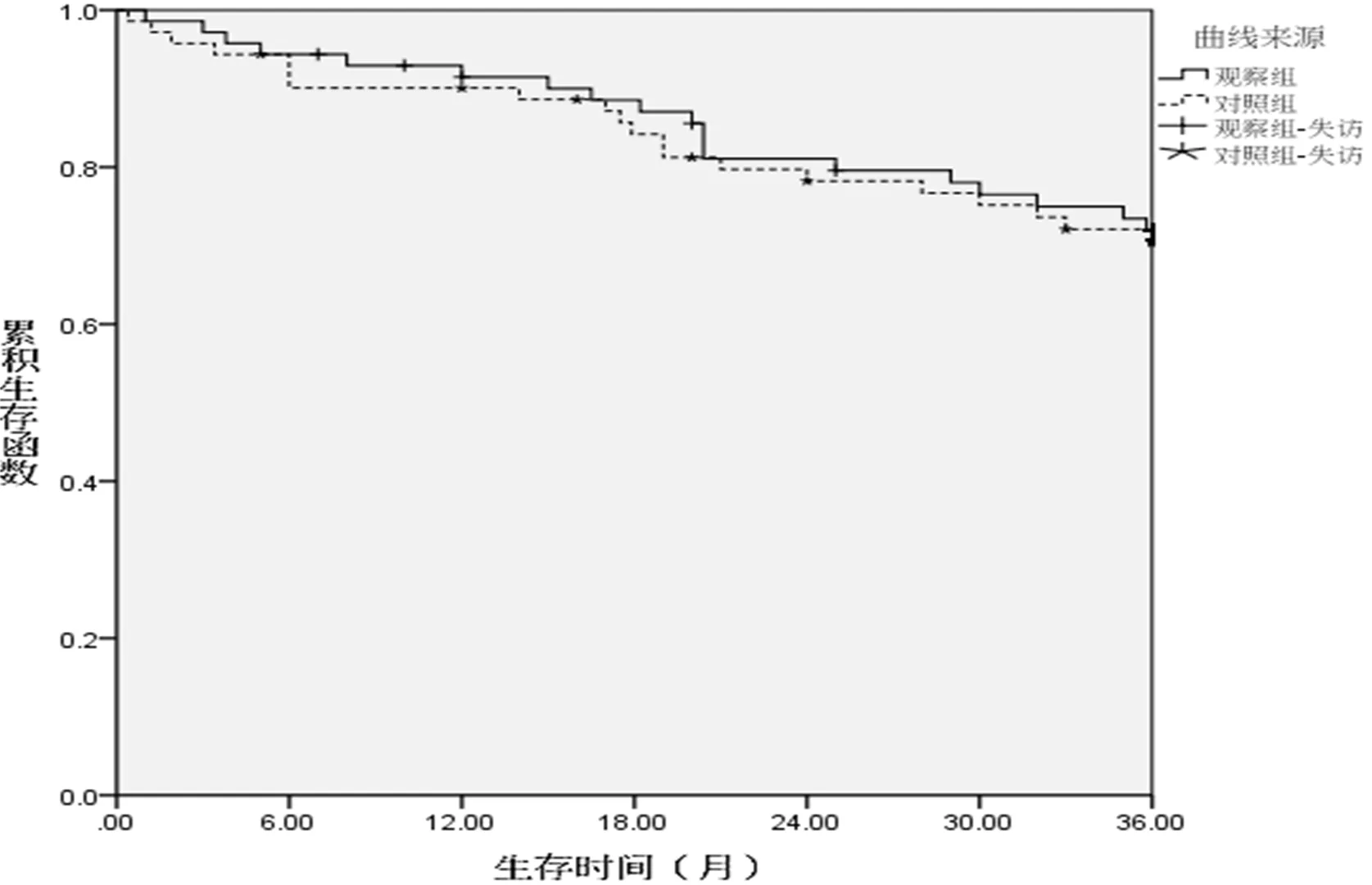
图3 两组累积生存率比较
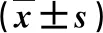
表2 两组血清肿瘤标记物水平比较

表3 两组并发症发生率(%)比较
与对照组比,①P<0.05
3 讨论
目前,微创疗法和手术切除等均为早期小肝癌的有效治疗方法,其中微创疗法疗效显著,创伤轻微,并发症发生风险低,患者恢复快,临床应用较为广泛[8-11]。微波消融技术属微创疗法中常用的手段,近年来多被用来治疗肝癌。报道显示,传统微波消融治疗往往基于超声引导下才能开展。若病灶与周围肝组织回声仅存在较小的差异,或周围组织有杂乱回声,常规超声检查对病灶的显示程度较差,无法实现准确的定位[12-15]。超声造影已被广泛用于消融治疗的引导,可增加肿瘤与周围肝组织间的对比度,于动脉期或延迟期迅速、准确定位病灶,准确反映病灶的实际大小,引导消融针的穿刺,必要时还可指导予以补充消融[16-18]。采用实时超声造影定位肿瘤的准确性高达92.3%,接近增强MRI或CT[19]。随着计算机处理技术的应用,采用实时超声造影结合融合影像导航技术下微波消融治疗肝癌逐渐应用于临床,可显著提高疗效[20]。
本研究观察组完全消融率为93.8%,对照组完全切除率达100.0%,与既往报道[15]一致,证实两种方案近期疗效确切。
