应用超声单模态融合成像技术指导微波消融治疗原发性肝癌即时疗效评价的价值研究*
2020-07-10孟海生胡冬梅王海涛顾金凤梁啸寒
孟海生,胡冬梅,王海涛,顾金凤,赵 静,梁啸寒
微波消融术是利用微波辐射产生的热能直接损害肿瘤局部组织,使原发性肝癌(PLC)细胞发生凝固性坏死,发挥治疗作用,其疗效得到临床的认可,已被共识推荐作为非手术治疗PLC患者的一线方案[1]。近年来,超声融合成像技术可将两种影像学图像置于同一平面进行分析,能更全面准确地了解病灶的消融情况,较超声造影更能清楚地反映肿瘤边界和消融效果[2,3]。目前,临床常用CT/MRI多模态融合成像对消融术进行疗效评估,但研究显示多模态融合成像操作较为复杂[4],可能造成部分患者对检查不能耐受,影响检查的准确性。超声单模态融合成像技术被认为简化了操作,也可获得清晰的图像,以便指导临床应用[5]。本研究对比超声单模态融合成像与CT/MRI多模态融合成像评价接受微波消融术治疗的PLC患者的疗效,现报道如下。
1 资料与方法
1.1 临床资料 2018年3月~2019年12月本院收治的PLC患者88例,男性64例,女性24例;年龄40~75岁,平均年龄为(58.76±16.94)岁。诊断参照中国抗癌协会原发性肝癌专业委员会发布的指南[6],均经术前肝脏穿刺组织活检病理学检查证实为肝细胞癌(HCC),肿瘤直径≤3 cm。体质指数为18.4~22.5 kg/m2,平均为(20.29±1.63)kg/m2;肿瘤临床分期:Ⅰ期34例,Ⅱ期30例,Ⅲ期24例;高分化40例,中分化18例,低分化30例。排除Child-Pugh C级、合并急性感染、凝血功能障碍和合并其他恶性肿瘤者。根据检查方法的不同,将88例患者分为观察组和对照组,每组44例,两组患者基本资料无显著性差异(P>0.05)。在观察组,行超声单模态融合成像指导下,在对照组采用CT/MRI多模态融合成像指导下的消融治疗。
1.2 微波消融方法 所有患者采取平卧位或侧卧位,采用微波消融设备【英菲尼奥科技有限公司】行多点穿刺消融治疗。在进针时,注意避免损伤肝内大血管。在消融时,使消融范围超过病灶区外0.5~1 cm,设置功率为80~120 w,消融时间为10~15 min。根据消融效果,给予1~4次治疗。
1.3 单模态融合成像检查 使用百胜MyLab Twice彩色超声诊断仪【国食药监械(进)字2014第3233183号】,以95°角扫查肿瘤病灶及其周围正常肝组织。然后,勾画出肿瘤与正常组织的边界。将超声容积图像与实时超声图像进行自动配准,在消融干预后再次调整,启动单模态融合成像模式,以使消融后的无灌注范围包括病灶区域和0.5 cm的安全范围。
1.4 多模态融合成像 使用荷兰飞利浦Brilliance16型16排螺旋CT机,行常规CT扫描,患者取仰卧位,自膈顶开始行轴位和斜位扫描,至髂脊上缘止。设置参数:电流130 mAs、层厚和间距为10 mm,记录动脉期和门脉期图像,或以钆塞酸二钠为造影剂,使用SuperNova 3.0 T磁共振诊断仪行MRI增强扫描,依次行轴位肝脏容积加速采集动态增强扫描和肝胆期扫描,记录动脉期和肝胆特异性期图像。应用三维可视化图像系统以CT和MRI图像为基础数据,构建CT/MRI融合图像,指导消融治疗。
1.5 结果判读和随访 记录并比较两组融合成像检查成功率和配准时间,将融合成像结果判读为[7]:A级:肿瘤病灶完全被消融,达安全边界;B级:肿瘤病灶完全被消融,但未达安全边界;C级:肿瘤病灶消融不完全。比较两组患者肿瘤无进展生存时间(PFS)和总生存时间(OS)。

2 结果
2.1 两组应用成功率与配准时间比较 观察组配准评估时间较对照组显著缩短,差异有统计学意义(P<0.05,表1、图1、图2),两组配准成功率无显著性差异(P>0.05,表1)。
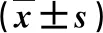
表1 两组配准成功率(%)和配准时间比较
2.2 两组评估结果比较 在44例观察组,发现52个病灶,单模态融合成功28例,共36个病灶(69.2%),在44例对照组,发现54个病灶,多模态融合成功25例,共32个病灶(59.3%),两组病灶融合成功率比较,无显著性差异(P>0.05,表2)。

图1 PLC患者肝脏超声单模态融合成像检查表现 A:术前,动脉期病灶增强;B:术后,消融覆盖病灶达安全边界
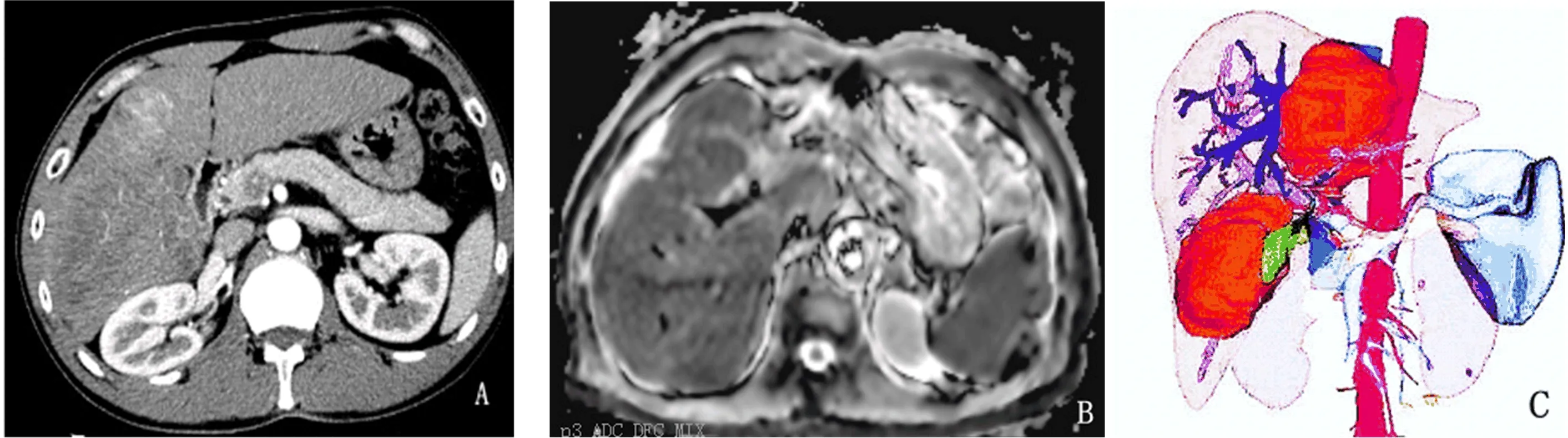
图2 PLC患者肝脏CT/MRI多模态融合成像检查表现A:CT显示病灶边界清楚;B:MRI显示肝右叶肿瘤模糊;C:CT/MRI多模态融合病灶与邻近组织血管空间解剖关系
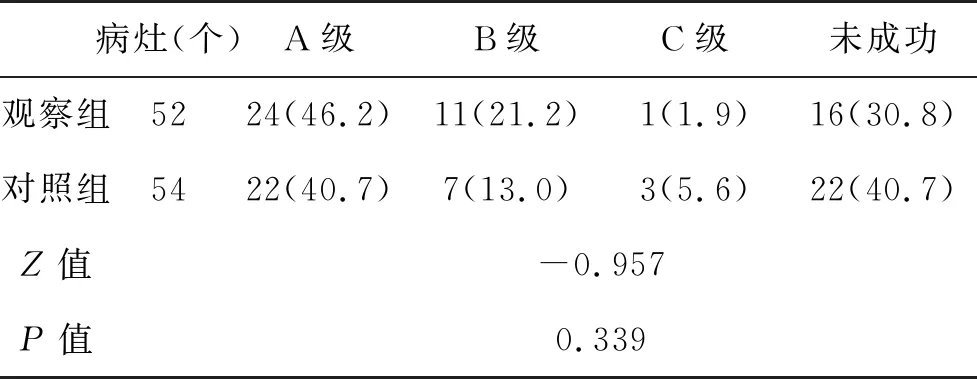
表2 两组病灶融合成像率(%)比较
2.3 两组并发症和预后比较 观察组完全消融43例(97.7%),对照组完全消融41例(93.2%,校x2=0.262,P=0.609);在消融治疗后,两组发热、局部疼痛、胆道出血和胆漏等并发症发生率无显著性差异(P>0.05,表3);随访3~20个月,观察组生存32例(72.7%),中位OS为15.1(5.0,20.0)个月,中位PFS为12.8(4.9,20.0)个月。对照组生存32例(72.7%),中位OS为14.2(4.8,20.0)个月,中位PFS为13.3(4.7,20.2)个月,两组OS和PFS比较均无显著性差异(Logrankx2=0.592,P=0.442;x2=1.103,P=0.294,图3、图4)。
表3 两组并发症发生率(%)比较

图3 两组无进展生存时间比较

图4 两组总生存时间比较
3 讨论
有学者提出微波消融治疗后肿瘤复发率较高,且对于邻近胆囊、胆管和膈肌的病灶,穿刺时还可能损伤邻近脏器[8-10],成为术后并发症发生的原因。因而,早期评估治疗效果对消融术后续治疗具有重要的意义。超声是临床常用的影像学检查工具,但作为消融术疗效评估工具依赖于操作者的经验,具有一定的主观性,同时超声对部分原发性肝癌的安全边界显像不清,给临床准确判断带来困难[11,12]。因而,近年来研究将两种或多种影像图像融合,以更全面了解病灶信息和治疗效果,进而为临床提供指导,提高疗效。CT/MRI具有良好的空间分辨力,被认为其融合成像可从不同切面寻找病灶,为临床诊治提供充分准确的图像[13]。CT/MRI可提供个体化的肝脏分段,模拟穿刺路径和消融范围,为手术提供最优方案[14]。
有学者发现CT/MRI多模态融合成像可能受肝脏形态和解剖位置的影响,在部分患者可能因解剖结构辨认不清,图像间形态差异较大造成配准失败[15,16]。我院自2018年采用单模态融合成像,将术前超声图像和实时超声影像融合,借此判断微波消融治疗是否达到安全边界,效果很好。本研究还显示观察组配准评估时间较对照组显著缩短,可能是因单模态融合成像利用超声实时图像进行治疗后即时评估,避免了肝脏解剖结构和位置改变对检查结果的误差,同时超声图像配准相对简单[17,18],大大缩短了配准时间。超声单模态融合成像配准时间较多模态融合成像更短,误差更小[19]。本研究在消融术后随访,结果显示两组PFS和OS均无显著性差异,而在随访期间单模态融合成像未达到消融安全边界患者均发生肿瘤进展,提示消融不全的患者预后差,因为行单模态消融成像操作简单,廉价,为后期临床治疗提供了参考。
本研究显示单模态融合成像仍存在一定的配准失败率,可能是因超声图像分辨力相对较低的原因[20,21],因而对于超声图像不清的原发性肝癌患者,采用单模态融合成像可能并不适用。本文为回顾性分析,纳入患者均接受了消融治疗,肿瘤最大径均小于3 cm。对于肿瘤直径超过3 cm的原发性肝癌患者,采用单模态融合成像技术指导消融治疗还有待进一步前瞻性大样本的临床观察。
