硝酸甘油片参比制剂与仿制制剂的体外质量一致性评价
2020-07-09孙婷姜建国张菁张西如徐艳梅王柳蒋凝
孙婷 姜建国 张菁 张西如 徐艳梅 王柳 蒋凝


中圖分类号 R927.1 文献标志码 A 文章编号 1001-0408(2020)05-0586-05
DOI 10.6039/j.issn.1001-0408.2020.05.16
摘 要 目的:考察国内硝酸甘油片仿制制剂与参比制剂(原研药)的体外质量一致性。方法:参照硝酸甘油片进口药品注册标准JX20010267测定硝酸甘油片1批参比制剂(A厂家)和4批仿制制剂(B、C、D、E厂家)中硝酸甘油和有关物质的含量。采用溶出度测定方法中的桨法,转速为50 r/min,以高效液相色谱法测定上述5批制剂在4种不同溶出介质(pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水)中10 min内的溶出量,计算累积溶出度,绘制溶出曲线,并以2、5、8 min时的累积溶出度计算相似因子(f2),评价溶出曲线的相似性。结果:A、B、C、D、E厂家制剂中硝酸甘油含量分别为99.8%、98.3%、94.0%、93.3%、96.7%(n=2),有关物质含量分别为0.46%、0.55%、0.63%、0.72%、0.49%(n=2)。以A厂家参比制剂为对照,在pH 1.2盐酸溶液中B、C、D、E厂家仿制制剂的f2分别为74、28、25、67,在pH 4.0醋酸盐缓冲液中的f2分别为76、26、28、84,在pH 6.8磷酸盐缓冲液中的f2分别为79、39、35、71,在水中的f2分别为69、32、37、62。结论:本方法适用于硝酸甘油片仿制制剂的体外质量一致性评价。与参比制剂比较,C、D厂家的仿制制剂主药含量较低,体外溶出曲线不具有相似性。
关键词 硝酸甘油片;仿制制剂;参比制剂;溶出介质;溶出曲线;相似性;体外质量;一致性评价
Consistency Evaluation of in vitro Quality of Nitroglycerin Tablet Reference Preparation and Imitative Preparation
SUN Ting,JIANG Jianguo,ZHANG Jing,ZHANG Xiru,XU Yanmei,WANG Liu,JIANG Ning(Hebei Institute for Drug Control, Shijiazhuang 050011, China)
ABSTRACT OBJECTIVE: To investigate the in vitro quality consistency of domestic Nitroglycerin tablet imitative preparation and reference preparation (original drug). METHODS: The contents of nitroglycerin and related substances in 1 batch of Nitroglycerin tablet reference preparation (manufacturer A) and 4 batches of imitative preparation (manufacturer B, C, D, E) were determined according to Nitroglycerin Tablet Import Drugs Registration Standard JX20010267. The paddle method of dissolution determination method was adopted, with the rotating speed of 50 r/min. HPLC method was adopted to determine the dissolution amount of 5 batches of above preparations in 4 kinds of dissolution mediums (pH 1.2 hydrochloric acid solution, pH 4.0 acetate buffer solution, pH 6.8 phosphate buffer solution, water) within 10 min.The accumulative dissolution rate was calculated, and dissolution curves of samples were drawn.The similarity of the dissolution curves was evaluated by calculating similarity factor (f2) of 2, 5, 8 min accumulative dissolution rate. RESULTS: The contents of nitroglycerin in the preparations from manufacturer A, B, C, D, E were 99.8%, 98.3%, 94.0%, 93.3%, 96.7%, respectively (n=2); the contents of related substance were 0.46%, 0.55%, 0.63%, 0.72%, 0.49%, respectively (n=2). Using reference preparation of manufacturer A as control, f2 of imitative preparation from manufacturer B, C, D, E were 74, 28, 25, 67 in pH 1.2 hydrochloric acid solution; 76, 26, 28, 84 in pH 4.0 acetate buffer solution; 79, 39, 35, 71 in pH 6.8 phosphate buffer solution; 69, 32, 37, 62 in water, respectively. CONCLUSIONS: The method is suitable for in vitro quality consistency evaluation of Nitroglycerin table timitative preparation. Compared with reference preparation, the contents of main components in the imitative preparations from manufacturer C, D are lower; in vitro dissolution curves of those imitative preparation are not similar to reference preparation.
KEYWORDS Nitroglycerin tablet; Imitative preparation; Reference preparation; Dissolution media; Dissolution curve; Similarity; in vitro quality; Consistency evaluation
硝酸甘油是一种用来治疗心绞痛、心力衰竭和心肌梗死的硝基类血管扩张药[1]。治疗急性心绞痛时,硝酸甘油以舌下含服、舌下喷雾或口腔含服的形式给药,这些给药方式均能快速地发挥疗效,并且能快速地缓解疼痛[1]。硝酸甘油片已列入《国家基本药物目录》2012年版,属于生物药剂学分类系统(BCS)中的Ⅰ类药物,目前,2015年版《中国药典》(二部)[2]、《美国药典》41版[3]等国内外药典均收载了该品种。为了考察国产硝酸甘油片仿制制剂与原研制剂在质量上是否一致,本研究以国家药品监督管理局(NMPA)公布的第一批参比制剂目录里美国辉瑞制药有限公司生产的舌下含服硝酸甘油片为参比制剂,比较其与国产硝酸甘油片仿制制剂中硝酸甘油的含量及有关物质,同时通过考察溶出曲线相似性对两者的体外溶出行为进行一致性评价,从而为硝酸甘油片的仿制药质量与疗效一致性评价工作提供技术支持,为该品种质量标准的提高提供参考。
1 材料
1.1 仪器
Aglient 1260型高效液相色谱仪(美国Aglient公司);UDT-812型智能溶出度试验仪(美国Logan公司); EDT-14Lx型智能试验溶出仪(上海仪真分析仪器有限公司); PB-10型酸度计、XS205 型电子分析天平[梅特勒-托利多国际贸易(上海)有限公司]; FAVD-25型真空脱气仪(上海富科思分析仪器有限公司)。
1.2 药品与试剂
硝酸甘油溶液标准物质[中国食品药品检定研究院,批号:100236-201702,标示量:0.963%(m/m)];硝酸甘油片(参比制剂厂家A,批号:N30287,规格:0.6 mg; 仿制制剂厂家B、C、D、E,批号分别为:B0701、C0702、D0703、E0704,规格:均为0.6 mg);盐酸、冰醋酸、醋酸钠、磷酸二氢钾、氢氧化钠(国药集团化学试剂有限公司,批号分别为:20180102、20160118、20170521、20170822、20170323,分析纯);甲醇为色谱纯;水为纯化水。
2 方法与结果
2.1 含量测定与有关物质检查
按照硝酸甘油片进口药品注册标准JX20010267[4]对收集到的1批参比制剂和4个厂家的各1批仿制制剂进行含量测定和有关物质检查,结果见表1。
表1 参比制剂和仿制制剂中硝酸甘油及有关物质含量测定结果(n=2,%)
2.2 溶出度试验条件的确定
2.2.1 溶出方法和转速的选择 经查阅美国FDA溶出曲线库中的方法(https://www.accessdata.fda.gov/scripts/cder/daf/#apphist)和硝酸甘油片进口药品注册标准JX20010267[4],其中溶出方法均选择桨法,转速均为50 r/min。另有文献研究表明,对于片剂,建议采用桨法、转速为50 r/min进行溶出试验,因为通常认为 50 r/min 与中老年人体内胃肠道蠕动强度基本一致[5]。因此,本研究所采用的溶出方法为桨法,转速为50 r/min。
2.2.2 溶出介质和溶出体积的选择 硝酸甘油属于酯类药物[6],通过测定其酸度系数(pKa),结果为9.13(当pKa>3.0时可看作为碱性药物)[5]。依据硝酸甘油的基本特性,结合日本《仿制药生物等效性试验指导原则(2012版)》中的溶出度研究内容[7],筛选出4种溶出介质,分别为pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水。溶出体积依据硝酸甘油片进口药品注册标准JX20010267[4],选择常用体积中的500 mL。
2.2.3 取样时间的选择 硝酸甘油片为舌下含服的快速起效降压药,其取样时间的选择与普通口服固体制剂的取样时间的选择存在一定差异。根据美国FDA溶出曲线库中的方法和硝酸甘油片进口药品注册标准JX20010267[4]中溶出度、崩解时限检验方法,选择硝酸甘油片溶出度试验的取样时间分别为1、2、3、5、8、10 min。
2.3 溶出曲线测定的方法学考察
2.3.1 对照品溶液的制备 精密称取硝酸甘油溶液标准物质适量,置于10 mL量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,即得质量浓度为0.1 mg/mL的对照品贮备液。精密量取上述贮备液1 mL,置于100 mL量瓶中,加溶出介质溶解并稀释至刻度,摇匀,即得对照品溶液。
2.3.2 供试品溶液的制备 取样品1片,分别以pH 1.2 盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水为溶出介质,按桨法、转速为50 r/min、溶出介质体积为500 mL进行溶出度试验。分别于1、2、3、5、8、10 min时,吸取溶出液 1 mL(每次取液后均补加相同温度的溶出介质 1 mL),用 0.45 μm 微孔濾膜过滤后,作为供试品溶液。平行操作12片。
2.3.3 色谱条件 色谱柱:Waters Symmetry C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(40 ∶ 60,V/V);检测波长:220 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:100 μL。
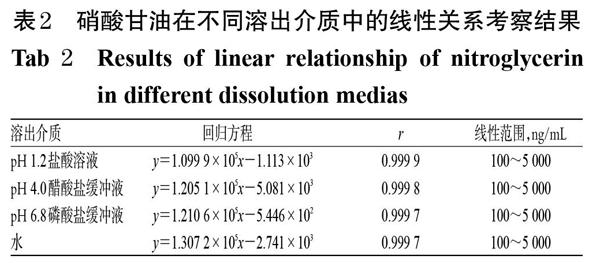
2.3.4 线性关系考察 精密量取“2.3.1”项下对照品贮备液0.1、0.2、0.5、1.0、2.0、5.0 mL,分别置于不同100 mL量瓶中,再分别以pH 1.2 盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水稀释至刻度后,按“2.3.3”项下色谱条件进样测定,记录峰面积。以硝酸甘油质量浓度(x,ng/mL)为横坐标、峰面积(y)为纵坐标进行线性回归分析,结果见表2。
表2 硝酸甘油在不同溶出介质中的线性关系考察结果
2.3.5 检测限与定量限考察 精密量取“2.3.1”项下硝酸甘油对照品溶液,以溶出介质逐级稀释后,按“2.3.3”项下色谱条件进样分析。当信噪比为3 ∶ 1时,硝酸甘油在pH 1.2 盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水中的检测限分别为54、51、58、55 ng/mL;当信噪比为10 ∶ 1时,硝酸甘油在上述4种溶出介质中的定量限分别为177、168、193、181 ng/mL。
2.3.6 精密度试验 精密称取A厂家的硝酸甘油片样品(批号:N30287)适量,按“2.3.2”项下方法制成供试品溶液,再按“2.3.3”项下色谱条件连续进样测定6次,记录峰面积。结果,硝酸甘油在pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水中峰面积的RSD分别为0.33%、0.47%、0.61%、0.58%(n=6),表明本方法精密度良好。
2.3.7 稳定性试验 精密称取A厂家的硝酸甘油片样品(批号:N30287)适量,按“2.3.2”项下方法制成供试品溶液,分别于室温下放置0、1、2、4、6、8、12 h时,按“2.3.3”项下色谱条件进样测定,记录峰面积。结果,硝酸甘油在pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水中峰面积的RSD 分别为1.0%、1.2%、0.9%、1.4%(n=7),表明供试品溶液在室温下放置12 h稳定性良好。
2.3.8 重复性试验 精密称取A厂家的硝酸甘油片样品(批号:N30287)适量,共6份,按“2.3.2”项下方法制成供试品溶液,再按“2.3.3”项下色谱条件进样测定,记录峰面积,计算溶出度。结果硝酸甘油在pH 1.2 盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水中溶出度的RSD分别为 0.6%、0.7%、0.5%、0.8%(n=6),表明本方法的重复性良好。
2.3.9 回收率试验 按硝酸甘油片平均溶出量的80%、100%、120%精密称取硝酸甘油溶液标准物质适量,共9份,每个浓度3份,按规格为0.6 mg的硝酸甘油片处方比例加入相应的混合辅料,置于 10 mL量瓶中,用无水乙醇溶解并稀释至刻度,滤过。取续滤液1 mL,置于100 mL 量瓶中,分别加 pH 1.2 盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液、水稀释至刻度,按“2.3.3”项下色谱条件进样测定,记录峰面积,代入回归方程计算含量及回收率。结果,硝酸甘油在上述4种溶出介质中的平均回收率分别为 98.6%、99.7%、98.2%、99.4%,RSD均小于2.0%(n=9),表明本方法的准确度良好。
2.4 溶出仪的选择
分别选用UDT-812 型智能溶出度试验仪和EDT- 14Lx型智能试验溶出仪,取A厂家的硝酸甘油片样品(批号:N30287)适量,分别以 pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和水500 mL作为溶出介质,按桨法(转速50 r/min)进行溶出试验。分别于1、2、3、5、8、10 min时吸取溶出液(每次取样后补充同温度的等量溶出介质),过滤后,按“2.3.3”项下色谱条件进样测定计算溶出量和累积溶出度,绘制溶出曲线。每种溶出介质中测试 12 片样品。结果,2个品牌仪器测定绘制的溶出曲线相似,测定结果基本一致,本研究以UDT-812型智能溶出度试验仪为溶出仪进行评价。不同溶出仪测得的样品在4种溶出介质中的溶出曲线见图1。
2.5 参比制剂和仿制制剂溶出曲线一致性考察
2.5.1 参比制剂和仿制制剂溶出曲线绘制 取收集到的硝酸甘油片1批参比制剂和4批国产仿制制剂样品,按“2.2”项下条件进行溶出度试验,再按“2.3.3”项下色谱条件进样测定,代入回归方程计算每片样品各取样点的累积溶出度。每批样品平行12片操作,以各时间点12片样品的累积溶出度平均值为纵坐标、溶出时间为横坐标绘制溶出曲线。结果,C、D厂家样品与A厂家参比制剂样品在pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水4种溶出介质中的溶出行为均不相似,B、E厂家样品与参比制剂的溶出曲线较为相似,溶出曲线见图2。
2.5.2 参比制剂与仿制制剂溶出曲线的一致性评价 美国FDA 和我国药品审评中心的指导原则均推荐采用相似因子(f2)法来评价试验药品与对照药品体外溶出曲线的差异,当f2值在50~100范围内时,认为 2 条溶出曲线相似[5]。在pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水4种溶出介质中,以时间点2、5、8 min[6]的累积溶出度计算f2来判断仿制制剂与参比制剂的相似性。结果,C、D厂家样品在4种溶出介质中的体外溶出曲线与参比制剂不相似,B、E厂家样品的体外溶出曲线与参比制剂相似,与“2.5.1”项下溶出曲线图结果一致。仿制制剂与参比制剂的f2计算结果见表3。
表3 仿制制劑与参比制剂的f2计算结果(n=12)
3 讨论
通过查阅2015年版《中国药典》(二部)[2]、《美国药典》41版[3]、《日本药典》第17改正版[8]和硝酸甘油片进口药品注册标准JX20010267[4],比较各质量标准中有关硝酸甘油片含量测定和有关物质项下色谱条件、系统适用性试验、检验限度等的要求,发现《日本药典》第17改正版和《美国药典》41版均未收载硝酸甘油片有关物质检查项,2015年版《中国药典》(二部)中硝酸甘油片含量测定的检验限度较宽泛。综合以上国内外质量标准,最终确定采用硝酸甘油片进口药品注册标准JX20010267对硝酸甘油片中硝酸甘油及有关物质含量进行测定。结果显示,C、D厂家样品的有关物质相对较高,主药含量相对较低。
本研究建立的硝酸甘油片溶出曲线方法,其中所采用的溶出方法、溶出介质、转速、溶出体积等条件均符合2015年版《中国药典》(四部)通则0931溶出度与释放度测定法[9]的要求,所采用的高效液相色谱法具有较高的灵敏度和较好的准确度,适用于该品种的相关质量评价。
经查阅NMPA网站可知,目前国内生产硝酸甘油片的厂家共有13家,网站公布的已批准通过仿制药质量和疗效一致性评价的品种目录中还未出现该品种,但在公布的第一批参比制剂目录中已收录了硝酸甘油片。由此可见,对硝酸甘油片仿制制剂与参比制剂进行一致性评价具有一定的研究价值。本文参照相关文献方法[10-14],对收集到硝酸甘油片1批参比制剂和4批仿制制剂进行评价。从溶出曲线和f2的结果可以看出,C、D厂家样品溶出行为與参比制剂差异较大。经笔者调研考察,分析以上结果可能是生产企业在生产中未控制好混合后湿颗粒的干燥温度,而硝酸甘油对热不稳定所致[15]。建议相关企业考察硝酸甘油片样品与参比制剂是否具有体内生物等效性。
参考文献
[ 1 ] 英国大不列颠药物学会.马丁代尔大药典[S]. 36版.伦敦:药典出版社,2009:1248-1250.
[ 2 ] 国家药典委员会.中华人民共和国药典:二部[S]. 2015年版.北京:中国医药科技出版社,2015:1291-1293.
[ 3 ] 美国药典委员会.美国药典[S]. 41版.巴尔的摩:联合图书出版社,2018:4067-4068.
[ 4 ] 国家食品药品监督管理局. JX20010267 进口药品注册标准[S]. 2001-02.
[ 5 ] 张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946-955.
[ 6 ] 仉文升,李安良.药物化学[M].北京:高等教育出版社,2002:290.
[ 7 ] 日本厚生省.仿制药生物等效性试验指导原则:2012版[S]. 2012-02-29.
[ 8 ] 日本药局方编辑委员会.日本药典[S].第17改正版.东京:日本厚生省,2017:1317-1318.
[ 9 ] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:121-124.
[10] 郭晓梅,赵青威,马葵芬,等.环孢素软胶囊原研药与仿制药体外一致性评价[J].中国现代应用药学,2016,33(6):759-762.
[11] 朱培曦,魏炜,陆静娴,等.去痛片溶出度测定方法的研究[J].中国现代应用药学,2017,34(2):272-275.
[12] 国家食品药品监督管理总局.普通口服固体制剂溶出度试验技术指导原则[S]. 2015-02-05.
[13] 孙婷,姜建国,郭永辉,等.不同厂家比沙可啶肠溶片仿制制剂与参比制剂溶出曲线的相似性评价[J].中国药房,2017,28(9):1268-1271.
[14] 孙婷,姜建国,刘云,等.双溶出-HPLC 系统在盐酸特拉唑嗪片一致性评价中的应用[J].沈阳药科大学学报,2017,34(11):987-993.
[15] 汪磊,陈玉文,郝桂明.国家评价性抽验结果论硝酸甘油片的质量[J].沈阳药科大学学报,2016,33(3):249-252.
(收稿日期:2019-07-05 修回日期:2019-10-12)
(编辑:邹丽娟)
