下调LncRNA SNHG3表达对人胃癌细胞MGC-803增殖、侵袭、凋亡的影响及机制
2020-07-09谷建斌张国欣张玉斌张景承王雪平薛菲
谷建斌,张国欣,张玉斌,张景承,王雪平,薛菲
石家庄市第一医院,石家庄050011
胃癌是全球常见的恶性肿瘤之一,预后相对较差,严重威胁人类健康。2012年全球胃癌新发病例约50%的病例发生在亚洲东部,主要集中在中国[1]。2015年中国胃癌新发病例约为67.9万例,胃癌死亡病例约为49.8万例,是严重危害中国居民健康的主要疾病[2]。长链非编码RNA(LncRNA) 指长度超过200个核苷酸的非编码RNA,近年来研究结果显示,在肿瘤组织和正常组织中有一系列差异表达的LncRNA[3,4],在多种肿瘤如胃癌、乳腺癌、结肠癌的发生发展、转移及复发过程中发挥重要作用[5~7]。核仁小分子RNA宿主基因3(SNHG3)是一种LncRNA,位于染色体1p35.3。我们在实验中发现,LncRNA SNHG3在胃腺癌组织中异常高表达[8],提示其异常表达可能与胃癌的发生和恶性进展密切相关。2017年10月~2018年12月,本研究通过 siRNA 技术下调胃癌细胞MGC-803中LncRNA SNHG3表达,探讨LncRNA SNHG3表达变化对胃癌细胞MGC-803增殖、侵袭和凋亡的影响及可能机制。
1 材料与方法
1.1 材料 正常胃黏膜上皮细胞GES1由河北医科大学第四医院科研中心提供;人胃癌细胞MGC-803购于中国医学科学院基础医学研究所基础医学细胞中心。SNHG3-siRNA由上海吉玛制药技术有限公司设计合成。LncRNA SNHG3、β-actin引物使用Primer 5软件设计,由上海生工生物工程技术服务有限公司合成。Roter gene 3000(澳大利亚Corbett公司);NanoDrop ND-2000分光光度计(美国NanoDrop公司);Transwell小室(美国Corning公司);BD Accuri C6流式细胞仪(美国BD公司);M-MLV反转录试剂盒(美国Promega公司);SYBR Green PCR Master Mix试剂盒(全式金公司);Lipofectamine2000(美国Invitrogen公司);goat anti rabbit IgG(H+L),HRP(美国Jackson);ECL(美国Millipore公司)。
1.2 细胞培养 将人胃癌细胞MGC-803及正常胃黏膜上皮细胞系GES1均接种于RPMI 1640培养基,于 37 ℃、5% CO2培养箱中培养,48 h后消化传代。
1.3 LncRNA SNHG3表达检测 采用qRT-PCR法。取对数生长期胃癌细胞MGC-803及正常胃黏膜上皮细胞GES1,采用qRT-PCR试剂盒检测LncRNA SNHG3表达。LncRNA SNHG3正向引物:5′-AGACAGATTCGCAGTGGTCG-3′,反向引物:5′-GTCTCCATGGCCCACTTCTG-3′。β-actin正向引物:5′-CACCCCAGCCATGTACGTTG-3′,反向引物:5′-AATGTCACGCACGATTTCCC-3′。采用定量2-△△CT法计算胃癌细胞LncRNA SNHG3相对表达量。
1.4 细胞分组及转染 将对数生长期的人胃癌细胞MGC-803,随机分为SNHG3-siRNA 组、阴性对照组和空白对照组,每组设 3 个复孔。各组常规培养24 h,SNHG3-siRNA 组加入LncRNA SNHG3 siRNA(正向引物:5′-GCAUUUAGCUAGGAAUGCATT-3′,反向引物:5′-UGCAUUCCUAGCUAAAUGCTT-3′)转染,阴性对照组加入无关序列 NC siRNA(正向引物:5′-ACUGCGACUGCUUCACUUGTT-3′,反向引物:5′-CAAGUGAAGCAGUCGCAGUTT-3′)转染,空白对照组不予转染。所有操作严格按 Lipofectamine2000说明书进行。转染24 h,提取细胞总RNA,按照M-MLV反转录试剂盒说明逆转录为cDNA,以 cDNA 为模板进行 PCR 扩增。根据 SYBR Green PCR Master Mix试剂盒说明配制反应体系20 μL。反应条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 10 s,72 ℃ 20 s共40个循环。
1.5 细胞增殖能力检测 采用CCK-8法。将转染24 h的三组细胞消化制成单细胞悬液,以5×103个/孔种植于96孔板(100 μL/孔),在培养24 h 时每孔加入CCK-8溶液10 μL,继续培养1 h,在450 nm波长下,用酶标仪测定各孔光密度(OD)值。
1.6 克隆形成率测算 采用平板克隆实验。将细胞接种于6孔板(300个/孔),置于培养箱中培养1~2周,观察克隆细胞形成至合适大小时用PBS洗涤2次,4%多聚甲醛固定15 min,加入适量0.1%结晶紫染色液染色10 min,倒置显微镜下观察5个视野,计数细胞的克隆数。克隆形成率(%)=克隆数目/接种细胞数×100%。
1.7 细胞迁移能力检测 采用Transwell小室实验。取各组细胞,均计数5×104个细胞加入Transwell小室上室中,用无血清培养液正常培养,小室下加入含10%血清的DMEM培养液。培养48 h,将小室取出用PBS冲洗,4%多聚甲醛固定20 min,0.1%结晶紫染色液染色20 min。显微镜下观察并拍照,随机选取5个视野计数穿膜细胞数,每组设3个复孔,取平均值。
1.8 细胞侵袭能力检测 采用Transwell小室实验。Transwell小室上室用50 μL Matrigel胶包被,在37 ℃中放置3~5 h。各组分别取200 μL(密度为2.5×105个/mL)细胞接种于Transwell小室上室,在下室加入DMEM培养基。培养48 h后擦去上室的Matrigel胶和多余细胞,4%多聚甲醛固定20 min,0.1%结晶紫染色液染色,随机选取5个视野计数穿膜细胞数,每组设3个复孔,取平均值。
1.9 细胞周期及凋亡检测 应用流式细胞术进行细胞周期分析,通过标准胰蛋白酶消化程序收获生长对数期的转染和对照细胞,用 PBS 洗涤,加入PI染液500 μL和破膜剂5 μL,室温避光孵育30 min,收集培养物并使用BD Accuri C6流式细胞仪分析细胞周期。统计G0/G1、S和G2/M期细胞的百分比。按照细胞凋亡检测试剂盒说明,将细胞每管加入Annexin V-FITC 5 μL和10 μL 20 μg/mL PI溶液,室温避光孵育15 min,使用流式细胞仪测定并获取细胞凋亡比例。
1.10 信号传导与活化转录因子3(STAT3)、基质金属蛋白酶2(MMP-2)、c-Myc和p-STAT3蛋白表达检测 应用蛋白质印迹(Western blotting)法测定。使用 RIPA 缓冲液提取总细胞裂解物,通过配置12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE,恒压80 V,2 h)分离蛋白质,并转移到 PVDF 膜,用5%脱脂奶粉封闭,并在4 ℃下与一抗孵育过夜。缓冲液洗膜(15 min×3次),将膜与二抗孵育,最后用 ECL底物试剂盒检测,实验重复3次。采用Bio-Rad Image Lab 5.2.1软件进行灰度分析。
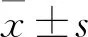
2 结果
2.1 人胃癌细胞MGC-803中各组LncRNA SNHG3表达比较 胃癌细胞MGC-803中LncRNA SNHG3相对表达量为正常胃黏膜上皮细胞GES1的(1.992±0.099)倍,MGC-803细胞中LncRNA SNHG3相对表达量高于GES1细胞(P<0.01)。在人胃癌细胞MGC-803中,空白对照组、阴性对照组、SNHG3-siRNA 组LncRNA SNHG3 相对表达量分别为1.00±0.00、0.89±0.21、0.27±0.03。SNHG3-siRNA组LncRNA SNHG3 相对表达量低于空白对照组、阴性对照组(P均<0.05)。
2.2 三组细胞增殖能力比较 CCK-8法检测结果显示,SNHG3-siRNA组、阴性对照组、空白对照组OD450分别为0.410 9±0.001 5、0.494 4±0.001 2、0.511 2±0.001 1。siRNA组的细胞增殖能力均低于阴性对照组、空白对照组(P均<0.01)。
2.3 细胞克隆形成率比较 SNHG3-siRNA组、阴性对照组、空白对照组的克隆形成率分别为5.89%±0.44%、9.48%±1.17%、10.00%±0.76%。SNHG3-siRNA组克隆形成率低于阴性对照组、空白对照组(P均<0.01)。
2.4 细胞迁移和侵袭能力比较 在不预铺基质胶Transwell小室实验中,SNHG3-siRNA组、阴性对照组、空白对照组迁移到滤膜下表面的细胞数分别为(38.6±1.5)、(148.6±10.2)、(157.0±18.0)个/视野, SNHG3-siRNA组迁移细胞数低于阴性对照组、空白对照组(P均<0.01)。Transwell小室实验中,SNHG3-siRNA组、阴性对照组、空白对照组的迁移到滤膜下表面的细胞数分别为(31.0±6.6)、(91.1±11.1)、(90.3±7.5)个/视野, SNHG3-siRNA组穿膜细胞数低于阴性对照组、空白对照组(P均<0.01)。
2.5 细胞周期和凋亡情况比较 MGC-803细胞转染24 h后SNHG3 siRNA组G0/G1期细胞百分比上升至62.89%±5.25%,与阴性对照组相比差异无统计学意义(P>0.05), S期细胞比例无显著变化;G2/M期细胞比例下降至7.15%±1.08%,与阴性对照组相比差异有统计学意义(P<0.01)。下调LncRNA SNHG3表达后,MGC-803细胞凋亡率上升至10.73%±0.77%,与空白对照组(1.54%±0.57%)、阴性对照组(2.34%±0.84%)相比差异有统计学意义(P均<0.001)。见表1。

表1 三组各周期细胞占比比较
注:与siRNA组相比,*P<0.01。
2.6 STAT3、MMP-2、c-Myc和p-STAT3蛋白表达比较 Western blotting结果显示,相较于阴性对照组和空白对照组,siRNA组的STAT3、MMP-2、c-Myc、p-STAT3蛋白表达下降(P<0.05),p-STAT3/STAT3值降低(P<0.05)。见表2。

表2 三组细胞STAT3、MMP-2、c-Myc和p-STAT3蛋白表达比较
注:与siRNA组相比,*P<0.05。
3 讨论
在人类基因组序列中,仅有1.5%的核酸序列用于蛋白质编码,而占据人类基因组98.5%的是非蛋白编码序列。非编码RNA是一大类不具有蛋白编码潜能的RNA转录本[9]。目前研究表明,LncRNA在肿瘤的发生发展中起重要调控作用[10]。SNHG3作为一种LncRNA,最初由Pelczar等[11]发现。Huang等[12]报道,在结直肠癌中,SNHG3作为内源性竞争性RNA与miR-182-5p相互竞争,导致c-Myc过表达并作用于c-Myc的目的基因,从而促进结直肠癌进展。我们在前期实验中证实了LncRNA SNHG3在胃腺癌组织中高表达[8],张子龙等[13]亦报道,LncRNA SNHG3在胃癌中高表达,并且高表达的胃癌患者生存时间低于低表达者。本研究以胃癌细胞MGC-803为研究对象,qRT-PCR结果显示,胃癌细胞MGC-803中LncRNA SNHG3的相对表达量高于正常胃黏膜上皮细胞系GES1,提示LncRNA SNHG3高表达与胃癌的发生相关。
应用siRNA技术转染MGC-803细胞下调LncRNA SNHG3表达后,CCK-8实验和平板克隆实验提示细胞增殖能力、克隆形成能力均受到显著抑制,提示LncRNA SNHG3在胃癌发展及克隆性增殖过程中发挥了一定作用。进一步研究发现,下调LncRNA SNHG3表达后,抑制胃癌细胞MGC-803进入G2/M期,并且凋亡比例显著增加。LncRNA SNHG3下调所引起的分裂增殖抑制、凋亡增加可能是胃癌细胞增殖能力下降的部分原因。Transwell迁移、侵袭实验表明,胃癌细胞MGC-803在LncRNA SNHG3下调后的迁移及侵袭能力减弱,说明在侵袭和转移过程中LncRNA SNHG3可能扮演了重要角色。
STATs家族成员具有信号转导和转录调控双重功能[14]。STAT3是STAT家族中的重要一员,其与肿瘤的关系密切,过度表达与肿瘤的增殖、细胞凋亡抑制、侵袭和转移、新血管生成等密切相关,被认为是一种原癌基因,有活性的p-STAT3进入细胞核内调控相关基因的转录[15]。Judd等[16]发现,抑制STAT3磷酸化可阻碍胃癌细胞增殖、减少炎症和诱导凋亡。MMP-2是基质金属蛋白酶MMPs家族中的重要一员,能降解细胞基底膜及细胞外基质成分Ⅳ型胶原,从而促进肿瘤侵袭和转移。c-Myc是Myc家族成员之一,是与细胞增殖和凋亡密切相关的一种癌基因[17]。下调LncRNA SNHG3表达后,STAT3、MMP-2、c-Myc的表达下降。p-STAT3/STAT3降低,提示可能通过抑制STAT3的表达和STAT3磷酸化水平,从而抑制了MGC-803细胞增殖,诱导了凋亡;抑制MMP-2表达,可能与抑制MGC-803细胞的侵袭有关。抑制c-Myc的表达,进入G2/M期的MGC-803细胞减少,并且凋亡比例显著增加。这在一定程度上解释了下调LncRNA SNHG3后细胞增殖、克隆、Transwell侵袭实验和细胞周期、凋亡实验的结果,抑制LncRNA SNHG3基因有望应用于胃癌的靶向治疗。
综上所述,LncRNA SNHG3在胃癌细胞中高表达,同时其是胃癌细胞增殖、抗凋亡、侵袭及转移的必要因素,对其进行干扰可有效破坏胃癌细胞的上述生物学行为;其机制可能通过下调STAT3、MMP-2、c-Myc、p-STAT3蛋白表达实现,LncRNA SNHG3有望成为胃癌治疗过程中的潜在分子靶点。
