乌头碱对H9c2细胞分化的影响
2020-07-06张斌强陈龙冉凤英杜开慧余飞陈炜杨丽萍薛旸陈琴华陈继舜
张斌强,陈龙,冉凤英,杜开慧,余飞,陈炜,杨丽萍,薛旸,陈琴华,陈继舜
作者单位:湖北医药学院附属东风医院,a实验中心,b心血管内科,湖北 十堰442008
附子是温里药中常用药物之一,被称为“百药之长”,又誉为“回阳救逆第一要药”。现代的科学研究同样认为附子具有很高的医学药用价值,比如在强心、镇痛、抗肿瘤、调节免疫等领域都有其独特的价值并得到了广泛的应用[1-2],最近的研究发现它还能够改善心衰大鼠体内的抗氧化能力[3],但是临床上经常因服用不当发生中毒死亡,其临床应用受到了严格的限制[4],而乌头碱是附子中具有毒性的主要生物活性碱之一。先前的研究表明乌头碱能诱导心肌细胞钠离子通道开放,加速钠离子内流,促使细胞膜去极化并且改变心肌细胞K+通道活性从而引发心律失常[5-6]。乌头碱还能通过激活和磷酸化p38/MAPK信号通路,增加细胞内钙离子浓度,最终诱导细胞凋亡[7],在体外实验中,也有研究证实了乌头碱通过降低PGC1α表达引起线粒体功能障碍,并且使得Cytoch rome c、Bax、cleaved、Caspase3表达上调以及Bcl2的表达下调最终导致H9c2心肌细胞的凋亡[8]。综上所述,乌头碱的毒性研究多集中在引起多种细胞和动物模型的电活动异常但对心肌细胞分化的影响的研究尚不多见。H9c2细胞株广泛应用于大鼠的生理和心脏毒性研究[9],该细胞在1%胎牛血清和全反式维甲酸(RA)的诱导下可分化为具有成熟表型的心肌细胞[10],应用此种诱导方法,先后引起了与心脏发育[11]和药理毒理学许多相关的研究[12-14]。2017年12月至2018年7月,本研究通过乌头碱对H9c2分化的影响,进一步阐释乌头碱对心肌细胞毒性作用机理。
1 材料与方法
1.1 材料与设备 大鼠H9c2心肌细胞(中国典型培养物保藏中心);乌头碱(上海普誉科贸有限公司,生产批号w-006-151225);全反式维甲酸(美国Sigma公司,生产批号WXBC4500V);DMEM干粉培养基(美国Gibco公司);胎牛血清(美国Biological Industries公司,生产批号1640562);引物(上海Sangon Biotech合成);cDNA反转录试剂盒(美国Thermo Scientific公司);SYBR Green PCR Kit(中国TIANGEN公司);兔来源一抗α-actinin抗体(美国Cell Singaling公司);小鼠来源一抗cTnI抗体(美国Santa Cruz Biotechnology,Inc公司);山羊抗兔荧光二抗(美国antgene公司);山羊抗小鼠荧光二抗(美国antgene公司);荧光定量PCR仪(美国Corbett Research公司,Rotor gene 6000);倒置相差显微镜(日本Olympus Corporation公司,CKX41);荧光显微镜(德国Carl zeiss AG公司,Axio scope A1)。
1.2 方法
1.2.1 H9c2细胞的培养 H9c2细胞接种到含有10%胎牛血清、100 kU//L青霉素和100 mg/L链霉素的高糖DMEM培养基中,于37℃、5%二氧化碳培养箱培养,胰蛋白酶消化传代备用。
1.2.2 乌头碱对H9c2细胞增殖影响 采用噻唑蓝比色法(MTT)检测乌头碱对H9c2细胞增殖的影响,取对数生长期的H9c2细胞以5×107个/L的细胞浓度接种于96孔培养板中,每孔加入200 μL细胞悬液。24 h后,加入200 μL的乌头碱溶液,使其终浓度分别为10、30、50、70、90、110 μM/L,每组设7个复孔,继续培养5 d、3 d换液。加入5 g/L的MTT,37℃孵育4 h,再加入150 μL DMSO。振荡10 min使结晶甲臜充分溶解后用酶联免疫检测仪490 nm波长下检测OD值。细胞增殖率=实验组平均值/对照组平均值×100%。
1.2.3 细胞分组培养 取对数生长期的H9c2细胞接种于6孔板和24孔板中,待细胞生长至90%融合度时加入不同实验分组的诱导因子,实验分组为:①正常培养组(含10%胎牛血清的DMEM培养基),②分化模型组(含1%胎牛血清、1 μM/L RA的DMEM培养基),③乌头碱处理组(含1%胎牛血清、1 μM/L RA、50 μM/L乌头碱的DMEM培养基)。于37℃、5%二氧化碳培养箱培养,3 d换液培养5 d后光镜照相。
1.2.4 荧光定量PCR(qPCR)检测分化相关基因的表达 H9c2细胞分组培养结束后取6孔板用TRIZOL试剂完全裂解细胞,将细胞裂解液用氯仿抽提,异丙醇沉淀,沉淀RNA溶于DEPC水后测定其纯度与含量后应用逆转录试剂盒将其逆转录成cDNA。将cDNA作为模板加入目的基因引物进行荧光定量PCR检测,反应条件:95℃,5 min;60℃,20 s;72℃,1 min,40个循环。以目的基因域循环数(Threshold cycle,Ct)值对同一样本的内参照基因GAPDH Ct值进行目的基因表达的相对定量分析。目的基因引物序列(见表1)。
1.2.5 免疫荧光化学染色观察胞质内α-actinin表达 将接种于24孔板中的不同组细胞用PBS洗3次,4%多聚甲醛固定30 min。PBS洗后加入1‰的TritonX-100破膜15 min;PBS洗3次,驴血清封闭30 min;加入PBS稀释的兔来源α-actinin抗体(1∶100)4℃过夜;第2天37℃复温1 h,洗去多余的一抗,PBS洗3次,每次5 min。加入用PBS稀释的山羊抗兔二抗(1∶100),37℃孵育1h,PBS洗3次后加入浓度为1 μg/mL的DAPI染色15 min,PBS洗3遍,封片观察。

表1 引物序列
1.2.6 蛋白质印迹法检测cTnI及α-actinin蛋白表达 将接种于6孔板中的不同组细胞弃培养基,加入RIPA裂解液,冰上孵育30 min,收集上清液。BCA法检测上清液中蛋白质浓度后,使用30 μg总蛋白进行SDS-PAGE电泳后,采用湿转法将蛋白转移至PVDF膜,5%脱脂牛奶室温封闭2 h后,分别加入抗大鼠α-actinin、cTnI、和α-tublin抗体(1∶1 000稀释),4℃孵育过夜。TBST漂洗后加入辣根过氧化物酶标记的二抗孵育2 h,ECL显色。
1.3 统计学方法 采用SPSS 19.0统计软件进行单因素方差分析对比组间差异,结果以表示,LDS法均值两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 MTT法检测乌头碱对H9c2细胞生长活性的影响 与对照组相比,随着乌头碱作用浓度的增加,H9c2细胞的增殖率逐渐降低。不同浓度10、30、50、70、90、110 μM/L乌头碱处理的H9c2细胞增殖率为(0.940±0.033),(0.732±0.027),(0.570±0.041),(0.347±0.031),(0.196±0.029),(0.137±0.026),与对照组相比增殖率降低,均差异有统计学意义(P<0.05)。
2.2 大鼠H9c2细胞各组形态学观察 对照组显示出正常H9c2细胞形态为梭形,在分化模型组中H9c2细胞呈现出细长的形态,而乌头碱处理组中细长形态细胞减少,细胞密度相对减少,与对照组细胞形态相近(见图1)。
2.3 免疫荧光化学染色观察α⁃actinin分布 大鼠H9c2细胞α-actinin免疫荧光表达情况主要为细胞质表达。正常培养组的H9c2仅有个别细胞表达,经分化诱导培养基培养后的表达细胞数量增多,α-actinin阳性胞质形态呈现细长形态,DAPI染色且呈现出多核聚集的现象。细胞而加入乌头碱后α-actinin阳性细胞减少,细长形态细胞减少,表达受到抑制(见图2)。
2.4 qPCR检测目的基因的表达情况 qPCR结果显示,与正常培养组相比,分化模型组中,actc1、myl1、myl2、tnnt2的mRNA表达均上调(P<0.01);nppb的mRNA表达降低(P<0.05)。与分化模型组相比,乌头碱处理组中,actc1、myl1、myl2、tnnt2的mRNA表达均下调(P<0.01);nppb的mRNA表达上调但差异无统计学意义(见表2)。
2.5 各组H9c2细胞cTnI及α⁃actinin蛋白表达情况 蛋白质印迹法结果显示,与正常培养组相比,分化模型组中cTnI及α-actinin的蛋白表达升高。与分化模型组相比,乌头碱处理组中cTnI及α-actinin的蛋白表达下降。见图3。
表2 荧光定量PCR(qPCR)分析大鼠H9c2细胞各组分化相关基因的表达/
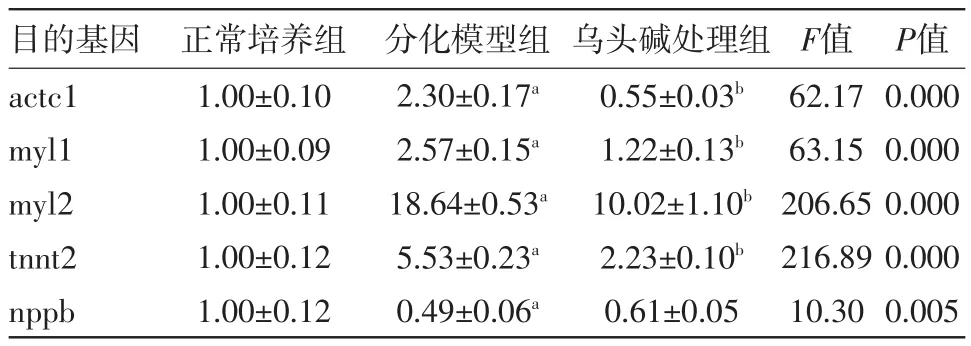
表2 荧光定量PCR(qPCR)分析大鼠H9c2细胞各组分化相关基因的表达/
注:与正常培养组比较,aP<0.01;与分化模型组比较,bP<0.01
images/BZ_24_1286_614_2240_673.pngactc1 myl1 myl2 tnnt2 nppb 0.000 0.000 0.000 0.000 0.005 1.00±0.10 1.00±0.09 1.00±0.11 1.00±0.12 1.00±0.12 2.30±0.17a 2.57±0.15a 18.64±0.53a 5.53±0.23a 0.49±0.06a 0.55±0.03b 1.22±0.13b 10.02±1.10b 2.23±0.10b 0.61±0.05 62.17 63.15 206.65 216.89 10.30

图3 蛋白质印迹法检测心肌肌钙蛋白I(cTnI)及α肌动蛋白(α-actinin)表达情况
3 讨论
H9c2广泛应用于大鼠的生理和心脏毒性研究,先前的研究表明该细胞在1%胎牛血清和RA的诱导条件下可分化为具有成熟表型的心肌细胞,分化后的细胞与10%胎牛血清正常培养的H9c2细胞形态有显著差异,其特点为形态细长并伴有多核聚集[10]。因为H9c2具有分化为成熟心肌细胞的能力,所以其作为一种分化模型在多个研究中得到应用[15-16]。最近较为热门的细胞外基质微环境诱导H9c2分化为成熟心肌细胞的研究中发现,H9c2细胞分化后具有高表达心肌细胞标志物F-actin、α-actinin、cTnI、以及myl2和tnnt2基因表达的增高的特点。而BNP作为一个胚胎心肌高表达的标记物受到nppb基因的调控,在未分化的H9c2心肌细胞中有较高的表达而分化后的成熟心肌细胞表达下降[17-18]。所以本研究采用qPCR检测分化相关基因actc1、myl1、myl2、tnnt2、nppb,免疫荧光染色观察αactinin表达以及蛋白质印迹法检测α-actinin、cTnI蛋白定量来分析H9c2心肌细胞的分化情况。
之前的研究表明,乌头碱对H9c2细胞有毒性作用能够诱导其凋亡的产生[8]。本研究分别使用不同浓度的乌头碱刺激H9c2细胞后用MTT检测细胞增殖抑制率,乌头碱对H9c2细胞的增殖抑制情况与先前的研究结果一致。因为RA诱导分化是一个较为长期的过程,之前的研究中诱导天数一般在5~7 d。我们用MTT检测乌头碱作用5 d后细胞的增殖率,挑选50 μM/L的乌头碱浓度行后续实验。本研究将H9c2在1%胎牛血清和RA培养条件下成功的诱导成为形态细长并伴有多核聚集的H9c2心肌细胞。在H9c2分化诱导的培养基中加入50 μM/L的乌头碱后,结果表明经乌头碱处理后的H9c2细胞细长形态减少,多核聚集减少。mRNA呈现出actc1、myl1、myl2、tnnt2表达均降低(P<0.05),而nppb的mRNA表达处理前后差异无统计学意义。免疫荧光染色显示出分化后的H9c2细胞胞质内α-actinin的表达增强,而加入乌头碱后α-actinin的表达降低,典型的分化细胞数量减少。同时蛋白质印迹法检测后显示分化后cTnI及α-actinin蛋白表达增高,而乌头碱处理组表达降低。说明分化诱导培养基中加入乌头碱后H9c2细胞的分化受到抑制。
众所周知,成熟的心肌细胞能够有节律的跳动,这种生理功能是一系列复杂调控的结果,但是必不可少的就是粗细肌丝的滑动。目前对于H9c2向成熟心肌细胞分化的研究中,纵使没有出现节律跳动的情况,但大多根据形态的改变,多核聚集的出现,肌丝的形成以及相关基因和蛋白的表达来证明其向成熟心肌细胞分化的事实[18]。本研究通过乌头碱对RA诱导H9c2分化的抑制作用,揭示了乌头碱对H9c2分化相关基因和蛋白的抑制情况。其中actc1、myl1、myl2、tnnt2都是参与肌丝形成所需蛋白的重要调控基因,这些基因的表达能够直接反应心肌细胞的分化的程度。另外α-actinin表达的改变也印证了乌头碱对心肌分化标志物的抑制作用。我们可以猜想乌头碱能够通过某种方式影响心肌细胞肌丝中蛋白的表达从而导致肌丝的功能出现障碍,成为乌头碱引发心脏毒性的机制。(本文图1,2见插图7-1)
