大豆品种郑97196 抗疫霉病基因RpsZheng 精细定位
2020-07-06张雪翠段灿星孙素丽朱振东
张雪翠 钟 超 段灿星 孙素丽,* 朱振东,*
1 中国农业科学院作物科学研究所, 北京100081; 2 沈阳农业大学农学院, 辽宁沈阳110866
大豆[Glycine max(L.) Merrill], 不仅是世界上 的主要油籽作物, 也是食用、饲料和工业原料的重要来源。近年来, 大豆种植面积不断下降, 而国内需求却不断增长, 导致国内大豆供需不平衡, 对外依存度很高, 使我国成为世界上最大的大豆进口国[1]。在大豆生产中, 大豆病害是限制大豆高产的一个重要因素。其中, 由大豆疫霉(Phytophthora sojaeKauf. &Gerd)引起的大豆疫霉病是一种破坏性大豆病害, 显著影响大豆产量, 其危害程度仅次于大豆胞囊线虫病[2-3]。大豆疫霉病于20 世纪80年代末在我国东北地区首次被发现, 之后该病害的发病区域在中国大豆产区不断扩大。迄今, 大豆疫霉病在内蒙古自治区、福建省、新疆维吾尔自治区、黄淮海地区以及长江流域均有发生[4]。
大豆疫霉是一种土传性植物病原菌, 其卵孢子可以在土壤中存活数年, 在适宜条件下卵孢子萌发形成孢子囊, 随后释放游动孢子侵染植株[5]。大豆疫霉在大豆的整个生育期均可侵染大豆。培育抗病品种是控制大豆疫霉病最为有效、经济和环境友好的措施[6-7]。大豆对大豆疫霉的抗性有 2种类型, 即由单个显性基因控制的质量抗性和由多个微效基因控制的数量抗性[8]。通常数量抗性具有广谱性和持久性, 但不能抵御较强病害压力且在常规育种中很难利用, 因此质量抗性基因的发掘与利用一直是研究的重点。迄今, 已在大豆2 号、3 号、7 号、10 号、13 号、14 号和16~19 号染色体上鉴定了30 多个抗疫霉病基因, 其中3 号染色体上最多[9-12]。然而, 研究表明, 在已鉴定的抗疫霉病基因中, 仅Rps1c、Rps1k、RpsYD25和RpsYD29等能够抵御我国的大豆疫霉种群[13-16]。因此, 需要不断挖掘新的大豆抗疫霉病基因, 以保障大豆抗病育种的可持续性。
大豆品种郑97196 是2008年由河南省农业科学院经济作物所利用郑100 为母本、郑93048 为父本杂交选育而成, 具有抗花叶病毒病、紫斑病、大豆胞囊线虫和抗倒伏的优良特性[17-18], 是当前黄淮地区主要大豆栽培品种之一。前期, 本研究团队发现郑97196 对大豆疫霉具有很宽的抗谱[19], 张海鹏等[20]在其 3 号染色体上初步定位了一个抗疫霉病基因RpsZheng。本研究将利用抗、感亲本的全基因组重测序数据继续开发与抗疫霉病基因RpsZheng连锁的分子标记, 缩小RpsZheng的候选基因组区域, 开发紧密连锁的分子标记。
1 材料与方法
1.1 植物材料
用于抗病基因分析的大豆品种为抗疫霉病品种郑97196、23 个含有单一抗疫霉病基因的大豆品种以及3 个感病对照品种(Williams、中黄13 和豫豆21)(表1), 用于验证共分离分子标记品种为226 个已知抗性表型的大豆品种(附表1), 用于抗病基因作图的群体为Williams 与郑97196 杂交衍生的188 个F2:3家系。所有试验材料均由中国农业科学院作物科学研究所提供。
1.2 大豆疫霉
用于本研究的10 个大豆疫霉分离物分别由南京农业大学王源超教授、东北农业大学张淑珍教授和本研究室提供(表1)。分离物在10℃下保存, 使用时在V8汁琼脂培养基上活化, 24℃培养8~10 d, 用于接种。
1.3 抗病性鉴定
选取抗病亲本郑97196、感病亲本Williams 以及23 个含有单一抗疫霉病基因的大豆品种和感病对照中黄13 和豫豆21 各15~20 粒种子, 作图群体每个家系选取20~25 粒种子, 播种在以蛭石为基质的1000 mL 纸杯中, 播种后在25℃温室培养; 每个品种播种10 杯, 分别接种10 个大豆疫霉分离物, 作图群体F2:3家系用分离物PsJS2 进行抗性鉴定。待植株第一对真叶平展开后, 采用下胚轴创伤接种法进行接种[16,21-22]。接种时, 先用注射器针头在大豆植株子叶下方1 cm 处下胚轴划长约1 cm 的伤口, 再用注射器在伤口上注射约0.2 mL 的接种体。将接种后植株置23~25℃、湿度为100%的保湿间内保湿48 h, 然后转入25℃温室内继续培养3 d 进行表型调查[21-23]。抗性评价参照Zhang 等[21-22]的标准, 每个品种或家系的死亡率小于21%, 记为抗病(resistant, R); 植株死亡率在 21%~79%之间, 记为中间类型或杂合(segregating, Rs); 植株死亡率大于79%, 记为感病(susceptible, S)。试验重复2 次, 重复2 次结果不一致的进行第3 次鉴定。
1.4 大豆基因组DNA 的提取
亲本Williams 和郑97196 及作图群体的每个F2:3家系分别等量采集15~20 个植株的混合叶片, 采用新型植物基因组DNA 提取试剂盒(离心柱)(天根生物科技, 中国北京), 参照其使用说明提取基因组DNA。
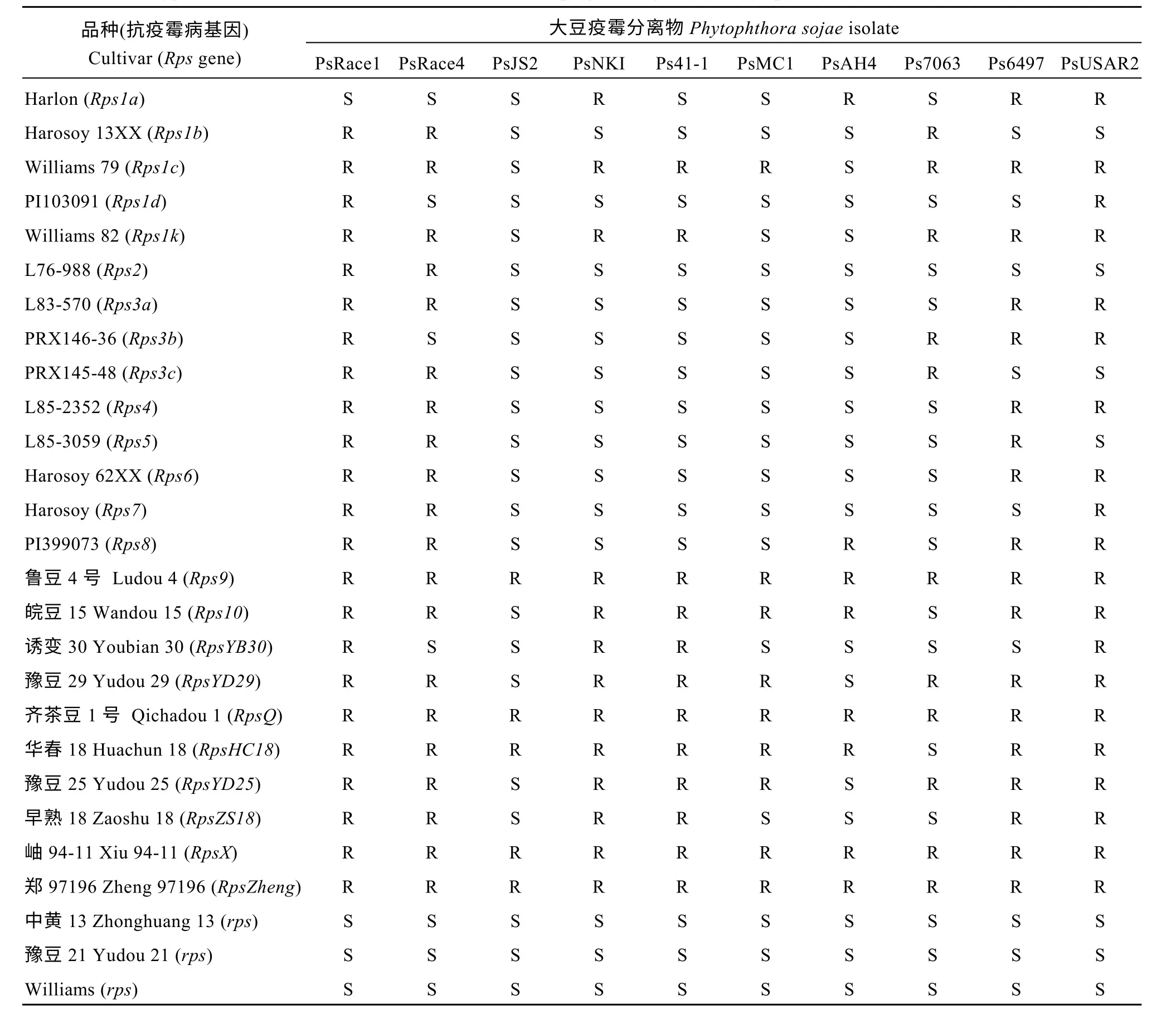
表1 28 个大豆品种对10 个大豆疫霉分离物的抗性反应型Table 1 Phenotypic reaction of 28 cultivars, with and without Rps genes, against 10 Phytophthora sojae isolates
1.5 SSR 分析及遗传连锁图谱构建
基于张海鹏等[20]对RpsZheng的初步定位结果,选择位于大豆3 号染色体上已经公布的SSR 标记在Williams 和郑97196 之间进行多态性筛选[21,24]。SSR引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为10 μL, 包含上下游引物各0.2 μL、2 ×TaqPCR MasterMix (Tiangen) 4 μL、模板DNA 2 μL(20 ng), ddH2O 补足至10 μL。反应程序为94℃预变性 5 min; 94℃变性45 s, 55℃退火45 s (不同引物退火温度略有不同), 72℃延伸45 s, 35 个循环; 72℃延伸 10 min, 4℃保温。在 PCR 产物中加入 2 μL 6×loading buffer, 用8%非变性聚丙烯酰胺凝胶电泳检测PCR 产物, 筛选出的亲本间具有多态性的SSR标记用于鉴定188 个F2:3家系基因型。
基于群体表型和基因型鉴定结果, 用作图软件MAPMAKER/EXP version 3.0 进行遗传连锁分析[25],遗传距离的计算依据 Kosambi 作图函数[26], loglikelihood 似然值设置为3.0。采用MapDraw 软件绘制遗传连锁图谱[27]。
1.6 InDel 标记的开发及精细作图
基于构建的抗疫霉病基因RpsZheng遗传连锁图谱, 在 Williams 82 参考基因组中(https://www.soybase.org/)获得抗疫霉病基因RpsZheng两侧最紧密连锁的分子标记的物理位置, 以确定抗病基因候选区域在大豆基因组的物理区间。利用二代测序技术对亲本Williams 和郑97196 进行全基因组重测序,基于2 个亲本品种的全基因组重测序数据开发抗病基因候选区域内的多态性InDel 标记, 用于进一步精细定位抗疫霉病基因。采用NCBI 引物设计工具Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计引物, PCR 程序与电泳检测方法参照SSR 标记的检测方法。
1.7 共分离标记的特异性检测
对RpsZheng候选区域内开发的共分离标记在23 个含有已知抗疫霉病基因大豆品种和226 个大豆品种中进行检测。
2 结果与分析
2.1 抗性表型鉴定
3 个感病品种Williams、中黄13 和豫豆21 所有植株接种10 个大豆疫霉分离物后全部死亡, 抗病亲本郑97196 植株接种后100%存活且未出现任何发病症状,表现出完全抗性, 其他23 个含有单一抗疫霉病基因的大豆品种分别抗3~10 个分离物, 共产生了16 种抗性反应类型, 其中郑97196 的抗性反应型与鲁豆4 号、齐茶豆1 号以及岫94-11 的抗性反应型一致(表1)。
Williams 与郑97196 杂交衍生的188 个F2:3家系接种大豆疫霉分离物PsJS2 后, 47 个鉴定为抗病家系, 91 个为抗、感分离的杂合家系, 50 个为感病家系。通过卡平方检验(χ2), 抗病家系∶杂合家系∶感病家系符合1∶2∶1 的期望分离比, 表明郑97196对大豆疫霉PsJS2 的抗性是由一个显性单基因控制(表2), 与张海鹏等[20]接种大豆疫霉分离物HeN35的结果一致。
2.2 SSR 标记分析和遗传连锁图谱构建
张海鹏等[20]将郑97196 的抗大豆疫霉病基因RpsZheng定位在大豆3 号染色体的SSR 标记satt485和satt584 之间, 遗传距离分别为2.1 cM 和3.7 cM。本研究选择3 号染色体已经公布的311 个SSR 标记在Williams 和郑97196 之间进行多态性筛选, 获得16 个多态性SSR 标记, 即BARCSOYSSR_03_0108、BARCSOYSSR_03_0151、BARCSOYSSR_03_0247、BARCSOYSSR_03_0250、BARCSOYSSR_03_0269、BARCSOYSSR_03_0300、BARCSOYSSR_03_0315、BARCSOYSSR_03_0344、BARCSOYSSR_03_0358、BARCSOYSSR_03_0382、Satt159、SattWM82_39、Satt1k3、Sat_084、Satt485 和Satt125, 其中Satt159、Satt485 和Satt125 为张海鹏等构建遗传连锁图谱的标记[20]。用这些标记进一步鉴定F2:3群体的188 个家系基因型。对188 个F2:3家系的表型和基因型结果进行连锁分析表明, 这16个SSR标记均与抗疫霉病基因连锁, 抗疫霉病基因定位在标记SattWM82_39 和BARCSOYSSR_03_0269 之间, 遗传距离分别为2.5 cM 和 1.0 cM, 标记 BARCSOYSSR_03_0247、BARCSOYSSR_03_0250 和Satt1k3 与抗疫霉病基因共分离(图1-A)。本研究定位的郑97196 抗疫霉病基因与张海鹏等定位的RpsZheng具有3 个相同的连锁标记Satt159、Satt485 和Satt125[20], 表明为同一个基因。
2.3 InDel 标记精细定位抗病基因
在大豆Williams 82 参考基因组上, 抗疫霉病基因侧翼标记 SattWM82_39 和 BARCSOYSSR_03_0269 间的物理距离为959.7 kb。为了进一步缩短RpsZheng定位区间的物理距离, 对Williams 和郑97196 进行了全基因组重测序, 基于测序数据鉴定出Williams 和郑97196 在抗病基因候选区域959.7 kb 的InDel 位点, 开发了15 个亲本间多态性InDel标记。进一步用这些标记鉴定作图群体基因型, 结果表明15 个InDel 标记在群体中均呈现出1∶2∶1分布, 为共显性标记(附表2)。遗传连锁分析表明, 15个InDel 标记均与抗疫霉病基因连锁。
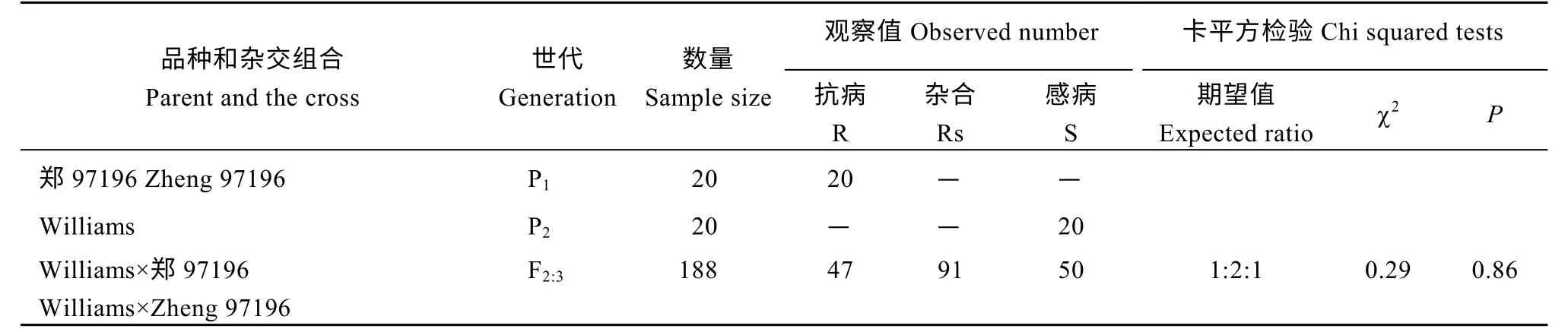
表2 Williams 和郑97196 及其杂交衍生的F2:3 群体对大豆疫霉分离物PsJS2 抗性遗传分析Table 2 Genetic analysis of resistance to Phytophthora sojae isolate PsJS2 in the F2:3 population derived from Williams×Zheng 97196
基于作图群体抗性表型和SSR、InDel 标记基因型数据构建抗疫霉病基因遗传连锁图, 抗疫霉病基因被定位在InDel 标记WZInDel7 和WZInDel12 之间, 与2 个标记的遗传距离分别为0.1 cM 和0.5 cM,在Williams 82 参考基因组(Glycine maxV2.0)上的物理 距 离 为 105.2 kb, WZInDel8 、 WZInDel9 、WZInDel10 和WZInDel11 四个标记与抗疫霉病基因共分离(图1-B, C)。根据大豆基因组Glycine maxV2.0 注释, 在该定位区间内共存在11 个基因模型(表3), 其中Glyma.03g035300和Glyma.03g036000含有Ser/Thr 蛋白激酶结构, 推测为最佳抗病候选基因。

图1 RpsZheng 定位区域遗传连锁图和物理图Fig. 1 Genetic and physical maps of the RpsZheng region

表3 大豆3 号染色体上RpsZheng 定位区间内(105.2 kb)的基因及注释(Glycine max V2.0)Table 3 Gene and gene annotation of the 105.2 kb genomic region for RpsZheng on chromosome 3 (Glycine max V2.0)
2.4 共分离标记的特异性检测
为了验证抗疫霉病基因RpsZheng的7 个共分离标记的特异性, 用这些标记鉴定23 个含有已知抗疫霉病基因的大豆品种和感病品种Williams、豫豆21号和中黄13, 发现除Williams 79 (Rps1c)、豫豆29(RpsYD29)和豫豆25 (RpsYD25)外, 标记WZInDel11能够区分RpsZheng与其他含抗疫霉病基因及感病品种(图2-A), 表明该标记能够有效鉴定RpsZheng。为了进一步验证WZInDel11 的特异性, 利用该标记鉴定226 个大豆品种, 结果只在豫豆23、郑92116、周豆11、皖豆24、皖豆29 和皖宿2156 中检测到目标条带(图2-B)(附表1)。对目的片段测序结果表明,Williams 79 (Rps1c)、豫豆29 (RpsYD29)和豫豆25(RpsYD25)、豫豆23、郑92116、周豆11、皖豆24、皖豆29 和皖宿2156 的DNA 序列与郑97196 的一致性为100%, 表明这9 个品种含有WZInDel11 标记。
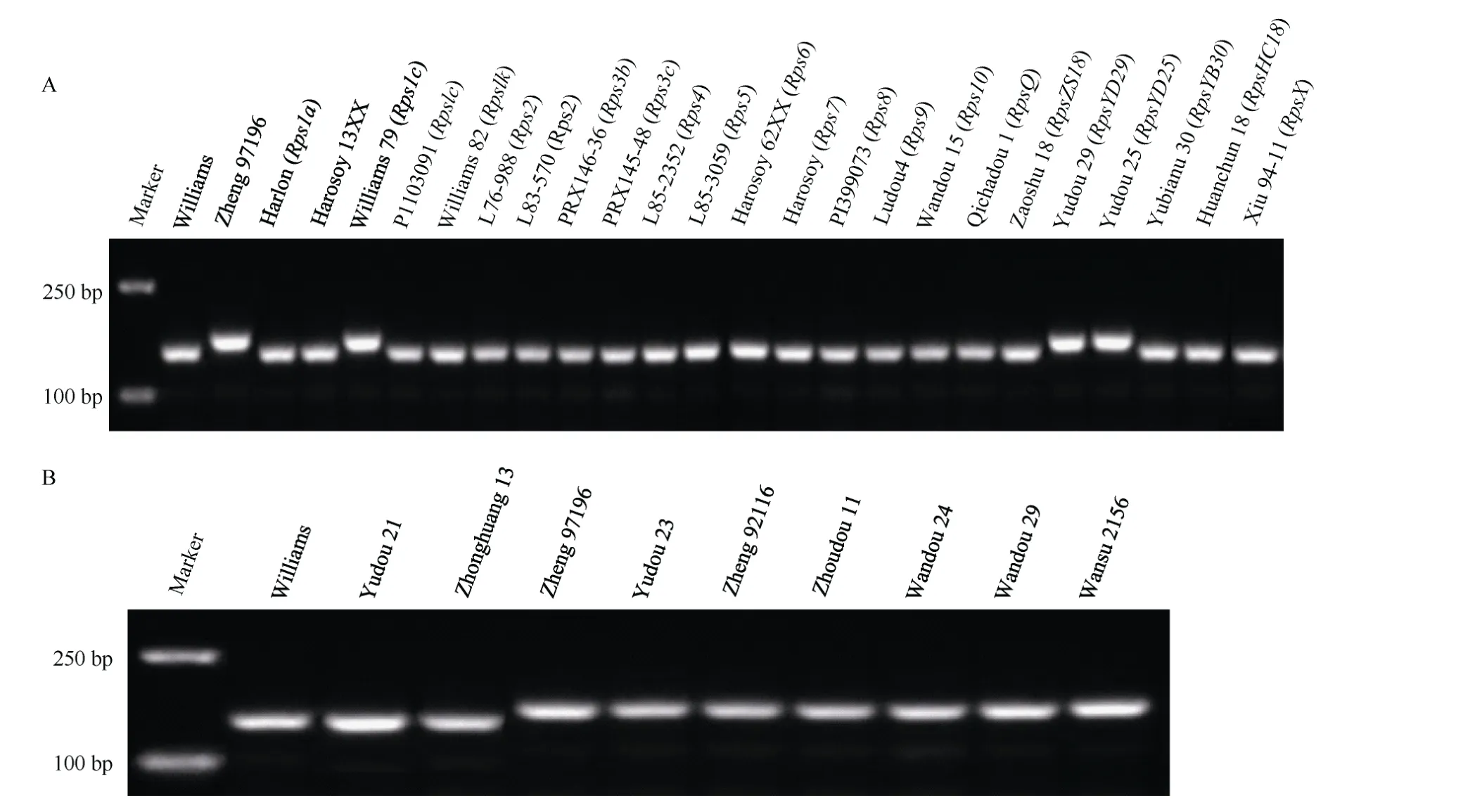
图2 标记WZInDel11 在大豆品种中的分子检测结果Fig. 2 Detection of marker WZInDel11 in soybean cultivars
3 讨论
利用含有抗疫霉病基因的大豆品种是防治大豆疫霉病最为有效、经济和安全的措施[10]。然而, 大豆抗疫霉病基因的有效期通常只能持续8~15年, 因此, 需要不断挖掘新的抗疫霉病基因[30]。通过精细定位抗疫霉病基因及开发紧密连锁的分子标记可以为抗病育种提供分子辅助选择的有效标记, 从而加速大豆抗病育种的进程。前人研究已经证明, 大豆品种郑97196 对大豆疫霉具有广谱抗性[19], 本研究结果表明, 郑97196 对选择的10 个不同毒力型的大豆疫霉分离物均表现为抗病, 进一步证明郑97196是优异的大豆疫霉病抗源。本研究用强毒力大豆疫霉分离物PsJS2 对作图群体进行表型鉴定, 遗传分析证明郑97196 对分离物PsJS2 的抗性由一个显性单基因控制, 与前期用分离物HeN35 鉴定的结果一致[20]。进一步利用SSR 标记对郑97196 中的抗疫霉病基因进行定位, 将抗疫霉病基因定位在3 号染色体SattWM82_39 和BARCSOYSSR_03_0269 之间,并与RpsZheng的已知连锁标记Satt159、Satt485 和Satt125 连锁, 表明郑97196 对分离物PsJS2 的抗性也由RpsZheng控制[20]。
迄今, 除RpsZheng外, 已经在大豆3 号染色体上定位了16 个Rps基因, 包括Rps1的5 个等位基因[29]、Rps7[30]、Rps gene in Waseshiroge[31]、Rps9[32]、
RpsQ[16]、RpsYD29[21]、RpsYD25[33-34]、RpsUN1[23,35]、RpsWY[36]、RpsHN[37]、RpsHC18[10]、RpsX[12]。依据大豆Williams 82 参考基因组分析候选区域, 这些Rps基因都位于3 号染色体上的一个抗病基因簇[21,23,35,37]。本研究基于亲本间全基因组重测序数据开发InDel 标记对RpsZheng进行精细作图, 最终将该基因定位在一个 105.2 kb 的区域内, 并获得BARCSOYSSR_03_0247、BARCSOYSSR_03_0250、Satt1k3、WZInDel8、WZInDel9、WZInDel10 和WZInDel11 七个共分离标记。在构建的RpsZheng遗传连锁图和物理图谱中, 除标记 Satt1k3 和BARCSOYSSR_03_0247 外, 其余14 个SSR 标记和15 个InDel 标记的顺序与参考基因组中的物理位置相一致, 表明本研究定位RpsZheng的准确性。Satt1k3 和BARCSOYSSR_03_0247 在遗传图谱位置上的不一致, 可能是作图群体间遗传背景的差异所致[21-22]。Satt1k3 是基于克隆Rps1k基因序列开发的SSR 标记, Zhang 等[21]发现RpsYD29与Satt1k3 遗传距离为1 cM。最近, 钟超发现RpsYD25与Satt1k3遗传距离为2.2 cM (钟超, 未发表数据)。在本研究中,RpsZheng与标记Satt1k3 共分离, 表明RpsZheng与RpsYD25和RpsYD29位于3 号染色体的相同基因簇, 与Rps1座位紧密连锁或是Rps1座位的等位基因。RpsZheng也定位在已经发表的大豆抗疫霉病基因RpsHN候选区域[37]。但是, Niu 等[37]用8 个大豆疫霉分离物对含有RpsHN的大豆品种蒙8206 进行抗性鉴定, 发现该品种仅对一个分离物表现抗性。钟超等用本研究的10 个分离物鉴定蒙8206 的抗性,发现该品种仅抗 PsRace1 (钟超, 未发表数据)。RpsZheng与RpsHN对大豆疫霉分离物的抗谱存在很大差异, 所以不可能为同一个基因, 推测RpsZheng与RpsHN可能是等位基因或者是紧密连锁的基因。虽然本研究未能通过抗谱将郑97196 与岫94-11、齐茶豆1 号和鲁豆4 号区分开, 但是岫94-11、齐茶豆1 号和鲁豆4 号抗疫霉病基因均被定位在与RpsZheng不同的区域, 表明RpsZheng不同于RpsX、RpsQ和Rps9[12,16,32]。
为了发掘抗疫霉病基因的特异性标记, 本研究用获得的RpsZheng共分离标记对含有已知抗疫霉病基因的大豆品种及3 个感病对照品种进行了检测,发现除Williams 79 (Rps1c)、豫豆29 (RpsYD29)和豫豆25 (RpsYD25)外, 标记WZInDel11 能够有效地将RpsZheng与其他抗疫霉病基因区分, 含Rps1c的Williams 79、含RpsYD25的豫豆25 以及含RpsYD29的豫豆29 中存在WZInDel11 目标片段(图2-A), 且目标片段DNA 序列与郑97196 的一致性为100%。该标记不能区分Rps1c、RpsYD25、RpsYD29和RpsZheng,表明这4 个基因有可能是等位基因, 而WZInDel11位于基因组非编码区, 并不是RpsZheng的功能标记。Rps1c、RpsYD25、RpsYD29和RpsZheng都定位在3号染色体相同的抗病基因簇, 具有对大豆疫霉相似的抗谱, 且RpsYD25、RpsYD29和RpsZheng具有相同祖先[38], 抗性上的差异可能因为遗传背景的不同或在选育过程中发生遗传变异所导致。用标记WZInDel11 对226 个大豆品种进行检测, 结果发现在豫豆23、郑92116、周豆11、皖豆24、皖豆29 和皖宿2156 中检测到目标片段(图2-B)(附表1), 且目标片段DNA 序列与郑97196 的一致性为100%, 系谱表明这些品种与郑97196 有共同的祖先或亲缘关系较近[38-41],推测在这些大豆品种中含有抗疫霉病基因RpsZheng或其等位基因。事实上, 除对大豆疫霉分离物PSJS2感病外, 豫豆23、周豆11、皖豆24、皖豆29 和皖宿2156都具有与郑97196相近的抗大豆疫霉谱, 是优异的大豆疫霉病抗源[42-43]。因此以标记WZInDel11 作为分子辅助选择工具, 即使在感病条件下也能够有效地将这些品种的抗疫霉病基因RpsZheng或其等位基因导入育种材料。另外, 中黄59 号、鲁0413、徐豆1 号、早熟1 号、早熟3 号、中品12585、济087201、吉育94、铁丰3 号、新大粒1 号的抗性反应型为抗病, 但是不含有标记WZInDel11, 系谱表明这些品种与郑97196 没有共同的祖先或亲缘关系较远, 这些品种可能含有不同于RpsZheng的抗疫霉病基因, 值得进一步发掘和利用。
4 结论
将大豆品种郑97196 抗疫霉病基因RpsZheng精细定位在105.2 kb 基因组区域, 开发了能够用于抗疫霉病基因RpsZheng检测的共分离标记WZInDel11,鉴定了6 个含有RpsZheng或等位基因的大豆品种,研究结果为大豆疫霉病防控、进一步分子辅助选择育种和基因功能研究奠定了基础。
附表 请见网络版: 1) 本刊网站http://zwxb.chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodical-zuowxb.aspx。
