干扰FOS表达对KSHV感染的神经元细胞增殖的影响
2020-07-02徐慧玲曹冬冬李英张晓艳吴淑媛王晓露潘泽民李冬妹
徐慧玲,曹冬冬,李英,张晓艳,吴淑媛,王晓露,潘泽民,李冬妹*
(1石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002;2新疆生产建设兵团第八师石河子市妇幼保健院,新疆 石河子 832000)
卡波氏肉瘤相关疱疹病毒(Kaposi′s sarcoma associated herpesvirus,KSHV),又称人类疱疹病毒8(Human Herpesvirus-8,HHV-8)。该病毒于1994年被发现,由Chang等人从艾滋病(AIDS)患者的卡波氏肉瘤(KS)病变中分离出来,KSHV是除Epstein-Barr virus 之外唯一可导致癌症的γ2-型疱疹病毒[1]。自鉴定出KSHV以来,有三种疾病被认为与KSHV感染有关:卡波氏肉瘤(KS)、多中心Castleman病(MCD)和原发性积液性淋巴瘤(PEL),且迄今为止KSHV被确认为KS的病原体[2]。早前的研究报道KSHV主要感染的细胞类型为内皮细胞、上皮细胞、B细胞、角质形成细胞和单核细胞[3-4]。
由HIV感染引起的细胞介导的免疫功能的逐渐消耗和随后的免疫功能丧失,使患者容易患上一系列异常恶性肿瘤,而AIDS患者易感染KSHV,由KSHV感染导致的肿瘤是AIDS患者最常见的死亡原因,且部分患者出现记忆丧失、智力减退和行为改变等神经系统症状[5-6]。近年来有研究发现HIV/AIDS阳性个体的中枢神经系统(CNS)中可以检测到KSHV 的病毒DNA[7],本课题组前期也验证了KSHV可以直接感染神经元细胞[8],KSHV感染对中枢神经系统和神经细胞宿主基因的表达和活性的改变以及KSHV病毒本身是否有影响还有待进一步研究。
对原癌基因中即刻早期应答基因(IEG)的研究提示,FOS蛋白是神经元被刺激激活的一种标志,在细胞的增殖和分化扮演着至关重要的作用[9],有研究报道感染KSHV的B细胞中FOS与KSHV病毒的多个启动子直接结合,激活病毒多种基因的转录[10-11],但其在KSHV感染的神经元细胞中的作用尚不清楚。本研究采用重组病毒rKSHV.219感染SH-SY5Y细胞建立感染细胞模型,通过干扰FOS基因的表达来探究FOS对KSHV感染的神经元细胞的增殖以及KSHV病毒的影响。
1 材料与方法
1.1 实验材料
高糖DMEM培养基、胎牛血清、胰酶、嘌呤霉素、G418购于美国GIBCO公司,强力霉素、丁酸钠购于德国Sigma Aldrich公司,潮霉素、Lip2000试剂购于美国Invitrogen 公司,PEG-it病毒浓缩液购于上海SBI公司,MTT购于中国Solarbio公司,鼠抗人FOS购于中国博奥森公司,山羊抗兔IgG、山羊抗鼠IgG购于北京中杉金桥公司,载体pGPU6/GFP/Neo购于上海吉玛制药,大肠杆菌E.coliDH5α,Cell Cycle Staining kit购于中国联科生物。
1.2 实验方法
1.2.1 细胞培养
SH-SY5Y(神经母细胞瘤细胞)细胞采用10%FBS和1%青链霉素的DMEM培养基培养,islk.219细胞(KSHV感染的内皮来源的细胞)采用含 10% 的胎牛血清、6 μg/mL 嘌呤霉素、100 μg/mL G418 和100 μg/mL潮霉素的高糖DMEM培养基培养,SK-RG细胞(KSHV感染的SH-SY5Y细胞)采用于含 10% 的胎牛血清、6μg/mL 嘌呤霉素的高糖 DMEM 培养基中,于含5% CO2的37 ℃恒温箱内培养。
1.2.2 诱导和提取rKSHV.219病毒液
用1 μg/mL强力霉素和1.25 mmol/L丁酸钠处理islk.219细胞72 h诱导KSHV裂解复制,然后收集所有细胞上清液,800 r/min,10 min离心去除残留的细胞,并用0.45 μm滤器无菌过滤含病毒的上清液,将上清液转移至无菌容器中,并在4 ℃下向含KSHV病毒的上清液中加入1/4体积预冷的PEG-It病毒浓缩液,4 ℃冷藏过夜(至少12 h)。在4 ℃下以1 500 r/min离心上清液/PEG-it混合物30 min。吸出上清液,将慢病毒沉淀重悬在无菌的磷酸盐缓冲液中。病毒原液保存在-80 ℃。
1.2.3 KSHV感染SH-SY5Y细胞
采用从islk.219细胞中诱导的rKSHV病毒液感染SH-SY5Y细胞。将感染的SH-SY5Y细胞在37 ℃,5%CO2下培养3 d。用荧光显微镜观察绿色荧光蛋白(GFP),将成功感染的细胞命名为SK-RG。
1.2.4 FOS基因干扰质粒的构建
根据shRNA设计原则合成针对人FOS基因的干扰序sh-FOS:GGGATAGCCTCTCTTACTACC和阴性对照靶序列sh-NC:GTTCTCCGAACGTGTCACGT。将序列分别连接入载体pGPU6/GFP/Neo,通过real time PCR扩增FOS 基因,确定干扰质粒sh-FOS有效,并将其用于后续实验。
1.2.5 细胞转染
使用脂质体Lip2000试剂转染细胞。实验分为阴性对照组(转染NC-sh-RNA)和实验组(转染FOS-sh-RNA)。在1.5 mL EP管中加入250 μL DMEM无血清培养基,再加入2 μgDNA,另取1 mL EP管加入250 μL DMEM无血清培养基,再加入5 μL转染试剂Lip2000,混匀,室温静置5 min后将DNA与转染试剂混合,室温放置20 min。吸去6孔板中的培养基,每孔加入1.5 mL的10%FBS的DMEM培养基,然后再加入500 μL DNA混合液。转染48 h后进行下一步实验。
1.2.6 Real time-PCR检测干扰与未干扰组FOS、RTA、LANA和K8.1的基因表达水平
采用Trizol法提取干扰与未干扰细胞的总RNA。按照日本TaKaRa公司的Prime Script RT reagent Kit with gDNA Eraser逆转录试剂盒说明书合成cDNA,采用Real-time PCR扩增目的片段,包括LANA、RTA、K8.1、FOS以及β-actin;序列为:LANA-F:5′-AGCCACCGGTAAAGTAGGAC-3′,LANA-R:3′-GATGTGACCTTGGCGATGAC-5′;RTA-F:5′-GAGTCCGGCACACTGTACC-3′,RTA-R:3′-AAACTGCCTGGGAAGTTAACG-5′;K8.1-F:5′-AAAGCGTCCAGGCCACCACAGA-3′,K8.1-R:3′-GGCAGAAAATGGCACACGGTTAC-5′;FOS-F:5′-AATCCGAAGGGAAAGGAATAAGA-3′FOS-R:3′-GTCTCCGCTTGGAGTGTATCAGT-5′;β-actin-F:5′-CGGAACCGCTCATTGCC-3′,β-actin-R:3′-ACCCACATCGTGCCCATCTA-5′。RT-PCR反应条件为95 ℃,5min;95 ℃,10 s,55 ℃,30 s,72 ℃,40 s,共计40个循环。
1.2.7 Western Blot检测干扰与未干扰组FOS蛋白表达水平
吸出细胞培养液,用1×PBS清洗2 次并弃去液体,加入以1∶100的比例加入PMSF的RIPA裂解液,置于冰上裂解约30 min,然后高速冷冻离心机4 ℃,12 000 r/min,15 min,收集上清液且加入上清液体积1/4的5× loading buffer 100 ℃,10 min煮沸,冷却到室温后,把蛋白样品直接上样到SDS-PAGE胶加样孔内,电泳80 V,30 min后转110 V,100 min后转膜(电转120 V,60 min)。膜用含5%脱脂奶粉的1×TBST常温封闭2 h,加入一抗(FOS 1∶500,β-actin 1∶1 000),4 ℃孵育过夜,用1×TBST洗膜10 min/次,洗3次。二抗(1∶10 000)室温静置孵育2 h,用1×TBST洗膜10 min/次,洗3次,发光试剂显色1 min左右进行压片显影。
1.2.8 MTT检测干扰与未干扰组的细胞增殖
胰酶消化瞬时转染48 h后的细胞,制备为单细胞悬液,96孔板每孔接种2000个细胞,每个样本设置3个复孔 MTT比色法检测转染后24、48、72 h(37 ℃,5% CO2的条件下)。每孔加入10 μL 5 mg/mL的MTT溶液,将培养板在培养箱内孵育4 h终止培养,小心吸去孔内培养液,每孔加入100 μL二甲基亚砜,置于摇床上低速振荡10 min,使结晶物充分溶解。用酶标仪490 nm处测吸光度来检测细胞增殖活性和生存能力,重复3次实验。
1.2.9 流式细胞术法分析干扰与未干扰组的细胞周期
转染48 h后,收集干扰与未干扰细胞,PBS缓冲液洗涤,胰酶消化,1 000 r/min离心5 min,去上清,用剩余液体重悬沉淀,加入室温的PBS 1 mL,将所有的细胞缓慢加入3 mL预冷的无水乙醇中并置于-20 ℃过夜。第二天将固定好的细胞1 000 r/min离心5 min,弃去乙醇,轻敲试管使沉淀松散,加入室温PBS 2~5 mL,静置15 min使细胞再水合。离心弃上清。加入1 mL的DNA staining solution,涡旋混匀5~10 s。室温避光孵育30 min。然后在流式细胞仪上检测。
1.3 统计学处理
采用Prism8.0统计软件对实验数据进行统计学分析,两个样本之间的比较采用配对样本t检验。检验水准α=0.05,P<0.05,差异具有统计学意义。
2 结果
2.1 KSHV病毒体外能够成功感染神经元细胞SH-SY5Y
rKSHV.219是重组病毒,自身带有绿荧光蛋白(GFP),使得病毒感染成功后即表达GFP显绿色荧光。感染72 h后,于荧光显微镜下检测拍照,检测到GFP表达,说明病毒感染成功(图1)。

图1 KSHV感染与未感染SH-SY5Y细胞GFP检测
2.2 KSHV感染的SH-SY5Y细胞FOS的mRNA表达上调
提取SK-RG细胞(KSHV感染的SH-SY5Y细胞) RNA作为实验组,未感染的SH-SY5Y细胞作为对照组,检测FOS mRNA的表达。结果发现SK-RG细胞中FOS mRNA表达水平高于SH-SY5Y细胞(P=0.0306,N=3),存在统计学差异(图2)。

图2 Real-time PCR检测FOS的mRNA表达水平
2.3 干扰FOS表达的效率检测
FOS干扰载体及空载体转染48 h后收集细胞,提取RNA,采用real time-PCR检测FOS的mRNA表达水平,与空载体转染组相比,干扰载体转染组有效抑制了FOS mRNA的表达(P=0.0365,N=3),差异有统计学意义(图3)。

图3 Real time PCR检测FOS的干扰效率
2.4 SK-RG细胞中干扰FOS后其蛋白水平下调
FOS干扰载体及空载体转染48 h后收集细胞,提取蛋白,采用Western blot检测FOS蛋白的表达水平,与空载体组相比干扰载体能够有效抑制FOS蛋白的表达(P<0.0231,N=3),差异有统计学意义(图4)。
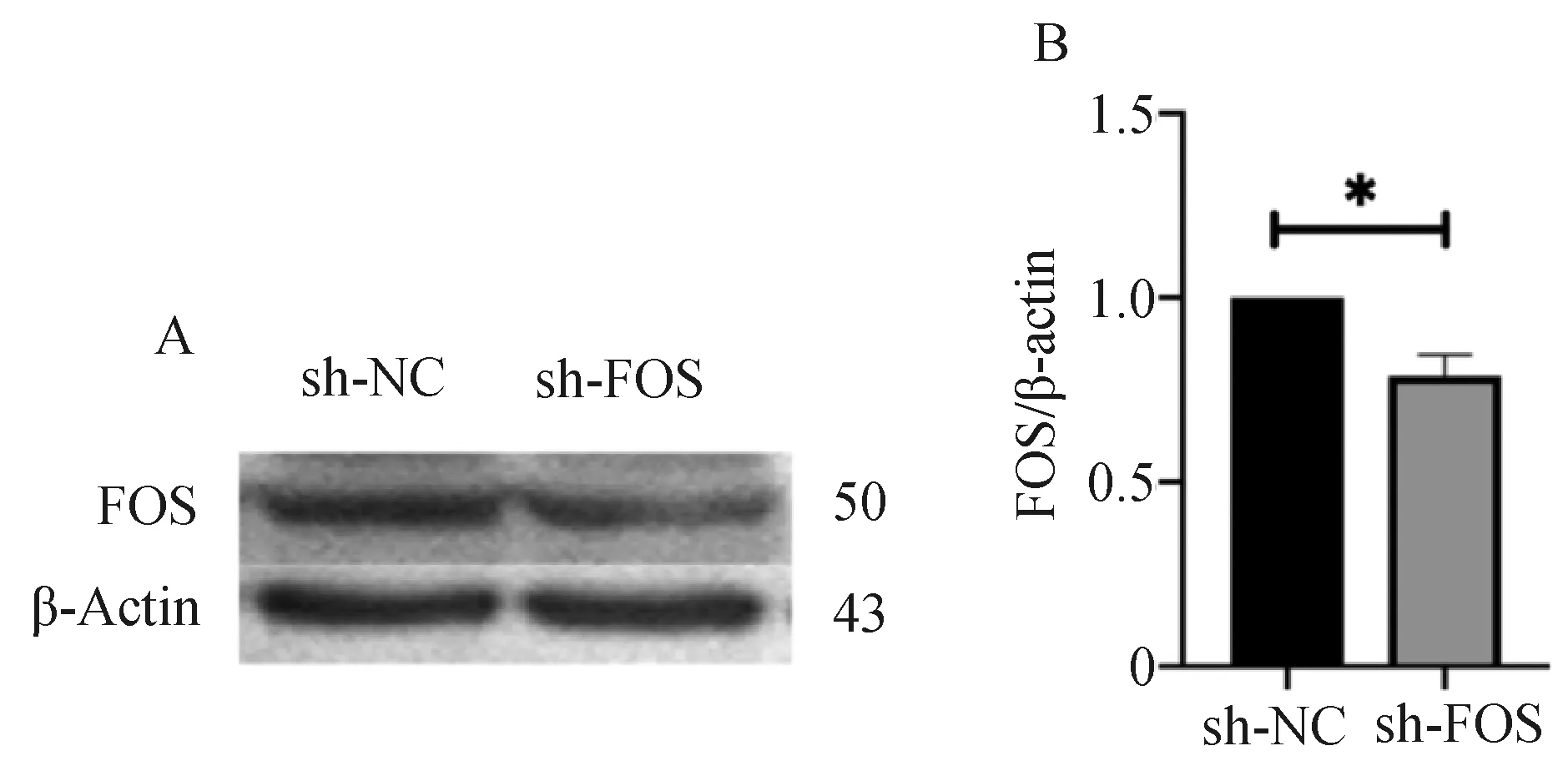
A—sh-NC和sh-FOS的蛋白表达情况 B—sh-NC和sh-FOS的蛋白表达的量化结果图4 Western blot法检测转染后FOS的表达
2.5 干扰FOS后SK-RG细胞中病毒基因LANA、RTA和K8.1表达下调
采用sh-FOS 干扰表达48 h后,收集细胞,提取RNA,采用real time PCR检测病毒基因的表达情况,结果发现与未干扰组相比,干扰FOS基因的表达组KSHV病毒基因LANA、RTA以及K8.1的mRNA的表达水平下调(图5),差异有统计学意义(P<0.05,N=3)。
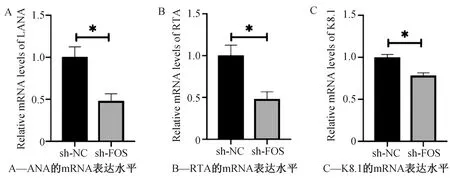
图5 Real time PCR检测干扰FOS后LANA、RTA和K8.1的表达水平
2.6 干扰FOS表达后SK-RG细胞增殖能力下降
取干扰载体FOS-shRNA转染SK-RG细胞研究其增殖特性,同时以转染空载体的SK-RG细胞作为对照。采用MTT法检测不同组细胞的增殖能力,由增殖曲线可见干扰FOS后KSHV感染的SH-SY5Y细胞的增殖水平降低(P<0.01,N=3),表明干扰FOS表达可抑制该细胞的增殖(图6)。
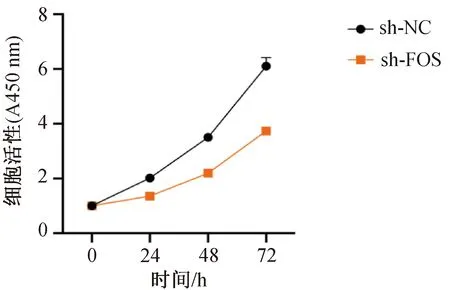
图6 MTT法检测sh-FOS转染SK-RG细胞的增殖能力
2.7 干扰FOS表达后SK-RG细胞出现G0/G1期阻滞
采用流式细胞技术检测干扰与未干扰FOS表达(48 h)的细胞周期情况,结果发现干扰FOS组的细胞出现了细胞周期G0/G1期阻滞(图7),差异有统计学意义(P<0.05,N=3)。

图7 干扰FOS表达后细胞周期检测结果
3 讨论
KSHV是一种双链DNA病毒[12],其对HIV阳性患者非常敏感。在感染KSHV的个体中,HIV感染者的KS风险要比其他类型的免疫抑制者高。有40%的艾滋病患者合并KS,KS是艾滋病患者最常见的早期临床表现之一,同时也是引起艾滋病病人死亡的常见病因。随着AIDS发病率逐年呈增长趋势,KS患病率也呈逐年增长趋势[13]。在HIV阳性合并KSHV的感染者中,有24%的患者出现了散发性脑膜炎的症状[14]。KSHV的感染与患者的神经系统的症状是否有内在的联系还需要进一步验证。
KSHV 感染细胞后可以出现两种状态,即潜伏态和裂解态。KSHV DNA在潜伏态仅表达有限的蛋白质,以促进免疫逃逸并保持病毒存活,例如ORF73编码的潜伏相关核抗原(latency-associated nuclear antigen,LANA)等,潜伏态在被环境等因素刺激下遭到破坏,可能激活静止的基因组;在裂解状态,KSHV基因组变成线性DNA,导致病毒产生,从而使病毒传播,裂解态的病毒也表达该时期相应的蛋白,例如ORF26,K8.1等,其中ORF50编码的立早蛋白RTA(Replication and Transcription Activator,RTA)是KSHV由潜伏态向裂解态转变的分子开关[15],RTA通过诱导裂解基因的表达,控制病毒基因DNA复制和编码病毒结构蛋白重组[16],调节和表达宿主基因。而HIV Tat可诱导RTA表达,促进KSHV进入裂解性周期复制的扩散,并感染更多的细胞[17-18]。
KSHV的致病机制离不开和宿主基因的相互作用,我们通过转录组测序比较及RT-PCR的验证发现FOS基因在KSHV感染的神经母细胞瘤细胞SH-SY5Y细胞模型中表达上调。FOS,也称为c-fos,属于“直接早期基因”家族,是转录水平上不同信号传递的“中转站”,与目的基因结合,激活目的基因的转录活性,完成细胞信号的传导,被称为核内“第三信使”。研究提示FOS蛋白可能是神经元被刺激激活的一种标志,在神经元活化、突触可塑性及神经细胞凋亡中发挥重要作用[17]。通过建立的感染细胞模型,干扰FOS基因的表达,我们进一步分析了FOS对KSHV感染的神经元细胞的增殖以及病毒基因表达的影响。我们发现干扰FOS后能够抑制此细胞的增殖,干扰后的细胞周期G0/G1期出现了阻滞,并且KSHV病毒基因RTA、LANA、K8.1的表达出现了下调。这说明FOS基因可能是通过影响细胞周期而对KSHV感染的神经元细胞的增殖造成影响的,而影响的具体机制可能与其调控KSHV致病蛋白的表达相关。也有研究表明FOS能够调控KSHV基因的表达。在KSHV感染的上皮细胞中,FOS通过与多个KSHV启动子的直接结合而促进了病毒基因的转录,这能够诱导ERK-MAPK的持续激活,ERK-MAPK信号通路是与细胞增殖密切相关的信号通路[18]。因此FOS对KSHV感染SH-SY5Y细胞增殖的影响可能与调控病毒基因的表达相关,具体为哪些致病蛋白,还需要做进一步的研究。
综上所述,我们的研究进一步揭示FOS在KSHV感染的神经元细胞的增殖中发挥重要作用,这为寻找此类疾病的药物靶点奠定理论基础。
