N-(3-异丙氧基-4-甲氧基苯基)-2-氧代环戊烷甲酰胺的合成*
2020-06-30仝红娟
仝红娟,刘 斌
(1.陕西国际商贸学院 医药学院,陕西 西安 712046;2.陕西省中药绿色制造技术协同创新中心,陕西 西安 712046)
环戊并喹啉衍生物是一类重要的含氮杂环化合物,具有广泛的生物活性。作为一种重要的活性分子骨架,环戊并喹啉衍生物已经被广泛的合成并应用于很多药物分子研究中[1-4]。其中,关于2,3-二氢-1H-环戊并[b]喹啉的合成及活性研究报道较多,如用于作为果糖-1,6-二磷酸酶抑制剂[5]、抗疟原虫活性[6]、抗肿瘤活性[7]、抗阿兹海默活性[8,9]、乙酰胆碱酯酶抑制剂[10,11]等药物分子的合成。而关于2,3-二氢-1H-环戊并[c]喹啉的研究,目前报道较少。而N-(3-异丙氧基-4-甲氧基苯基)-2-氧代环戊烷甲酰胺(1)是合成4-氯-7-异丙氧基-8-甲氧基-2,3-二氢-1H-环戊并[c]喹啉的关键中间体,化合物1在三氯氧磷中,一步反应可以制备得到4-氯-7-异丙氧基-8-甲氧基-2,3-二氢-1H-环戊并[c]喹啉。
为了研究N-(3-异丙氧基-4-甲氧基苯基)-2-氧代环戊烷甲酰胺在构筑环戊并[c]喹啉类活性分子中的应用,本研究以3-异丙氧基-4-甲氧基苯胺和1,4-二氧螺[4.4]壬烷-6-羧酸为原料,经过缩合反应、脱乙二醇保护两步反应合成得到目标化合物,产物结构经1H NMR、13C NMR和ESI-MS确证。并对两步反应及后处理的条件进行了讨论。该研究为N-(3-异丙氧基-4-甲氧基苯基)-2-氧代环戊烷甲酰胺的合成提供了一种简单可行的工艺条件。
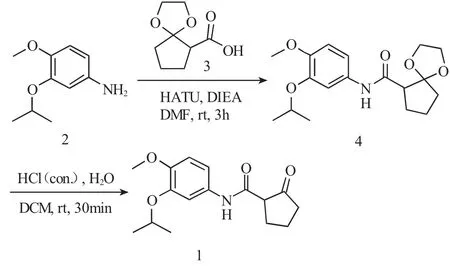
图1 目标化合物(1)的合成路线Fig.1 Synthetic route for target compound 1
1 实验部分
1.1 原料与仪器
3-异丙氧基-4-甲氧基苯胺、2-(7-氧化苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATU)、N,N-二异丙基乙胺(DIEA),泰坦科技股份有限公司;300~400目柱层析硅胶(青岛海洋化工厂);其他所有试剂均为市售分析纯。1,4-二氧螺[4.4]壬烷-6-羧酸,按照文献方法合成[12]。
AV400型核磁共振仪(DMSO-d6为溶剂,TMS为内标德国Bruker公司);Ultima Global Spectrometer型质谱仪(ESI源美国Waters公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);SHB-Ш循环水式多用真空泵(郑州长城工贸有限公司)。
1.2 合成方法
1.2.1 N-(3-异丙氧基-4-甲氧基苯基)-1,4-二氧螺[4.4]壬烷-6-甲酰胺(4)的合成 在50mL的三口瓶中加入3-异丙氧基-4-甲氧基苯胺1.81g(10.0mmol)、N,N-二甲基甲酰胺(30mL)、1,4-二氧螺[4.4] 壬烷-6-羧酸 1.89g(11.0mmol)、DIEA 2.58g(20.0mmol)、HATU 4.56g(12.0mmol),搅拌均匀后室温反应3h。TLC监测反应结束后,体系加入饱和NaHCO3水溶液(50mL)稀释,乙酸乙酯(3×50mL)萃取,有机相经饱和食盐水洗涤、无水Na2SO4干燥、减压旋蒸得到淡黄色油状液体2.76g。粗品无需进一步纯化,直接用于下一步反应。ESI-MS(m/z)336.11[M+1]+。
1.2.2 N-(3-异丙氧基-4-甲氧基苯基)-2-氧代环戊烷甲酰胺(1)的合成 在50mL的三口瓶中加入1.68g(5.0mmol)化合物 4、二氯甲烷(30mL)、水(10mL)和浓盐酸5mL(60.0mmol),体系在室温条件下反应30min。TLC监测反应结束后,减压蒸除有机溶剂,体系加水(10mL)稀释,再缓慢加入NaOH水溶液(2mol·L-1),调节至中性(pH 值为 7),体系再用乙酸乙酯(3×40mL)萃取,有机相经饱和食盐水洗涤、无水硫酸钠干燥、减压旋蒸得到粗品经硅胶柱层析分离(V石油醚∶V乙酸乙酯=3∶1),得到目标产物(1)1.06g,黄色固体,收率72.6%。1H NMR(400MHz,DMSO-d6):δ 9.91(s,1H),7.33(d,J=2.4Hz,1H),7.09(dd,J=8.8,2.4Hz,1H),6.89(d,J=8.8Hz,1H),4.44(dt,J=12.2,6.1Hz,1H),3.72(s,3H),3.24(t,J=9.0Hz,1H),2.39~2.30(m,1H),2.28(dd,J=8.4,4.0Hz,1H),2.24~2.19(m,2H),2.07~1.99(m,1H),1.91~ 1.78(m,1H),1.27(s,3H),1.26(s,3H);13C NMR(100 MHz,DMSO-d6):δ 215.35,167.45,146.92,146.56,132.94,113.00,112.04,108.35,80.59,71.00,56.44,56.18,38.57,27.33,22.37,21.05。 ESI-MS(m/z)292.20[M+1]+。
2 结果与讨论
2.1 缩合反应讨论
2-氧代环戊烷羧酸结构中羧酸羟基会与酮羰基发生分子内氢键作用,从而影响羧基的化学反应,例如酸胺缩合反应等。所以,将酮羰基用乙二醇保护得到化合物3,然后再与3-异丙氧基-4-甲氧基苯胺(2)发生缩合反应,反应收率会明显提高。缩合反应过程中使用HATU作为缩合剂,反应结束后用NaHCO3水溶液洗涤,反应中HATU分解产生的片段以及原料剩余物均能较好的溶解于碱性水溶液,再通过乙酸乙酯萃取,可以达到较好的分离纯化效果。因而,反应结束经过简单的后处理,得到的粗品可以无需纯化直接用于下一步反应。
2.2 脱乙二醇保护讨论
N-(3-异丙氧基-4-甲氧基苯基)-1,4-二氧螺[4.4]壬烷-6-甲酰胺(4)结构中,环己酮结构上的羰基被乙二醇保护形成缩酮形式,缩酮在盐酸溶液中可以快速的实现脱保护,合成得到目标化合物1。反应中,为了提高反应速率,盐酸含量需要大大过量。在该研究中,将盐酸用量固定为60mmol,摩尔比为化合物4的12倍。然后讨论反应温度和反应时间对产物1收率的影响。
2.2.1 反应温度对产物1收率的影响 当固定反应时间为1.0h时,反应温度对产物收率的影响见表1。

表1 反应温度对产物1收率的影响Tab.1 Effect of reaction temperature on the yield of target compound 1
当温度从0℃升高到25℃时,收率从40.3%升高到71.9%,继续升高温度到45℃(体系回流)时,收率没有明显提升。所以,确定适宜的反应温度为25℃。
2.2.2 反应时间对产物1收率的影响 当确定反应温度为25℃,通过研究反应时间对化合物1收率的影响发现(表2),当反应15min时,产物1收率为53.2%,延长反应时间为30min,收率明显提升至72.6%,当反应时间增加至45min及60min时,收率没有明显变化。所以,最终确定适宜的反应时间为30min。

表2 反应时间对产物1收率的影响Tab.2 Effect of reaction time on the yield of target compound 1
2.3 产物1核磁共振氢谱分析
对于目标化合物的1H NMR分析,δ9.91(br,1H)为酰胺结构上的 N-H;δ7.33(d,J=2.4 Hz,1H)是与异丙氧基相邻的苯环氢;δ7.09(dd,J=8.8,2.4Hz,1H)和 6.89(d,J=8.8Hz,1H)为苯环上的另外两个氢,从耦合常数可以看出两者互为邻位;δ4.44(dt,J=12.2,6.1Hz,1H)为异丙基上的次甲基;δ3.72(s,3H)为甲氧基;δ3.24(t,J=9.0Hz,1H)为环戊酮结构两个羰基α-位的次甲基,收到两个羰基吸电子效应的影响,化学位移偏向低场;δ2.39~2.30(m,1H),2.28(dd,J=8.4,4.0Hz,1H),2.24~2.19(m,2H),2.07~1.99(m,1H),1.91~1.78(m,1H)这 5 处峰均为环戊酮结构上的3个亚甲基;δ1.27(s,3H)和1.26(s,3H)分别为异丙基上的两个甲基。
3 结论
本文报道N-(3-异丙氧基-4-甲氧基苯基)-2-氧代环戊烷甲酰胺的合成,以3-异丙氧基-4-甲氧基苯胺和1,4-二氧螺[4.4]壬烷-6-羧酸为原料,经过缩合反应、脱乙二醇保护两步反应合成得到目标化合物,产物结构经1H NMR、13C NMR和ESI-MS确证。并对两步反应条件进行了讨论。缩合反应结束后经过简单洗涤,无需进一步纯化。确定脱乙二醇保护过程中,反应温度25℃,反应时间30min。该研究为N-(3-异丙氧基-4-甲氧基苯基)-2-氧代环戊烷甲酰胺的合成提供了一种简单可行的工艺条件。
