阶梯式降温对半短程硝化效能及菌群结构的影响
2020-06-29李柏林夭开芳
王 伟,李柏林①,汪 月,王 恒,李 晔,夭开芳,黄 馨
(1.武汉理工大学资源与环境工程学院,湖北 武汉 430070;2.矿物资源加工与环境湖北省重点实验室,湖北 武汉 430070)
氮是诱发水体富营养化的重要因子,为弥补传统生物脱氮工艺的不足,新型脱氮技术引起广泛关注[1]。其中短程硝化-厌氧氨氧化工艺因对低碳氮比、高浓度氨氮废水具有良好的处理效果,且能节省碳源与能源而成为研究热点[2]。目前高温下(>30 ℃)维持短程硝化的稳定运行已得到中外学者的一致认可,而低温条件下短程硝化能否维持稳定尚存在争议[3]。傅金祥等[4]研究发现在温度为20 ℃,pH值在7.5以上时,NO2--N积累率(NAR)基本维持在51%以上,继续下降后短程硝化遭到破坏。荣宏伟等[5]研究了低温对短程硝化的影响,发现15 ℃条件下NH4+-N去除率(NRR)为65.4%,NAR为62.1%。郭安等[6]研究得出,当温度由18 ℃逐渐降至10 ℃并长期维持在较低温度下可以培养出具有良好物化特性的短程硝化污泥。然而实际城市污水水温较低(10~25 ℃),且NH4+-N浓度也处于较低水平,如何实现中低温低氨氮条件下短程硝化系统的稳定运行是目前亟待解决的问题。同时短程硝化-厌氧氨氧化工艺的实现依赖于对前半段短程硝化出水的控制,使其能满足后半段厌氧氨氧化的进水要求(NO2--N/NH4+-N比值在1.32左右),即可维持半短程硝化状态。为了促进半亚硝化短程反应的顺利进行,对系统中硝化细菌的分析和研究也极其重要[7]。出水水质与废水中的优势菌群息息相关,所以研究工艺运行过程中微生物的变化尤为重要。作为新型微生物种群鉴定技术,高通量测序技术具有分析结果准确、高速、高灵敏度和高自动化等特点,在环境微生物鉴定领域应用广泛,也越来越多地被应用于短程硝化工艺的微生物群落结构分析中[8]。基于此,笔者先在高温下快速启动短程硝化,随后调控出水NO2--N/NH4+-N比值为1.32左右,实现半短程硝化,然后运用阶梯式降温方式观察半短程硝化在中低温下的运行状态,并探究降温过程中功能菌群落结构的变化,以期为中低温下半短程硝化调控策略及其功能菌群落结构分析提供依据。
1 材料与方法
1.1 实验装置
实验装置采用有机玻璃制成的圆柱形SBR反应器。如图1所示,装置高40 cm,直径15 cm,有效体积6 L,周期排水比为0.5,曝气方式为鼓风曝气,并通过循环水浴对水浴层进行温度控制,为反应器内部活性污泥提供稳定的温度环境。
1.2 接种污泥及实验用水
实验接种污泥取自武汉市汤逊湖污水处理厂,污泥ρ(MLSS)为5.3 g·L-1。实验进水为人工配置的无机低氨氮废水,用水水质如下:ρ(NH4Cl)为(230±5) mg·L-1,ρ(NH4+-N)为(60±5) mg·L-1,ρ(KH2PO4)为25 mg·L-1,ρ(NaHCO3)为1 000 mg·L-1,微量元素Ⅰ、Ⅱ分别为1 mL·L-1[9]。
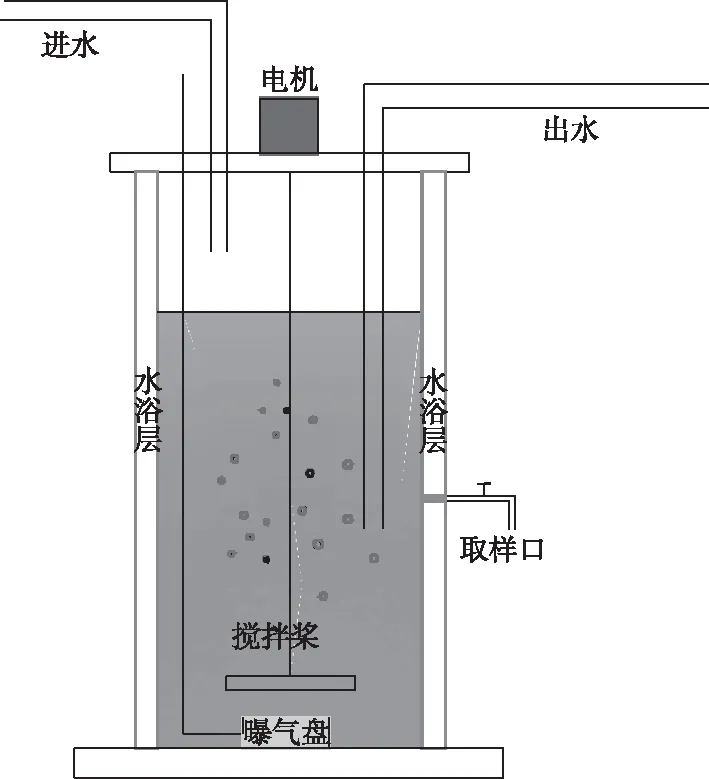
图1 短程硝化SBR反应器
1.3 实验方案
实验主要分为3个阶段:短程硝化启动、半短程硝化调控及降温阶段(28 ℃→25 ℃→20 ℃→15 ℃)。先通过调控DO浓度、pH值、游离氨(FA)浓度等运行参数来实现短程硝化快速启动。启动阶段为充分激发氨氧化菌(AOB)活性,促进NO2--N的积累,控制ρ(DO)为1.2~1.5 mg·L-1,进水pH值为7.6~7.7。调控阶段降低ρ(DO)为0.8~1.0 mg·L-1,使出水NO2--N/NH4+-N比值稳定在1.32左右。然后通过设置4个降温梯度,实现中低温下系统的稳定运行。运行周期设定如下:进水5 min,曝气90~120 min,沉淀15 min,排水5 min,静置5 min。不同阶段的具体运行条件见表1。
1.4 分析及测试方法
1.4.1常规指标检测方法
水质指标的测定均采用国家标准方法[10],NH4+-N、NO2--N、NO3--N浓度分别采用纳氏试剂分光光度法、N-(1-萘基)-乙二胺分光光度法和麝香草酚分光光度法测定;DO浓度、pH值和温度通过Hach便携仪表测定,MLSS采用重量法测定。FA浓度按式(1)[11]计算:
(1)
式(1)中,ρFA为FA质量浓度,mg·L-1;ρNH4+-N为NH4+-N质量浓度,mg·L-1;T为温度,℃。
1.4.2高通量测序
取反应器污泥,采用Power Soil试剂盒提取DNA,以w=1%的琼脂糖凝胶电泳检测。然后扩增细菌V3~V4区域16S rDNA基因的引物融合hiSEQ测序平台的通用引物,采用515F/909对PCR产物进行琼脂糖凝胶(w=2%)电泳检测,回收DNA,定量检测PCR产物,之后按样品的测序量比例混合,进行16S rDNA测序[12]。hiSEQ测序、序列拼接及OUT分类由上海生工股份有限公司完成。
表1 反应器运行工况
Table 1 Operational conditions of the reactor
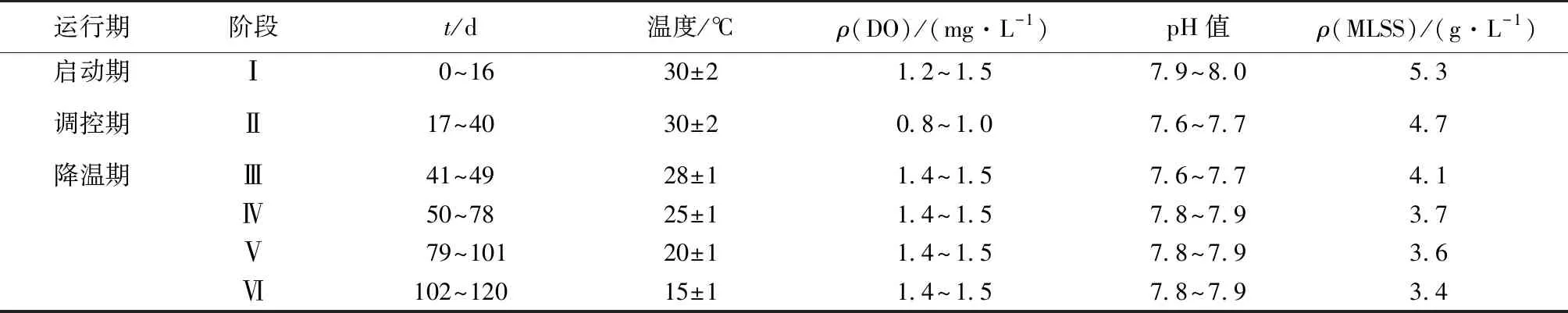
运行期阶段t/d温度/℃ρ(DO)/(mg·L-1)pH值ρ(MLSS)/(g·L-1)启动期Ⅰ0~1630±21.2~1.57.9~8.05.3调控期Ⅱ17~4030±20.8~1.07.6~7.74.7降温期Ⅲ41~4928±11.4~1.57.6~7.74.1Ⅳ50~7825±11.4~1.57.8~7.93.7Ⅴ79~10120±11.4~1.57.8~7.93.6Ⅵ102~12015±11.4~1.57.8~7.93.4
Ⅰ表示启动期,Ⅱ表示调控期,Ⅲ表示降温期温度为28 ℃阶段,Ⅳ表示降温期温度为25 ℃阶段,Ⅴ表示降温期温度为20 ℃阶段,Ⅵ表示降温期温度为15 ℃阶段。
2 结果与分析
2.1 半短程硝化脱氮效能分析
2.1.1启动、调控阶段
短程硝化启动阶段(0~16 d)的水力停留时间(HRT)设置为3 h。启动初期DO维持在较高的水平,有利于激发AOB的活性,因此0~8 d反应器内ρ(DO)控制为1.5 mg·L-1左右。如图2所示,此阶段出水ρ(NH4+-N)维持在(14±5) mg·L-1,NRR为77.4%左右,但NAR低于18%,且出水ρ(NO3--N)在38.4 mg·L-1左右,说明此阶段大部分NH4+-N直接转化为NO3--N,为全程硝化。
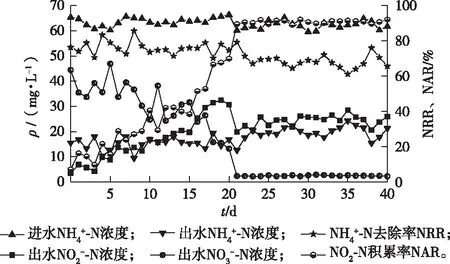
图2 启动、调控阶段氮的变化
研究表明当ρ(FA)为0.1~1.0 mg·L-1时,亚硝酸盐氧化菌(NOB)活性受到抑制,而AOB的抑制质量浓度为10~150 mg·L-1[13],第9天开始控制ρ(DO)为1.2 mg·L-1,NRR有所下降,平均NRR为75.2%,通过控制一定的NRR来提高出水的FA以抑制NOB,使出水ρ(FA)保持在0.8~1.13 mg·L-1,对NOB有一定的抑制,有利于AOB活性的提高。第16天出水ρ(NO2--N)为25.3 mg·L-1,而出水ρ(NO3--N)为23.9 mg·L-1,NAR达到52.8%,据此推断系统中的NOB开始逐步被淘汰,AOB成为优势菌,成功启动短程硝化。
经过16 d的运行,MLSS由接种时的5.3 g·L-1降为启动末期的4.7 g·L-1,但反应器内的亚硝化反应速率逐渐升高。为了保障反应器出NO2--N/NH4+-N比值满足后续厌氧氨氧化进水要求,第17天开始将曝气时间缩短为90 min,并将ρ(DO)降低至0.8~1.0 mg·L-1。AOB最适ρ(DO)为0.2~1.5 mg·L-1,而NOB的最适质量浓度为1.2~1.5 mg·L-1,AOB对氧的亲和能力大于NOB,因此在DO浓度较低情况下AOB更易富集[14]。由图2可知,出水ρ(NO3--N)在第Ⅱ阶段没有明显波动,维持在1.3 mg·L-1以下,而由于反应时间的缩短,出水ρ(NO2--N)略有下降,从30.8降至24.8 mg·L-1。使得出水NO2--N/NH4+-N比值逐渐得以优化,比值由第1天的0.22升至第20天的2.23,第24天之后稳定在1.32左右,实现半短程硝化。第Ⅱ阶段NAR一直维持在90.8%左右,说明系统内AOB丰度增加,NOB得到充分抑制,为后续阶梯式降温运行奠定了良好的基础。
2.1.2阶梯式降温阶段
半短程硝化调控优化后,在第41~120天对系统进行阶梯式降温。每个阶段梯度降温用循环水箱逐渐降温的方式,每隔1 d降低温度1 ℃,直至降到相应温度。为提升降温过程中AOB活性,将ρ(DO)提升到1.4~1.5 mg·L-1,进水pH值提升至7.8~7.9。由图3所示,在系统内温度逐渐降低的过程中,ρ(NO3--N)均维持在较低的水平(均值为4.5 mg·L-1),说明NOB丰度可能降至较低水平,DO的提升未造成NO3--N的积累。每次降温初期NAR、NRR都出现小幅波动,降温期系统内出水ρ(NO2--N)一直保持在22.8 mg·L-1左右(最高值为28.9 mg·L-1,最低值为17.2 mg·L-1)。降温阶段ρ(MLSS)由降温初期的4.0 g·L-1降至15 ℃时的3.4 g·L-1,推测是由于进水中缺乏有机碳源,且进水负荷较低,异养菌及NOB裂解衰亡所致。在降温过程中ρ(MLSS)下降缓慢,最终稳定在3.4 g·L-1左右,表明此时系统短程硝化能力逐步增加,能够抵抗低温带来的不利影响。
AOB在中低温下保持良好的活性。即使在15 ℃时,NAR均值为80.2%,呈递增状态。NRR维持在59.7%左右,半短程硝化运行稳定。中低温半短程硝化的稳定运行主要依赖于以下2点控制策略:一是在高温下实现AOB的富集,并通过调节运行参数(DO浓度、pH值、FA浓度、曝气时间等)促进AOB的富集,同时尽可能抑制NOB的生长,使AOB成为系统中的优势菌种,高温下形成稳定的半短程硝化运行状态。二是采用阶梯式降温方式驯化AOB,使其逐渐适应低温环境,避免AOB因温度剧烈变化而失活。由于温度的下降,AOB活性会有所降低,但系统内随着时间的推移丰度也逐渐增加。同时将ρ(DO)提升到1.4~1.5 mg·L-1,进水pH值提升至7.8~7.9,通过以上调控策略和方法成功实现了中低温下半短程硝化的稳定运行。
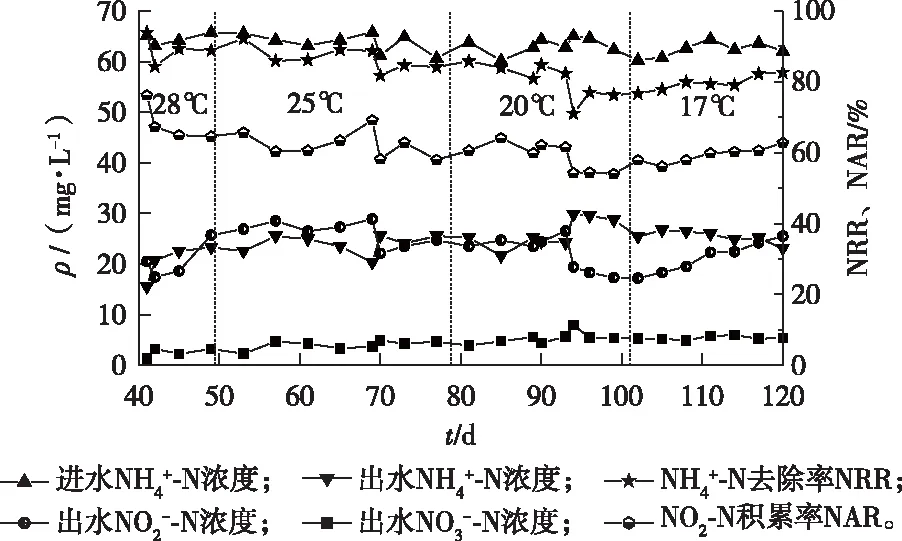
图3 阶梯式降温阶段系统内氮的变化
2.2 高通量测序结果分析
2.2.1微生物丰富度和α多样性
对接种污泥(A)、降温初始阶段温度为28 ℃(B)和降温后期温度为15 ℃(C)时的污泥样品进行高通量测序,3个污泥样品的覆盖率(coverage)指数均高于95%以上(表2),表明测序数据量合理且大量的微生物可被检出,测序结果能够全面有效地反映微生物群落结构特征。
表2 微生物群落丰富度和α多样性
Table 2 Microbial community richness and α diversity
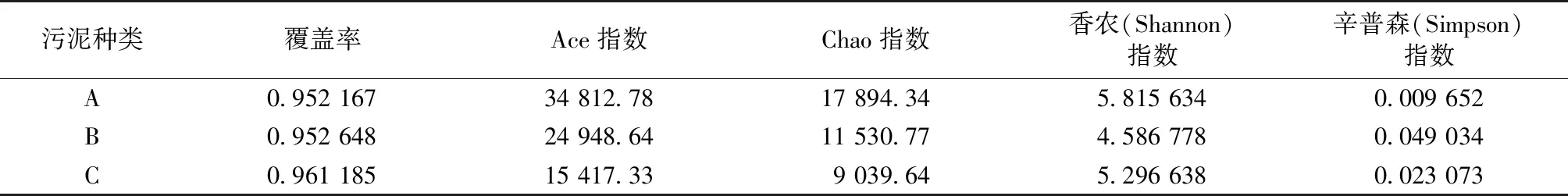
污泥种类覆盖率Ace指数Chao指数香农(Shannon)指数辛普森(Simpson)指数A0.952 16734 812.7817 894.345.815 6340.009 652B0.952 64824 948.6411 530.774.586 7780.049 034C0.961 18515 417.339 039.645.296 6380.023 073
A、B和C分别指接种污泥、接种污泥降温初始阶段温度为28 ℃和接种污泥降温后期温度为15 ℃时的污泥样品。
Ace指数和Chao指数用来估计群落中操作分类单元(OTU)数目的指数,反映微生物种群的丰富度,值越高表明微生物种群丰富度越高[15]。由表2可知,A、B、C样品群落丰富度逐渐降低,这可能是低温下微生物生长缓慢,导致微生物数量减少。香农(Shannon)指数和辛普森(Simpson)指数常用来评价微生物样品的生物多样性,香农指数越大,辛普森指数越小,说明样品生物多样性越高[16]。如表2所示,接种污泥取自污水厂好氧池,生物多样性较高,随着对污泥的驯化和定向培养,生物多样性有所降低。而C样品中群落多样性高于B,说明阶梯式降温后,为适应温度变化,生物多样性有所增加。
2.2.2主要功能菌群落结构分析
A、B、C样品中分别检测出微生物24门44纲272属、24门38纲187属和29门45纲213属。反应器内各阶段微生物种类丰富但微生物的相对丰度不同。在门水平上,短程硝化系统内变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、装甲菌门(Armatimonadetes)、绿弯菌门(Chloroflexi)是菌群结构的主要组成部分,约占总体的60%~80%(图4)。IBARBALZ等[17]研究表明,在城市污水处理厂污泥中最丰富的是变形菌门,该菌门在A、B、C污泥样品中分别占33.82%、25.38%和37.26%。大多数与脱氮有关的菌都属于Proteobacteria菌门,包括AOB中亚硝化单胞菌(Nitrosomonas)、亚硝化球菌(Nitrosococcus)和 NOB 中硝化杆菌属(Nitrobacter)、亚硝化球菌属(Nitrococcus)均属于变形菌门[18]。随着系统短程硝化反应不断驯化,装甲菌门呈逐渐减少的趋势,分别占35.14%、16.22%和6.40%,此外,在半短程硝化运行过程中,装甲菌门、绿弯菌门等明显减少。而酸杆菌门(Acidobacteria)丰度增加,说明该菌门能很好地适应低温环境。
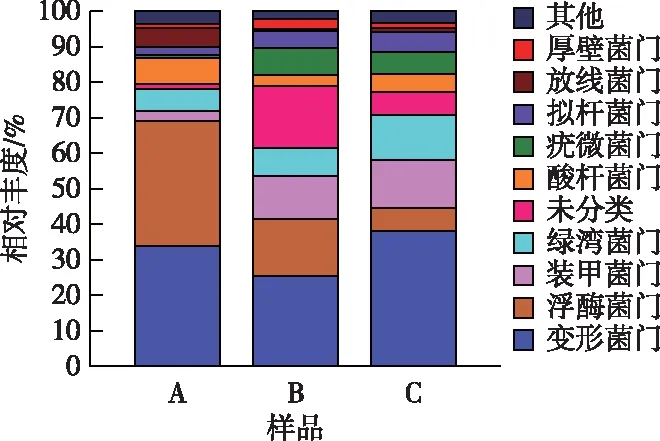
A—接种污泥样品,B—接种污泥降温初始阶段温度为28 ℃的污泥 样品,C—接种污泥降温后期温度为15 ℃时的污泥样品。
在纲水平上,A、B、C样品中丰度较大的有浮霉菌纲(Planctomycetia)、α-变形菌纲(α-phaproteobacteria)、β-变形菌纲(β-proteobacteria)。NOB主要属于α-变形菌纲、δ-变形菌纲(δ-proteobacteria)、硝化螺旋菌纲(Nitrospira)。A样品中α-变形菌纲丰度达到20.92%,B样品中α-变形菌纲降至9.83%,但在C中略有上升。而样品硝化螺旋菌纲一直处于降低状态。总体而言,NOB得到了有效的抑制。AOB主要属于β变形菌纲。由图5可知,与A样品相比,B中β-变形菌纲达10.24%,并在C样品中持续上升到13.47%,AOB不断得到富集,这也解释了为什么NAR均值在中低温下仍能稳定在83.3%左右。浮霉菌纲属于浮霉菌门,其丰度随着系统运行逐渐下降,由接种污泥的34.87%下降至C样品中的5.53%,与浮霉菌门下降幅度一致。
在属水平上,AOB相关菌属亚硝化单胞菌(Nitrosomonas)呈逐渐上升态势,从A样品中的0.09%上升至B样品的1.94%,C样品中达5.21%,说明在中低温条件下亚硝化单胞菌可以稳定生长。NOB相关菌属亚硝化螺旋菌(Nitrospira)和硝化杆菌(Nitrobacter)丰度明显减小,分别从A样品的0.90%和0.98%逐渐下降到C样品中的0.33%和0.05%。NOB在系统运行过程得到充分抑制,使运行过程中出水NO3--N浓度处于较低状态,保证了中低温下系统的稳定运行。Candidatuskuenenia是厌氧氨氧化(AAOB)菌属,在B样品中突升至10.82%(图6),此阶段DO浓度较低,为AAOB的生长提供了条件。该菌种可能消耗了部分NH4+-N和NO2--N,导致28 ℃下NAR比30 ℃下有所降低,而NRR有所提升。通过提升ρ(DO)为1.4~1.5 mg·L-1,C样品中Candidatuskuenenia下降到0.60%。
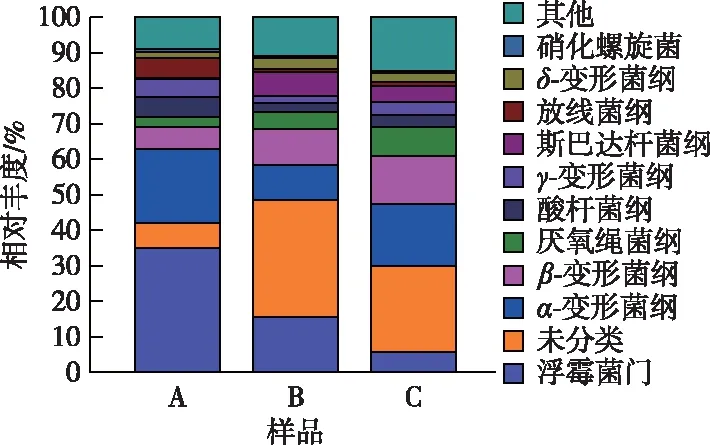
A—接种污泥样品,B—接种污泥降温初始阶段温度为28 ℃的污泥 样品,C—接种污泥降温后期温度为15 ℃时的污泥样品。
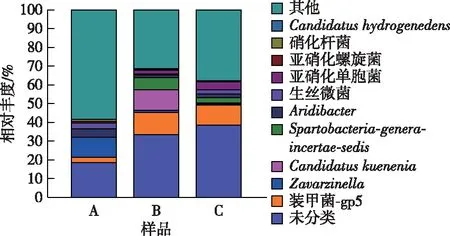
A—接种污泥样品,B—接种污泥降温初始阶段温度为28 ℃的污泥 样品,C—接种污泥降温后期温度为15 ℃时的污泥样品。
3 结论
(1)进水ρ(NH4+-N)为(60±5) mg·L-1,控制系统ρ(DO)为1.2~1.5 mg·L-1,pH值为7.9~8.0,温度为(30±2)℃,可抑制NOB活性,第16天NAR达到52.8%,成功启动短程硝化。
(2)通过阶梯式降温(28 ℃→25 ℃→20 ℃→15 ℃)逐步驯化AOB,并将ρ(DO)提升到1.4~1.5 mg·L-1,进水pH值提升至7.8~7.9,强化中低温条件下AOB的硝化性能。即使在15 ℃条件下,反应器NRR均值维持在59.7%左右,NAR达80.2%,系统在中低温下运行稳定。
(3)采用16S rDNA高通量测序分析培养前后(接种污泥、28 ℃、15 ℃)系统中污泥的菌群结构,发现随着系统运行的逐步稳定,亚硝化单胞菌呈逐渐上升态势,从接种污泥中的0.09%上升至28 ℃下的1.94%,在15 ℃下已达5.21%,成为AOB优势菌属。而亚硝化螺旋菌和硝化杆菌丰度明显减小,分别由接种污泥的0.90%和0.98%下降到15 ℃下的0.33%和0.05%,NOB得到充分抑制。
