基于高通量测序对南极菲尔德斯半岛土壤微生物多样性的初步研究
2020-06-25李桂秀宋易洋王国良
李桂秀,宋易洋,赵 芯,王国良
(1.烟台大学生命科学学院,山东 烟台 264005;2.北京市农林科学院北京农业生物技术研究中心,北京 100097)
南极大陆是世界上最晚被发现的大陆,也是世界上居住人口最少的大陆。南极大陆位于地球的最南端,气候恶劣,营养匮乏,不利于生物的生存。但是这种极端环境下生长的生物具有耐低温、耐高盐、抗辐射等特点[1],有别于其他大陆的生物,因而具有广泛的研究意义[2]。南极土壤经过长时间的积累与沉积,成为了微生物生存的栖息地。这些微生物往往具有适应其特殊环境的形态学、生理学上的特异性[3],为微生物学注入新的思路和方向。与其他大陆相比,南极大陆的环境较为封闭,受人类改造较少,从而微生物群落更为原始,受人类活动的影响也较少[4-5],因此研究南极土壤微生物不仅可以为开发利用微生物资源提供重要的理论依据[6],还可以为生命的起源和进化提供重要的线索[7]。
目前世界上仅有1%的微生物可以用纯培养的方式获得,剩余99%的微生物难以用传统方法进行研究[8]。随着高通量测序技术的普及和宏基因组学研究技术的发展,人们逐渐揭开了环境微生物世界的神秘面纱[9]。宏基因组是指整个环境中所含有的遗传物质的总和[10]。宏基因组学技术的发展克服了大部分微生物难以培养的难题,通过直接获取环境中所有微生物的遗传信息并进行生物信息学分析,研究环境中微生物的多样性,了解微生物的群体结构和生态功能[11-12]。
本研究以中国第31次南极科学考察采自菲尔德斯半岛3个站点的土壤样本为研究对象,对其进行宏基因组DNA(gDNA)提取,用高通量测序和生物信息学技术对其进行测序分析,初步揭示了南极土壤微生物的多样性,为后续南极土壤新物种的发现和功能基因的挖掘提供实验依据。
1 材料与方法
1.1 样本采集与处理
实验中采用的样本来自中国第31次南极科学考察(2014-10-30出发),取样地点为菲尔德斯半岛。3个取样点分别涵盖了苔藓植物、雪缝水和山坡区域,采样时用无菌铲取距离表层约5~10 cm深度的土壤样本,每个采样点取3份重复混合而成,去除可见根,混合后放到无菌密封塑料袋中低温保存。所有样本低温条件运输至国内,长期以-80℃温度条件储存于中国科学院北京基因组研究所(表1)。
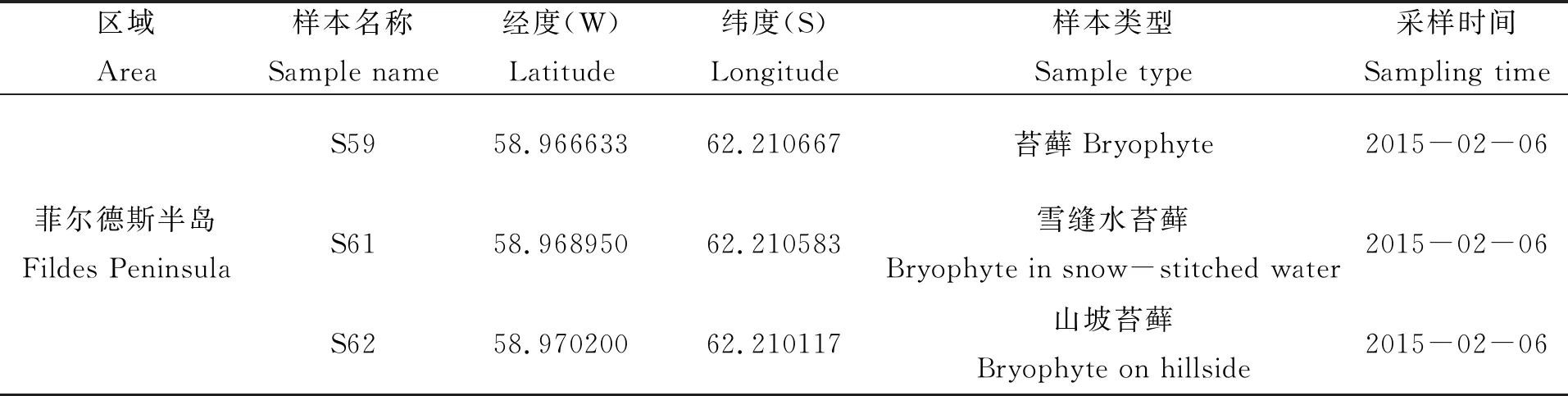
表1 3例南极土壤样本位点信息
1.2 宏基因组DNA提取
3例南极土壤样本使用电子天平各称取0.1 g,用基因组提取试剂盒(江苏康为世纪,CW2091S)进行宏基因组DNA(gDNA)提取。采用NanoDrop微量分光光度计和琼脂糖凝胶电泳检测DNA的纯度和完整性,用Qubit dsDNA HS试剂盒(Invitrogen,Q32854)检测DNA浓度,达到实验要求的gDNA存于-20℃,以备建库。
1.3 宏基因组文库构建和高通量测序
根据Qubit检测的浓度,取10 ng gDNA起始建库,利用自动聚焦声波基因组剪切仪Covaris M220将gDNA打断成200 bp左右的片段后,使用1.8×DNA纯化磁珠(Vazyme,N411)对片段化产物进行纯化,用通用DNA文库构建试剂盒(Vazyme,ND607)进行文库构建。文库使用全自动核酸分析系统Qsep100和荧光定量PCR仪(BioRad,CFX96)分别进行片段分布和浓度测定。检测合格的文库送往北京贝瑞和康生物技术有限公司进行测序,测序平台为Illumina NovaSeq 6000,测序策略是Paired-end 150。
1.4 数据处理
首先用FastQC对下机数据进行质量评估,生成质检报告,根据质检报告用Trimmomatic[13]选择过滤标准对数据进行修剪过滤,以去除接头和低质量碱基等。然后用MetaPhlAn2[14]对处理过的数据进行分析,基于参考数据库比对快速实现序列的物种分类[15],获取环境中微生物的丰度和群落结构[16]。GraPhlAn[17]是一种用于生成分类和系统发育树的综合可视化工具,利用这个软件对微生物群落数据进行可视化,构建物种群落结构图。
2 实验结果
2.1 基因组DNA提取和文库构建
电泳检测如图1所示,主带完整性较好,轻微降解,无明显杂带。NanoDrop测定样本吸光值A260/A280(表2)均分布于1.8~2.0之间,说明纯度符合实验要求。根据Qubit检测结果(表2),样本量可以满足2次及以上的建库需求。

表2 NanoDrop和Qubit检测gDNA质量结果
注:M表示Super DNA Marker(江苏康为世纪,CW2583),59、61、62分别表示样本S59、S61、S62。
Notes:M represented Super DNA Marker(CWBIO,Jiangsu,CW2583).59,61 and 62 represented samples S59,S61 and S62,respectively.
Qsep100以电泳峰图和凝胶电泳图展示宏基因组文库片段分布(图2),结果显示文库分布于300~500 bp范围内,峰值集中在400 bp左右,无接头和引物二聚体等小片段,文库质量符合上机测序要求。
注:图a、b、c分别代表样本S59、S61、S62,上半部分是电泳峰图,下半部分是凝胶电泳图。
Notes:Figures a,b and c represented samples S59,S61 and S62,respectively,with the upper half being the electrophoresis peak map and the lower half being the gel electropherogram.
2.2 数据质控
先用FastQC对从测序公司返回的下机数据进行质控,下机数据与质控的详细信息见表3。原始数据中会包含接头信息、低质量碱基、未测出的碱基等,这些数据会对后续信息分析造成干扰,因而在分析之前会用Trimmomatic按照一定的过滤标准对其进行过滤清除,获得有效数据,即Clean reads,用于后续生物多样性分析。
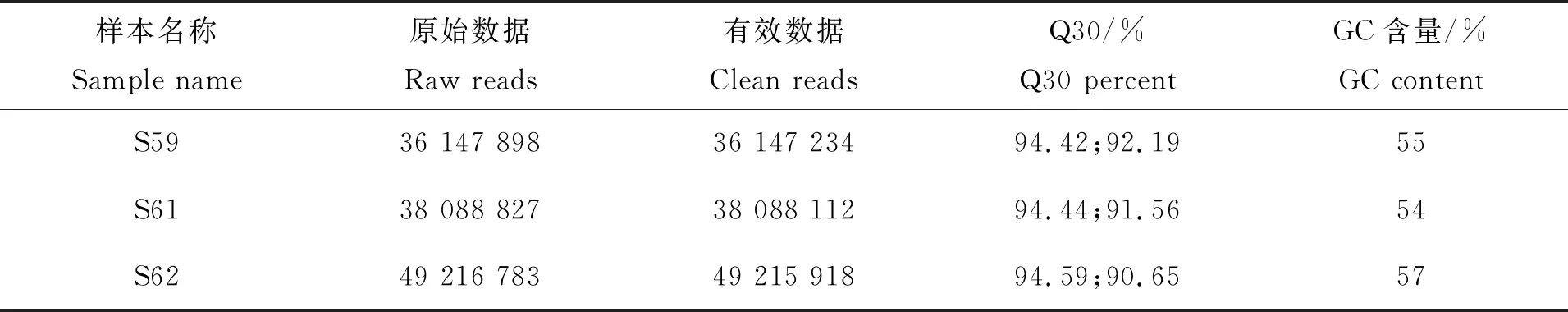
表3 质控统计结果
2.3 生物丰度分析
根据获得的物种丰度表(表4)、韦恩图(图3)和相对丰度热图(图4),分析了3例样本不同水平上的优势菌群。由图4看出,样本S59、S61、S62均有明显的红色和黄色区域,这说明这些红色和黄色区域所覆盖的细菌数量相对较大,且均具有不同的黑色区域,表明样本间的差异性较大。其中,S61样本中细菌丰度较大,优势菌群是假单胞杆菌属(Pseudomonas),与S59和S62样本相比,具有的特殊菌种是深蓝紫色杆菌(Janthinobacteriumlividum)、威隆假单胞菌(Pseudomonasveronii)和雷尔氏菌属(Ralstonia);S59样本中的细菌和真菌的丰度各占59.83%和39.92%,细菌优势菌种是曼德氏假单胞菌(Pseudomonasmandelii),特殊菌群是游动放线菌属(Actinoplanes),真菌优势菌种是白色念珠菌(Candidaalbicans);S62真菌的丰度略高,约58.13%,其中真菌优势菌种和S59一致,细菌的优势菌群是假单胞菌属(Pseudomonas),无特殊菌群。
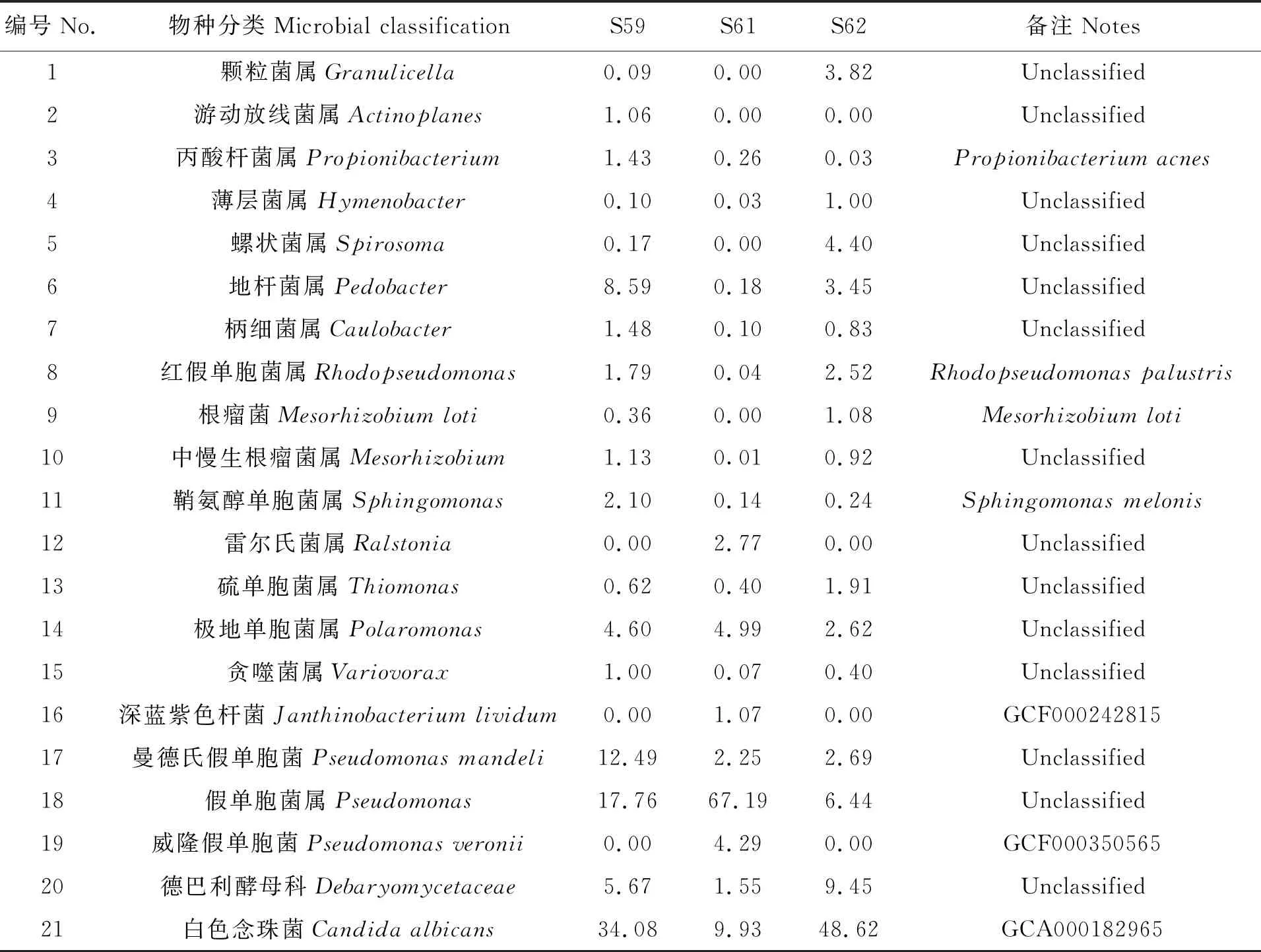
表4 3例南极土壤样本微生物丰度表
注:第3~5列表示三个样本中不同物种的相对丰度,单位是%;Unclassified表示没有具体的物种分类或对应的编号。
Notes:Columns 3~5 represented the relative abundance of different species in the three samples,the unit was %;Unclassified meant there was no specific species classification or corresponding number.
注:X轴:上侧表明样本的系统发育关系,下侧表明样本号;Y轴:左侧展示物种的系统发育关系,右侧是物种名称;方形网格中的颜色强度表示微生物相对丰度,由黄到黑表示丰度由高到低。
Notes:The heatmap indicated the relative abundance of each genus in different samples.The X-axis clustering indicated the phylogenetic relationships of these samples(upper side)and samples name(under side),the Y-axis clustering exhibited the variables and phylogenetic relationships of each bacterial species in different samples(left side)and species name(right side).The color intensity in the square grid represented the relative abundance of species.From yellow to black,the abundance was high to low.
2.4 物种群落结构分析
GraPhlAn软件选取前100个最丰富的进化枝构成的物种群落结构图(图5)中,从内而外依次表示界门纲目科属种,整个生物群落细菌的多样性很高,有8个门14个纲21个目32个科48个属,丰度大于1%的(即图5中颜色标注的区域)分别是酸杆菌目(Acidobacteriales)、放线菌目(Actinomycetales)、伯克氏菌目(Burkholderiales)、柄杆菌目(Caulobacterales)、嗜纤维菌目(Cytophagales)、嗜甲基菌目(Methylophilales)、颤藻目(Oscillatoriales)、假单胞菌目(Pseudomonadales)、根瘤菌目(Rhizobiales)、酵母目(Saccharomycetales)、鞘脂杆菌目(Sphingobacteriales)、鞘脂单胞菌目(Sphingomonadales);节点越大,丰度越高,由此可以看出物种的丰度差异明显,其中假单胞菌目(Pseudomonadales)和酵母目(Saccharomycetales)的物种丰度最高。
注:不同颜色表示不同的目分类,见右侧图例;字母所代表的具体物种或者属,在左侧的图例中标出。A:颗粒菌属;B:游动放线菌属;C:痤疮丙酸杆菌;D:噬纤维菌属;E:薄层菌属;F:螺状菌属;G:地杆菌属;H:微鞘藻属;I:短波单胞菌属;J:柄细菌属;K:沼泽红假单胞菌;L:红假单胞菌属;M:根瘤菌;N:中慢生根瘤菌属;O:鞘氨醇单胞菌;P:雷尔氏菌属;Q:硫单胞菌属;R:极地单胞菌属;S:贪噬菌属;T:深蓝紫色杆菌;U:紫色杆菌属;V:曼德氏假单胞菌;W:假单胞菌属;X:威隆假单胞菌;Y:白色念珠球菌。
Notes:The dots on the cladogram represented the specific bacterial taxa whose colors were the same as those of the corresponding orders.The size of dots was proportional to the relative abundance.A:Granulicella;B:Actinoplanes;C:Propionibacteriumacnes;D:Cytophaga;E:Hymenobacter;F:Spirosoma;G:Pedobacter;H:Microcoleus;I:Brevundimonas;J:Caulobacter;K:Rhodopseudomonaspalustris;L:Rhodopseudomonas;M:Mesorhizobiumloti;N:Mesorhizobium;O:Sphingomonasmelonis;P:Ralstonia;Q:Thiomonas;R:Polaromonas;S:Variovorax;T:Janthinobacteriumlividum;U:Janthinobacterium;V:Pseudomonasmandelii;W:Pseudomonas;X:Pseudomonasveronii;Y:Candidaalbicans.
3 讨论
本研究通过对中国第31次南极科学考察采自菲尔德斯半岛3个站点的南极土壤样本提取的宏基因组进行建库测序,对测序数据进行生物信息学分析,获得了南极土壤中丰富的微生物种群数据信息,为分离培养新菌种、获取生物活性物质和筛选功能基因等提供了信息资源。
16S rRNA在研究环境微生物多样性上应用广泛[18],但是对16S测序结果进行分析仅能确定物种至属[19],因此只能在门、纲、目、科、属这些级别进行微生物群落进化和种属亲缘关系分析,而对宏基因组的高通量测序可以进一步确定至种名,并且覆盖更多的功能基因区域。MetaPhlAn2是基于数据库进行比对获取生物物种信息的,但本次数据分析发现,很多物种并没有鉴定到种,而只是鉴定到属,这可能是因为南极土壤中存在的大部分物种是未经开发和研究的,数据库中并不存在此物种的基因序列,只能根据基因序列的相似性鉴定到相关属。这也侧面反映了南极土壤中微生物多样性高,新物种存在概率大,南极土壤将成为未来新物种开发和研究的热点。
本研究用MetaPhlAn2分析得出的优势菌群是假单胞菌属,这与刘春影等[20]探索南极可培养土壤微生物的多样性结果一致。与张丽珉等[21]的研究略有差异,他们发现南极罗斯海区域中嗜冷杆菌属(Psychrobacter)为优势细菌类群,枝孢属(Cladosporium)为优势真菌类群,这说明南极土壤微生物具有区域差异性。实验结果中的极地单胞菌属(Polaromonas)是构成冰川微生物群系的重要部分,已经有研究发现极地单胞菌属的一些质粒可以帮助宿主适应极地地区的恶劣条件[22],比如低温,可以将该微生物的功能基因和低温酶等投入工厂生产和实际应用。
本研究系统地介绍了南极土壤微生物种群的多样性,详细阐述了各个样本的优势菌群和特殊菌群,初步了解了南极土壤微生物的群落结构和物种丰度。后期会结合二代高通量测序技术与三代长分子测序技术[23],深入挖掘南极土壤微生物的潜在价值,比如筛选功能基因簇;同时结合宏转录组[24]数据分析,研究微生物群落的动态结构以及其适应南极环境的作用机制等。
