联苯菊酯对菲律宾蛤仔肝胰腺细胞DNA损伤的初探
2020-06-24陈宇锋许贻斌姜双城郑惠东
陈宇锋,许贻斌,刘 波,姜双城,郑惠东
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
联苯菊酯(Bifenthrin,BF)是一种合成、高效的拟除虫菊酯杀虫、杀螨剂[1],因具有杀虫谱广、作用迅速,低毒等特点而被广泛应用于农作物病虫害防治[2]。但联苯菊酯具有强大的亲脂性,对光和热稳定,残效期长,在其高效杀虫的同时,残留的联苯菊酯随着雨水、地表径流等途径进入海洋,也导致了近海海域海洋环境日益严重的污染问题[3]。研究表明:在美国加利福尼亚北部海域[4]、厦门西海岸及九龙江河口水体和沉积物中均有检出微量的联苯菊酯等农药残留[5]。虽然联苯菊酯等拟除虫菊酯类农药对哺乳动物、鸟类毒性较低,但对鱼、贝和甲壳类等水生生物毒性较大[6-9],并且具有一定的生物富集能力[10],引发人们对该类农药潜在的基因遗传毒性方面的关注。
单细胞凝胶电泳(Single cell gel eletrophoresis,SCGE)又称彗星实验(Comet assay),是一种在单细胞水平上检测DNA单链或双链断裂的实验方法[11]。其主要技术原理为:当细胞DNA损伤越严重时,断链的迁移率越大,经荧光染色后,在荧光显微镜下形成彗星状的电泳图谱[12]。根据电泳缓冲液的pH值不同,可分为中性彗星实验(pH=8.4)和碱性彗星实验(pH>13.0)。碱性彗星实验具有更高的灵敏性,不仅可以检测少量的单链和双链断裂损伤,还可将碱性不稳定点(Alkali-labile sites,ALS)转化为DNA断裂进行检测[13-14]。由于彗星实验简便、快速、灵敏度高、所需细胞少而成为评估DNA损伤的有效工具,并被广泛应用于遗传毒性、环境监测、氧化应激及细胞凋亡等方面,研究对象以哺乳动物居多,在血细胞、淋巴细胞、肝肾等脏器细胞、生殖细胞等方面开展研究[15-16]。在对水生生物研究中,彗星实验检测技术也开始被应用在检测鱼类血细胞[17]和肝胰脏细胞[18]、甲壳类肝胰腺细胞[19]、贝类血淋巴细胞[20]和消化腺细胞[21]等方面。
菲律宾蛤仔(Ruditapesphilippinarum)是一种分布广泛的滩涂贝类,是我国沿海地区重要的养殖贝类之一,具有很高的经济价值。菲律宾蛤仔生活在潮间带或近岸浅海,对海洋环境中的有机污染物有很强的生物富集效应[22],同时肝胰腺也是贝类的主要食物消化部位和解毒部位。目前对联苯菊酯潜在的基因遗传毒性知之甚少,特别是其对菲律宾蛤仔肝胰腺细胞DNA损伤的研究未见报道。本研究以水产养殖贝类菲律宾蛤仔为实验对象,采用单细胞凝胶电泳技术探讨了联苯菊酯暴露对菲律宾蛤仔体内肝胰腺细胞DNA的损伤作用,旨在为联苯菊酯的遗传毒性评价和安全评估提供必要的参考数据,也为合理使用联苯菊酯提供科学依据。
1 材料与方法
1.1 试剂与仪器
联苯菊酯为江苏皇马农化有限公司产品,有效成分含量为25 g/L;低熔点琼脂糖(LMA)、10×细胞裂解液(0.1 mol/L Tris、10% 肌氨酸钠、10% Triton X-100)、EDTA溶液(0.5 mol/L)、绿色荧光DNA染色剂为美国CELL BIOLABS公司产品;台盼蓝染色试剂盒、Tris·HCl缓冲液(0.05 mol/L)购自生工生物工程(上海)股份有限公司;磷酸一氢钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、磷酸二氢钾(KH2PO4)、氯化钠(NaCl)、钾化钠(KCl)、氢氧化钠(NaOH)均为国产分析纯试剂,由西陇科学股份有限公司生产。
实验用玻片为美国CELL BIOLABS公司产品;超净工作台为苏州智净净化设备有限公司的SW-CJ-1D型;台面式pH/ISE测试仪为美国Orion公司的MODEL 828型;电热恒温水浴锅为上海精宏公司的DK-500S型;电泳仪为美国Thermo公司的EC250-90型;全自动雪花制冰机为上海坤科仪器设备有限公司的IMS-20型;高压灭菌器为美国Zealway公司的GR60DA型;水平电泳槽为北京君意公司的JY-SP-E型;荧光显微镜为德国Leica公司的DM5500B型。
1.2 实验材料
菲律宾蛤仔购自福建省海水鱼类苗种繁育科研中试基地(漳州招商局开发区)附近水产批发市场,在科研基地的水泥池中暂养7 d,每天固定时间定量投喂微藻一次。挑选健康无病、外形完整且规格相当的菲律宾蛤仔作为实验用贝,平均壳长(28.5±3.9)mm,平均体质量(12.6±2.1)g。
1.3 实验用水
实验用水为沙滤海水,pH为(8.1±0.3)、水温(20.2±0.5)℃、盐度(30.5±0.3)。实验期间,为确保联苯菊酯暴露浓度的稳定,采取每日全部更换实验用水的方法。在实验过程中保持微充气,确保溶解氧DO大于5 mg/L。
1.4 亚急性毒性实验方法
根据预实验结果,分为5个处理组进行实验,分别设置为0(空白对照组)、0.05、0.10、0.15、0.20 mg/L,每组50粒菲律宾蛤仔,实验周期为25 d,实验处理组各设置3个平行。
1.5 细胞悬液制备
亚急性毒性实验进行25 d后,各实验处理组挑取存活的菲律宾蛤仔10粒,取其剪碎混匀后的肝胰腺组织0.2 g置于1.5 mL灭菌离心管中,加入4℃预冷的0.01 mol/L PBS缓冲液(含0.02 mol/L EDTA)1.0 mL,冰浴静置5 min后转入新的离心管,3 000 r/min 离心2 min后弃上清液,用4℃预冷的0.01 mol/L PBS 缓冲液重悬细胞,通过台盼蓝染色剂染色5 min后镜检细胞活性,用预冷的PBS缓冲液调节细胞浓度为1×105个/mL,置于4℃冰箱中避光备用。
1.6 彗星实验方法
按照CELL BIOLABS公司的彗星分析试剂盒实验步骤进行单细胞凝胶电泳分析。
制片:将试剂盒内的低熔点琼脂糖凝胶取出,放置于90~95℃水浴锅内加热20 min,使之溶解后取100 μL凝胶分装至200 μL灭菌PCR管,再置于37℃水浴锅中冷却,备用。吸取细胞悬液与低熔点琼脂糖凝胶按1∶10比例混合,取75 μL混合液均匀铺于载玻片上,放置于4℃避光凝固15 min。
裂解:将载玻片浸没于4℃预冷的细胞裂解液(2.5 mol/L NaCl、0.1 mol/L EDTA、0.01 mol/L Tris、1%肌氨酸钠、1% Triton X-100,pH=10.0)中,置于4℃冰箱内避光裂解60 min。
解旋裂解后,载玻片经超纯水漂洗后,放入电泳槽中,缓慢倒入4℃预冷的碱性电泳缓冲液(0.3 mol/L NaOH、1 mmol/L EDTA,pH>13.0)中,置于4℃冰箱避光解旋30 min。
电泳:往水平电泳槽内缓慢倒入4℃预冷的碱性电泳缓冲液,使其没过载玻片胶面2~3 mm,在电压1 V/cm、电流300 mA的条件下电泳20 min。
染色:电泳结束后,用预冷、灭菌的超纯水浸泡移出的载玻片2 min,并反复冲洗两次,以便洗去多余的碱液,再用70%酒精浸泡固化5 min。将玻片取出避光控干,加入100 μL绿色荧光DNA染料,室温避光染色15 min。
1.7 图像分析和数据处理
在荧光显微镜下观察玻片,并进行显微摄影,应用彗星分析软件Comet Score 1.5 进行分析,各实验处理组随机选择30个细胞进行拍照观察和数据分析,选择平均彗星尾长、拖尾率、彗尾DNA相对含量、尾矩和Olive矩等参数来评价菲律宾蛤仔肝胰腺细胞DNA的损伤程度。其中拖尾率=拖尾细胞数/观察细胞数×100%、彗尾DNA相对含量=尾部DNA含量/细胞总DNA含量×100%、尾矩=尾长×彗尾DNA相对含量×100%、Olive矩=头尾部中心间距×彗尾DNA相对含量×100%。彗星实验数据结果以平均值±标准差(Means±SD)表示,应用Excel软件及SPSS 18.0软件对所获得的数据进行单因素方差分析(One-way ANOVA),检验各浓度组与对照组之间显著性差异并进行回归方程和相关性分析。
2 结果
2.1 联苯菊酯对菲律宾蛤仔肝胰腺细胞DNA的影响
经过荧光染料染色后,各实验处理组随机采集30个细胞,在荧光显微镜下观察并进行统计分析。由图1可见,空白对照组菲律宾蛤仔的肝胰腺细胞DNA结构完整,细胞核大小均一,经荧光染色后呈现圆形状的荧光团,荧光强度均匀,无明显的拖尾现象;0.05 mg/L和0.10 mg/L处理组菲律宾蛤仔的肝胰腺细胞核中呈现一个荧光亮点,周围边缘模糊,表明细胞DNA开始出现解体,呈松散状态,出现一定的拖尾现象;而0.15 mg/L和0.20 mg/L处理组菲律宾蛤仔的肝胰腺细胞损伤的DNA断裂碎片在电场中离开核DNA,向同一个方向(阳极)迁移,经染色后形成彗星状拖尾。随着暴露浓度的增加,细胞核DNA损伤越严重,断裂的碎片或碱变性片段越多,彗星尾长相应增加,尾部荧光强度也相应增强。从表1检测指标可见:空白对照组DNA细胞受损较少,细胞拖尾率仅为(6.33±1.05)%,彗尾DNA相对含量、尾矩和Olive矩都接近0;其余各实验处理组的彗星尾长、拖尾率、彗尾DNA相对含量、尾矩和Olive矩随着暴露浓度的增加而不断增加,呈现一定的剂量效应关系。0.05~0.20 mg/L处理组与空白对照组相比,菲律宾蛤仔肝胰腺细胞DNA均有不同程度的损伤且各检测指标值均显著增加(P<0.05),其中0.20 mg/L处理组的各检测指标又显著高于其他检测处理组(P<0.05),表明菲律宾蛤仔体内肝胰腺细胞对联苯菊酯毒性存在较为敏感的阈值范围。
注:a.空白对照组;b.0.05 mg/L处理组;c.0.10 mg/L处理组;d.0.15 mg/L处理组;e.0.20 mg/L处理组。
Notes:a.Control group;b.0.05 mg/L exposure concentration;c.0.10 mg/L exposure concentration;d.0.15 mg/L exposure concentration;e.0.20 mg/L exposure concentration.
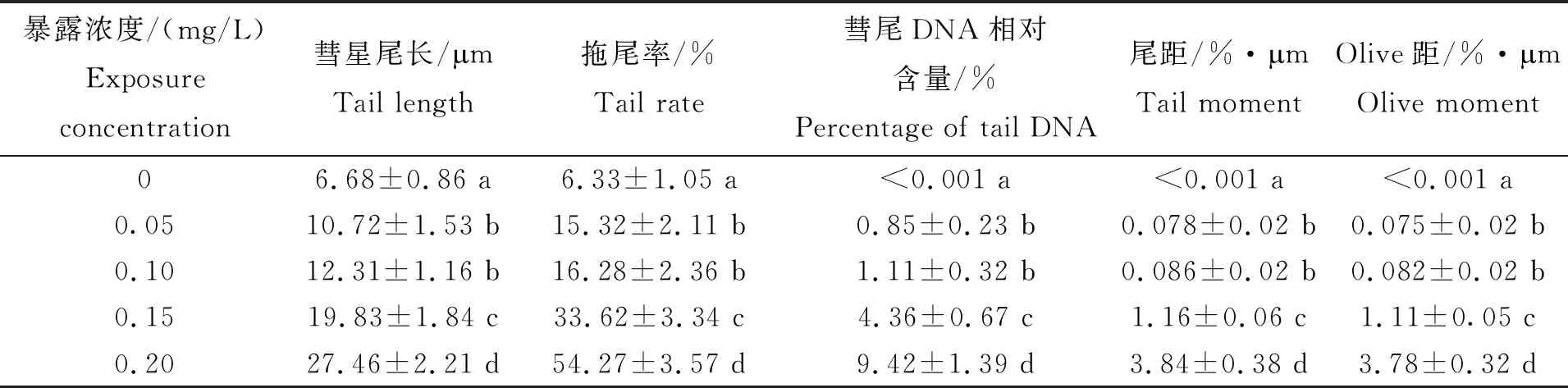
表1 联苯菊酯不同暴露浓度对菲律宾蛤仔肝胰腺细胞DNA损伤的彗星检测指标数据
注:不同英文字母表示差异显著(P<0.05)。
Notes:Values with the different letters were significant difference(P<0.05).
2.2 联苯菊酯不同处理浓度与彗星实验各检测指标的回归分析
各检测指标的回归方程如表2所示,应用Excel软件及SPSS 18.0软件对各项检测指标与联苯菊酯暴露浓度进行线性、多项式和指数拟合回归分析后,其多项式回归分析拟合度最高(r>0.99)。各检测指标与暴露浓度之间存在较好的相关性。联苯菊酯处理浓度与各检测指标的多元回归方程为Y=-0.105+0.075X1+0.028X2-0.012X3-0.173X4(P<0.01),其中Y表示联苯菊酯暴露浓度;X1表示彗尾DNA相对含量;X2表示彗星尾长;X3表示拖尾率;X4表示Olive矩。

表2 联苯菊酯不同处理浓度与彗星实验各检测指标的回归方程
注:y为各检测指标,x为联苯菊酯不同处理浓度。
Notes:ywas each experimental index in comet assay ;xwas the exposure concentration of bifenthrin.
3 讨论
拟除虫菊酯类农药作为一种神经毒剂,通过干扰离子通道,损伤神经系统,从而产生兴奋性神经毒性,出现神经中毒症状[23]。拟除虫菊酯类农药的遗传毒性效应对环境和生物的危害表现为可能导致各种类型的基因突变风险,具有致癌效应和致畸效应。研究报道表明,拟除虫菊酯类农药对水生动物的细胞DNA结构和基因表达产生影响,进而对水生生态存在着一定的生态风险[24-25]。相比于其他传统方法,Mitchelmore等[26]认为彗星实验特别适用于鱼类和其他水生生物的遗传毒理学检测,其基因毒性反应常常作为非特异性的生物标记,应用在环境污染物对生物体损伤的测定中。Al-Subiai等[27]研究暴露于不同Cu浓度培养条件下紫贻贝(MytilusedulisLinnaeus)的反应,体内暴露5 d后,血细胞DNA损伤随着Cu浓度增加而有所增加,低浓度Cu(18 μg/L)即可造成显著性DNA损伤,当浓度增加至56 μg/L时,彗尾DNA百分比(Tail DNA%)不断增加至66%。曹丽萍等[28]研究四氯化碳对建鲤(Cyprinuscarpiovar.jian)肝细胞DNA的毒性作用,结果表明彗星实验中各项损伤指标值随着环境污染物染毒剂量增加而极显著增加。
本研究选用彗星尾长、拖尾率、Olive尾矩和尾部DNA百分含量来评估联苯菊酯对菲律宾蛤仔体内肝胰腺DNA的损伤程度,其中尾部DNA百分含量与Olive尾矩是公认的评估DNA损伤的彗星实验指标[29]。实验结果表明,0.05~0.20 mg/L处理组均出现出不同程度的DNA损伤,随着联苯菊酯暴露浓度的增加,各检测指标值均呈规律性的增长趋势,菲律宾蛤仔肝胰腺DNA结构越松散,断裂的DNA碎片或碱变性片段越多,彗星尾长相应增加,损伤也越严重,表现出良好的剂量效应关系。该实验结果与氰戊菊酯对菲律宾蛤仔研究结果[21]相一致。实验中0.20 mg/L处理组的各项检测指标值均显著高于其他组,表明菲律宾蛤仔在联苯菊酯0.20 mg/L暴露处理25 d后,其肝胰腺DNA受到了严重损伤。菲律宾蛤仔肝胰腺细胞在联苯菊酯暴露浓度为0.05~0.15 mg/L时,实验处理组与空白对照组相比,各检测指标表现出显著性差异(P<0.05),而当暴露浓度达到0.20 mg/L时,DNA损伤更加剧烈,该实验处理组显著高于其他实验处理组(P<0.05),结果表明联苯菊酯与菲律宾蛤仔肝胰腺细胞DNA的损伤具有高度的相关性,呈现一定的剂量效应关系,同时菲律宾蛤仔肝胰腺细胞对联苯菊酯毒性存在着高速反应的阈值范围。
为了全面评价联苯菊酯对菲律宾蛤仔肝胰腺DNA损伤的影响因子,本研究对实验各检测指标进行回归分析和相关性分析,结果表明各检测数据与处理浓度之间存在高度的相关性,其中多项式回归分析拟合度最高(r>0.99),彗星实验各个检测指标均能很好地反映出联苯菊酯暴露浓度对菲律宾蛤仔肝胰腺细胞DNA的损伤程度。该结论也与相关研究报道一致,Kacar等[30]采用厚壳贻贝(MytiluscoruscusGould)作为指示生物,对贻贝的鳃细胞和血细胞进行彗星实验,表明贻贝的鳃细胞和血细胞中的DNA损伤均与环境中总PAHs浓度呈正相关(r分别为0.76和0.87);Dogu等[31]用含毒死蜱(CFP)三个浓度组(0.02、0.04、0.08 mg/L)的饲料投喂虹鳟(OncorhynchusmykissWalbaum)后,采用彗星实验技术对虹鳟血红细胞DNA损伤水平进行了检测,结果显示CFP剂量的增加与DNA损伤质检有显著的相关性(P<0.01)。本研究通过在对彗星实验各检测指标建立一元回归方程的基础上,采用SPSS统计软件进行分析,经过多参数的多元回归方程分析表明:联苯菊酯暴露浓度与彗星实验各检测指标之间存在着高度的相关性,且各个检测指标的相关系数都具有统计学意义,表现出显著性差异(P<0.05),并通过多元回归方程可以有效地推断出联苯菊酯对菲律宾蛤仔的染毒浓度,其中彗尾DNA相对含量是比较直接的可靠指标,而处理浓度对尾矩和Olive矩的影响作用类似,但Olive矩在回归方程显著性更高(P<0.01),尾矩为排除的变量。通过多元回归方程分析表明:联苯菊酯暴露对菲律宾蛤仔肝胰腺细胞DNA损伤情况较好的检测指标为彗尾DNA相对含量和Olive矩,即产生影响最显著的因素,表明通过彗星实验建立实验室检测联苯菊酯遗传毒性的方法具有可行性,进一步验证彗星实验在研究环境污染物对水生生物潜在基因毒性方面的可行性,为评估联苯菊酯的遗传毒性和安全评估提供必要的参考数据。
4 结论
本实验以菲律宾蛤仔肝胰腺细胞为研究对象,采用单细胞凝胶电泳技术探讨了联苯菊酯的遗传毒性作用。
1)随着联苯菊酯浓度的增加,彗星实验各检测指标都呈现规律性的增长趋势,具有高度的相关性(r>0.99),表现出良好的剂量效应关系。
2)评价彗星实验较好的检测指标为彗尾DNA相对含量和Olive矩,并且通过多元回归方程可以有效地推断出联苯菊酯对菲律宾蛤仔的染毒浓度。
