高通量测序技术检测自然流产绒毛染色体异常的准确性分析
2020-06-24郭丽娜赵敏英刘盼
郭丽娜,赵敏英,刘盼
早期自然流产是指妊娠12周之内发生的流产,是临床重点关注课题,但其涉及诸多复杂因素,约有60%的早期流产与胚胎染色体异常有关。常规细胞遗传学方法诊断存在较高的误诊率及漏诊率,不利于临床对自然流产风险的预测。目前研究认为加深胚胎染色体异常的诊断效能有利于提高自然流产风险的预测能力,高通量测序技术检测自然流产对判断胚胎染色体有无异常具有重要作用[1-2]。王德刚等[3]研究表明,临床采用高通量测序技术获取全基因组数据,可作为胚胎染色体异常的诊断依据。但目前关于该方法的临床研究仍然较少。因此,本研究选取2018年3月—2019年3月石家庄市第一医院(我院)收治的39例自然流产患者,通过高通量测序技术检测胚胎染色体,为临床采用高通量测序技术提高胚胎染色体异常诊断水平提供依据。
1 对象与方法
1.1 研究对象 选取2018年3月—2019年3月我院收治的39例自然流产患者。本研究经我院伦理委员会批准。纳入标准:①流产前影像学检查提示胚胎停育者;②自愿参与本研究,主动提出流产绒毛组织染色体检测。排除标准:①孕期发生感染者;②既往有害物质接触史者。39例患者年龄23~38岁,平均(28.91±6.21)岁;流产孕周7~12周,平均(9.28±1.46)周;连续2次自然流产者13例,首次流产者4例,复发性流产者22例。
1.2 方法
1.2.1 高通量测序检测①组织标本留取:给患者准备私密空间,在保护患者隐私、知情同意的前提下行清宫术,给予患者常规外阴以及阴道等区域消毒,根据标本留取原则留取胚胎绒毛组织10 g。②使用无菌盐水多次漂洗绒毛样组织标本,提取基因组DNA。通过紫外可见分光光度计测定所提取DNA的浓度及纯度,随后利用琼脂凝胶电泳判断DNA片段的完整性。③将提取的基因组DNA打断成小片段核酸,采用打断后的基因组DNA进行文库构建。补平打断后DNA小片段的5′端突出末端或削平3′端突出末端。采用T4 DNA连接酶,把接头连接到DNA片段两端,用琼脂凝胶切胶回收的方法选择合适范围的片段回收,采用聚合酶链反应(PCR)扩增进行富集。随后再次进行片段的选择与纯化从而得到DNA小片段文库。利用ABI PRISM 310型基因测序仪进行高通量测序分析。④将高通量测序针所得数据进行生物信息学分析,通过序列对比观察染色体是否存在异常。
1.2.2 细胞培养染色体核型分析对采集的绒毛标本进行常规处理,培养4~5 d。常规使用消化法处理细胞、制片、染色,根据镜下观察结果,计数20个中期分裂相,分析3~5个核型。
1.3 统计学方法 采用SPSS 21.0软件进行数据分析。定量资料采用均数±标准差(x±s)表示,组间比较采用t检验;定性资料用例数(百分比)表示,组间比较采用配对卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养染色体核型分析结果 细胞培养染色体核型分析共检测39例绒毛样本,检测失败4例,检测成功率89.74%。结果显示,染色体异常21例,占样本总例数的53.85%,染色体未见明显异常14例(35.90%)。
在21例染色体异常样本中,染色体数目异常19例,包括非整倍体11例(52.38%),其中三体7例(63.64%),主要涉及22号和16号染色体;单体5例(23.81%),均为Turner综合征;四体3例(14.29%)。染色体结构异常2例(9.52%)。见表1。

表1 21例染色体核型异常结果
2.2 高通量测序分析结果 高通量测序检测成功率为100%。未见明显异常的样本共14例(35.90%),染色体异常共25例,占样本总例数的64.10%。其中细胞培养检测染色体异常的21例中,高通量测序检测发现21例染色体异常,二者检测结果一致;未见明显异常的14例样本中,发现1例三体嵌合体(46,XX/47,XX+21)、2例拷贝数变化(CNVs)[46,XX,del(4)(p16),见图1;46,XX,del(11)(q23)];4例检测失败中的样本中,发现1例CNVs[46,XY,del(1)(q21)],见图2。

图1 高通量测序检测CNVs结果;46.XX,del(4)(p16)
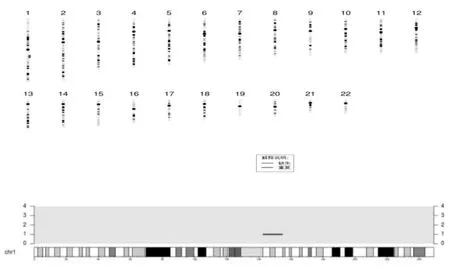
图2 高通量测序检测CNVs结果;46,XY,del(1)(q21)
2.3 2种分析结果比较 高通量测序总检出率虽高于细胞培养染色体核型分析总检出率[64.10%(25/39)vs.53.85%(21/39)],但差异无统计学意义(χ2=2.250,P=0.134)。
3 讨论
自然流产的遗传学机制主要体现在染色体数目的异常变化上。当遗传缺陷在染色体数目异常影响下增大,进而导致大量基因增加或缺失,破坏基因平衡,从而影响细胞增殖,将无法继续妊娠,最终诱发自然流产[4-5]。
目前细胞培养染色体核型分析在科研领域受到重点关注,其在自然流产遗传学病因的诊断中发挥重要作用,但是其存在标本要求高、检测时间长等局限性[7-8]。研究表明,在细胞培养染色体核型分析操作过程中需要经过诸多步骤,繁琐的环节影响了其推广,而且环节越多微生物感染风险越高,培养失败率越高,加之染色体亚端粒区域的诊断难度较高,使用细胞培养染色体核型分析无法获取该区域的具体信息,即使利用高精密设备进行小片段CNVs仍无法获取诊断依据,所以诸多局限性使得细胞培养染色体核型分析不能完全作为判断染色体有无异常的依据[9]。
高通量测序技术可一次并行对几十万到几百万条DNA分子进行序列测定和一般读长较短。本研究的创新点即利用高通量测序技术与细胞培养染色体核型分析进行对比,反映高通量测序技术的具体优势。研究表明,高通量测序技术可通过调整测序的深度及覆盖度加强染色体亚端粒区域的观察,获取准确的判断依据,进而为临床了解自然流产的遗传学病因提供依据,提示高通量测序技术可有效提高自然流产胚胎染色体异常的检出率[10-12]。本研究结果显示,高通量测序技术对于染色体异常的检出率高于细胞培养染色体核型分析,且在细胞培养染色体核型分析中未发现异常的标本,利用高通量测序技术也可检出染色体异常,但二者差异无统计学意义,可能与样本量较小有关。但是在比较两种方法检测自然流产绒毛染色体过程中,仍然体现出高通量测序的优势:在39例标本中,细胞培养染色体核型分析有4例因绒毛组织培养失败而不能进行分析,无法得到结果。说明细胞培养染色体核型分析对标本要求较高,需要标本新鲜无菌,同时需要专业人员的技术水平也较高,在一定程度上限制了其应用。高通量测序技术检测可行性较佳,其无较高的标本要求,在-20℃冷冻保存14个月也能检测成功,更有利于临床推广[13-15]。在本研究中,高通量测序发现细胞培养染色体核型分析未见明显异常的14例样本中,发现染色体异常3例。传统细胞培养染色体核型分析的方法只能检测10 Mb以上片段的重复和缺失,无法检测到微小片段的重复和缺失。而高通量测序可以发现200 Kb以上片段的重复和缺失,可以获得更高的染色体结构异常检出率。从标本检测时长上看,细胞培养染色体核型分析单个样本检测时间约为30 d,而高通量测序检测时间仅10 d左右,大大缩短了患者的等待时间。
综上所述,高通量测序检测技术是一项有助于明确自然流产遗传学因素的高效遗传学检测手段,可作为细胞培养染色体核型分析检查的有力补充,值得临床推广和广泛应用。
