玉米根际土壤微生物群落结构及多样性季节变化特征
2020-06-22杨泽良李萍芳向书琴向国红
杨泽良,李萍芳,薛 涛,向书琴,向国红
(1.湖南科技学院农业与生物技术学院,湖南 娄底 417000;2. 湖南农业大学资源环境学院,湖南 长沙 410128)
【研究意义】作为人类直接的生存载体,陆地生态的变化将产生重大的影响,直接影响着人类及其他动植物的生存环境,制约着人类生存生活[1-3]。森林、土壤、微生物等作为陆地生态的重要组成部分,各自发挥着不可或缺的角色。作为植被种植的载体[4-6],土壤的存在能够将养分源源不断地向植被输送,维持着植被整个生长发育各个阶段,在此过程中也离不开微生物的作用,在微生物的参与之下[7-8],有机质等被分解为可供吸收利用的能量,提升了土壤养分,同时降低了土壤板结等问题的发生,微生物活动也能够增强土壤孔隙度,同时参与土壤矿化等,成为土壤生化循环的重要组分部分[9],可以说,在整个能量转化过程中,微生物起着积极作用,对于改善根际土壤质量作用尤为关键。植被能量的获取离不开发达的根系,因此根际土壤显得尤为关键,直接制约着根系对养分及水分的利用,这也是土壤与植被的紧密结合区,也是微生物活跃的区域,三者共同构成了植被生长发育的关键场所,制约着能量交换和物质循环,对于根际土壤而言,根系分泌物能够显著影响之,对于微生物及植被交互作用起着直接制约效应,二者的协同发展会形成良好的互惠发展,充分满足各自所需。一方面,根际土壤的养分条件受到微生物及根系的双重制约,另一方面,土壤理化特点也受到二者的制约,同时,植被生长发育也会对根际微生物群落分布产生重要影响效果[10];对于植被生长而言,其不仅离不开土壤养分及水分的供应,也离不开根际微生物的分解及降解作用,其菌类PGPR在促进养分转化方面的效果尤为显著,同时对于植被适应性的增强起着积极作用,加强了植被对干旱等逆境的耐受性[11-12]。【前人研究进展】由于根际所处位置具有独特性,因此其作用也尤为关键,直接制约着植被对于养分等能量的吸收利用,更是与微生物交互作用的场所,是吸收能量的载体[6-8],此外,其分泌物对于微生物活动也起着较显著的作用,能够影响根际土壤质量,反哺于植被生长发育,开展根际及土壤等方面的研究具有重要的现实意义。国内对于这方面的研究相对来说起步较晚,可追溯至20世纪80年代,前期的研究主要集中在农作物及林木等方面,随着研究的不断深入,根际养分及微生物研究不断增多,并取得了较为丰硕的研究成果,同时对于分泌物及簇根等方面开展了相关分析,但是对于油料作物的相关研究并不多见[13-14]。【本研究切入点】基于此,本研究开展此方面的相关研究,并将玉米作为探究对象,对于玉米研究而言,以往常注重育种及栽培等方面的分析,对于根际土壤特性的变化并未进行充分的大量研究,对于其根际微生物活动等探究也相对较少,尤其的季节变化下的根际土壤,这对于玉米养分获取及结实等方面起着明晰的制约效果,对于强化玉米种植具有显著的现实意义,同时能够强化土壤相关研究。【拟解决的关键问题】因此本研究立足于玉米的不同生长季节,从而一方面探究其根际土壤养分及其理化特征,另一方面对根际微生物特性加以分析,从而促进玉米种植,强化土壤保护,促进玉米的产业化种植,同时对根际土壤的养分特点进行比较,以寻求更为适宜的养分利用方法,注重土壤利用策略,加强土壤保护,促进玉米的合理种植和土壤的有序保护,以提供有益参考。
1 材料与方法
1.1 样品采集
将玉米种植区作为研究对象,使用先玉335,并于2018年2月开始正式的实验分析,并进行根际土壤的采样,后续对之开展相应的指标分析,由于其花期利于微生物活动,此时开展土样采集及测样较为合适;在土样采集过程中注重土样的混合均匀,以便于准确进行指标分析,具体来说通过抖根法进行,之后将之在4 ℃下的实验室温度保持,在正式的指标测定前将其分为两个部分,其中部分采样风干后测定,另一部分直接进行相应的DNA测序。
1.2 研究方法
分别于2、7、10、12月的中旬开展植株取样,相当于在不同的季节进行了随机取样,数量为30株,然后进行根际土样采集,首先将完整根系及其周边土壤挖出,接下来将其中不含根系的大块土壤抖落,之后才借助于小刀将周边土壤取出,这是非根际土S,为了进行试验对比,需要将之置于密封袋保存,并进行充分的混合;而根际土样需通过刷子取样,也就是附着在根围5 mm范围内的土壤,这就是根际土R,在此过程中注意根系的保护,同时去除土样的杂物以及根系等,这样区分根际土的情况下共获取土样60份,并在4 ℃的常温下保存,以便于后续开展相应的指标测定。正式测量各项指标前需要进行过筛处理,同时对理化特征加以分析记录。
1.3 样品测定
对于样品的具体测定方法如下:对于pH值、有机碳SOC、全氮STN的测定分别借助于pH测量计、容重法及硝化法进行;通过P4电导仪测定电导率,并通过其估算含盐量;对于磷、速效氮的测定分别借助于比色法、光度计法[15]。
1.4 土壤总DNA提取
对于土壤DNA的提取,本研究需要依赖于DNA试剂盒开展,在此过程中还需要进行洗脱处理,待其体积为50 μl的情况下,将1 %的琼脂糖凝胶融入其中,同时利用电泳条带特性开展相应的质量测定,利用ND-1000光度计进行浓度分析。
1.5 土壤微生物基因组DNA的提取
为了进行基因指标提取,首先需要在溶液中加入根际土样,并混合均匀,取样1 mL进行离心处理30 s,并在无菌状况下进行,温度不超过5 ℃,待上清液去除后将DNA基因组予以提取。
1.6 DNA扩增及测序
为了完成细菌的扩增测量,需要进行两轮的操作,尤其要注意V3~V4区;首先,在barcode通用引物的参与下,能够进行第一轮的扩增处理,尤其是要注重引物的结合,对于引物而言,要求上游达到341F,而下游为805R;对于真菌而言,要求18S rDNA,分别在NS1、Fung条件下进行;在此过程中共进行了5个循环,反应体系及模板分别达到30 μl、20 ng。
从二轮扩增的角度来看,主要集中在PCR产物的桥式引物,此过程中开展5次循环,要求达到5 min的延伸处理,温度在72 ℃,同时及时将相关的产物回收,在此过程中做好数据记录及结果记录分析,最后还需要进行产物混合,并测序高通量。
1.7 数据分析
在开展测序分析的过程中,对于其接头序列需要去除,同时将碱基拼接后降非特异扩增造成的制约剔除,从而获取有效序列,作为其数据源,将97 %作为分析阚值;此外,坐标也会和群落分布密切相关,对其相似性加以比较。
2 结果与分析
2.1 不同季节玉米根际与非根际土壤理化性质
由图1可知,不同季节玉米根际与非根际土壤理化性质随季节变化趋势一致,玉米根际、非根际土壤电导率随季节呈先增加后降低趋势,大致表现为夏季>秋季>春季>冬季,以夏季根际、非根际土壤电导率达到最大,玉米根际和非根际土壤电导率在不同季节差异均显著(P<0.05),夏季、秋季和冬季玉米根际土壤电导率极显著高于非根际土壤(P<0.01),春季玉米根际土壤电导率则显著高于非根际土壤电导率(P<0.05)。由春季到冬季,玉米根际、非根际pH值呈先降低后增加趋势,大致表现为春季>冬季>秋季>夏季,以夏季玉米根际、非根际土壤pH值最低,其中玉米根际土壤pH值在不同季节差异均显著(P<0.05),非根际土壤pH值夏季显著低于其他季节(P<0.05);不同季节玉米根际土壤pH值极显著低于非根际土壤pH值(P<0.01)。
2.2 不同季节玉米根际与非根际土壤养分含量
由图2可知,不同季节玉米根际与非根际土壤养分含量随季节变化趋势相一致,由春季到冬季,玉米根际、非根际养分含量均呈先增加后降低趋势,以夏季玉米根际、非根际土壤养分含量最高,冬季玉米根际、非根际土壤养分含量最低,并有所波动。其中玉米根际、非根际土壤有机碳含量在不同季节差异均显著(P<0.05),并且夏季、秋季和冬季玉米根际土壤有机碳含量极显著高于非根际土壤(P<0.01),春季玉米根际土壤有机碳含量则显著高于非根际(P<0.05)。玉米根际、非根际土壤全氮含量在不同季节差异均显著(P<0.05),并且夏季、秋季和冬季玉米根际土壤全氮极显著高于非根际土壤(P<0.01),春季玉米根际土壤全氮含量则显著高于非根际(P<0.05)。玉米根际、非根际土壤全磷含量在不同季节差异均不显著(P>0.05),并且夏季、秋季和冬季玉米根际土壤全磷含量与非根际土壤全磷含量差异不显著(P>0.05),春季玉米根际土壤全磷含量则显著高于非根际(P<0.05)。玉米根际、非根际土壤全钾含量在不同季节差异均显著(P<0.05),并且夏季、秋季和冬季玉米根际土壤全钾极显著高于非根际土壤(P<0.01),春季玉米根际土壤全钾含量则显著高于非根际(P<0.05)。
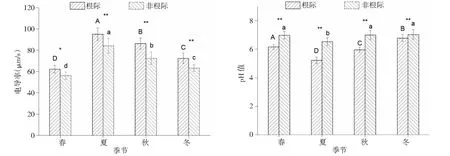
“*”“**”分别表示同一季节不同处理间在0.05、0.01水平上差异显著;不同季节同一处理间不同大写字母表示不同季节玉米根际土壤在0.01水平上差异显著。下图同‘*’ and ‘**’ mean that the difference between different treatments in the same season is significant at the level of 0.05 and 0.01, respectively.Different capital letters in the same treatment in different seasons indicated that the difference of maize rhizosphere soil at 0.01 level was significant in different seasons.The same as below图1 不同季节玉米根际与非根际土壤理化性质Fig.1 Physicochemical properties of maize rhizosphere and non-rhizosphere soil in different seasons
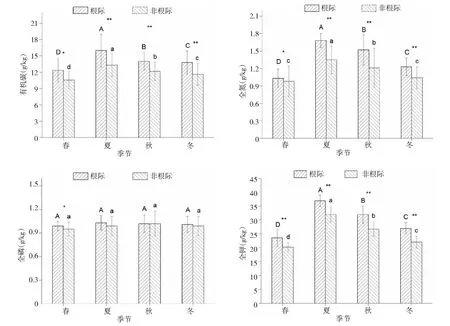
图2 不同季节玉米根际与非根际土壤养分含量Fig.2 Soil nutrient contents in rhizosphere and non-rhizosphere of maize in different seasons
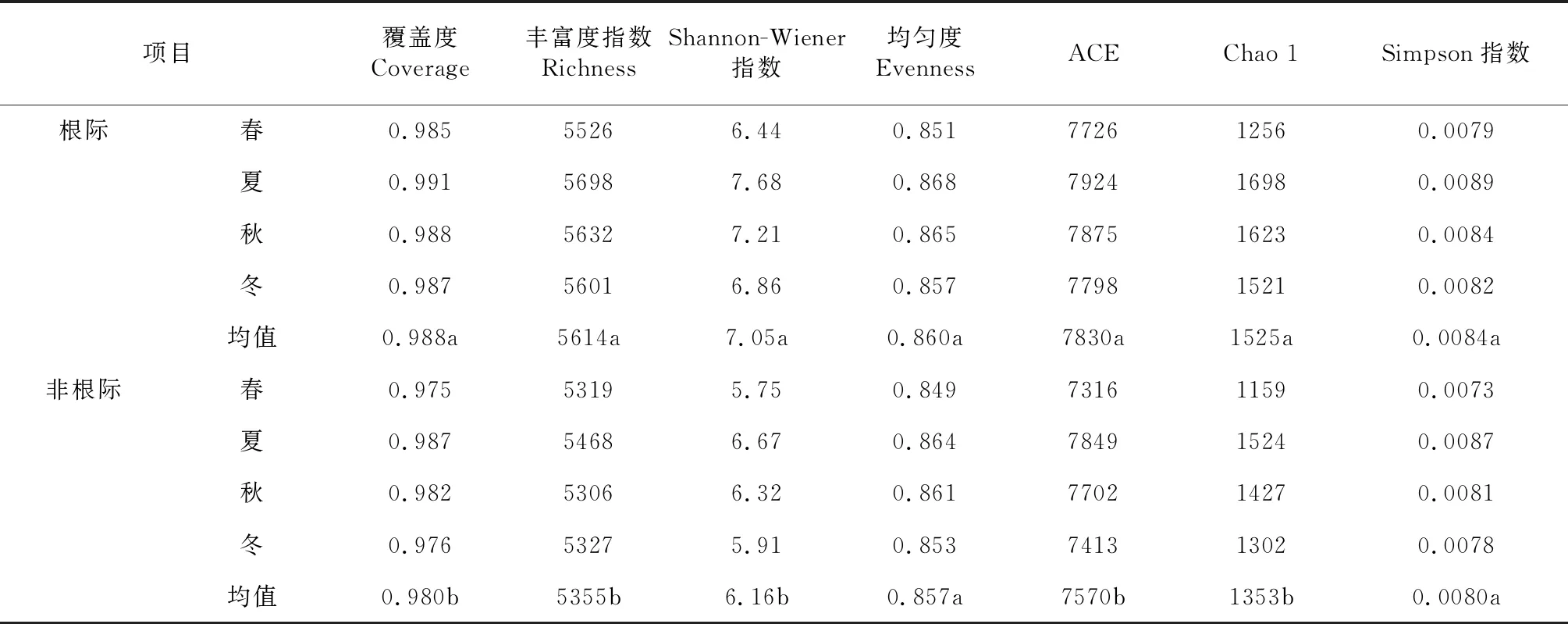
表1 玉米根际与非根际土壤细菌多样性
2.3 不同季节玉米根际与非根际土壤微生物群落多样性
由表1可知,对于土壤细菌多样性,不同季节玉米根际与非根际土壤细菌覆盖度、丰富度指数、Shannon-Wiener 指数、均匀度Evenness、ACE、Chao 1指数、Simpson指数随季节变化趋势相一致,由春季到冬季,玉米根际、非根际土壤细菌多样性指数均呈先增加后降低趋势,以夏季玉米根际、非根际土壤细菌多样性指数最高,冬季玉米根际、非根际土壤细菌多样性指数最低,并有所波动。玉米根际土壤细菌覆盖度、丰富度指数、Shannon-Wiener 指数、ACE、Chao 1指数均显著高于非根际(P<0.05),而根际土壤均匀度Evenness和Simpson指数与非根际差异不显著(P>0.05)。
由表2可知,对于土壤真菌多样性,不同季节玉米根际与非根际土壤细菌覆盖度、丰富度指数、Shannon-Wiener 指数、均匀度Evenness、ACE、Chao 1指数、Simpson指数随季节变化趋势相一致,由春季到冬季,玉米根际、非根际土壤真菌多样性指数均呈先增加后降低趋势,以夏季玉米根际、非根际土壤真菌多样性指数最高,冬季玉米根际、非根际土壤真菌多样性指数最低,并有所波动。玉米根际土壤真菌覆盖度、丰富度指数、均匀度Evenness、Shannon-Wiener 指数、ACE、Chao 1指数均显著高于非根际(P<0.05),而根际土壤Simpson指数与非根际差异不显著(P>0.05)。

表2 玉米根际与非根际土壤真菌多样性
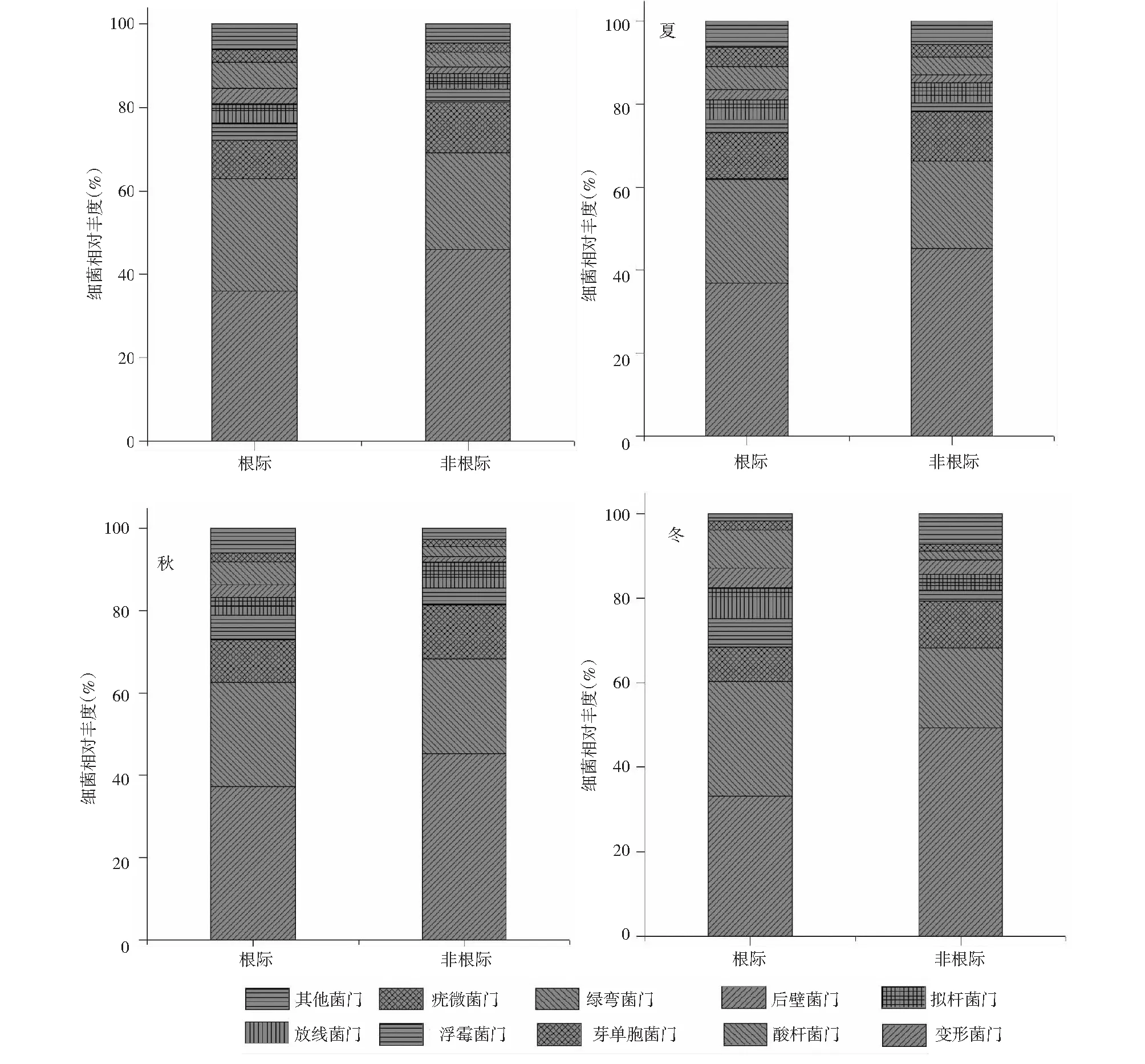
图3 不同季节玉米根际与非根际土壤细菌群落组成Fig.3 Composition of rhizosphere and non-rhizosphere soil bacterial community in different seasons
2.4 不同季节玉米根际与非根际土壤微生物群落组成
由图3可知,不同季节玉米根际与非根际土壤细菌群落结构随季节变化趋势相一致,细菌群落组成没有发生较大变化,其中玉米根际土壤细菌群落中,优势类群主要是变形菌门(33.26 %~37.268 %)、酸杆菌门(25.03 %~27.03 %)和芽单胞菌门(8.16 %~11.26 %),还包括浮霉菌门(3.15 %~6.78 %)、放线菌门(2.15 %~5.19 %)、拟杆菌门(1.96 %~2.15 %)、后壁菌门(2.58 %~4.69 %)、绿弯菌门(5.36 %~8.96 %)、疣微菌门(2.15 %~4.58 %)。非根际土壤细菌群落中,优势类群主要是变形菌门(45.32 %~49.25 %)、酸杆菌门(18.95 %~23.17 %)和芽单胞菌门(11.05 %~13.05 %)。其中根际土壤细菌酸杆菌门相对丰度高于非根际,变形菌门相对丰度低于非根际。
由图4可知,不同季节玉米根际与非根际土壤细菌群落结构随季节变化趋势相一致,细菌群落组成没有发生较大变化,其中玉米根际土壤真菌群落中,优势类群主要是子囊菌门(52.69 %~54.69 %)和担子菌门(23.04 %~26.17 %),还包括结合菌门(3.26 %~6.12 %)、壶菌门(0.51 %~1.56 %)、新丽鞭毛菌门(6.25 %~8.94 %)、球囊菌门(2.14 %~4.12 %)、芽枝菌门(1.19 %~3.19 %)。非根际土壤真菌群落中,优势类群主要是子囊菌门(48.26 %~50.16 %)和担子菌门(29.87 %~32.16 %),其中根际土壤细菌酸杆菌门相对丰度高于非根际,变形菌门相对丰度低于非根际。
由图5可知,主坐标分析(PCoA)分析表明:不同季节玉米土壤根际和非根际细菌群落具有很好的相似性,并且根际和非根际细菌群落产生明显的分离效应;玉米土壤根际和非根际真菌群落具有很好的相似性,并且根际和非根际真菌群落产生明显的分离效应。

图4 不同季节玉米根际与非根际土壤真菌群落组成Fig.4 Composition of rhizosphere and non-rhizosphere soil fungus community in different seasons
2.5 土壤养分与细菌群落结构的相关性
相关性分析(表3)表明:玉米土壤细菌和真菌Coverage、ACE与土壤养分均没有显著的相关性(P>0.05);土壤pH与土壤细菌和真菌多样性呈负相关,土壤电导率和全磷与土壤细菌和真菌多样性均没有显著的相关性(P>0.05)。土壤有机碳与细菌Richness、Shannon呈极显著的正相关(P<0.01),与细菌Chao 1和Simpson呈显著的正相关(P<0.05);土壤有机碳与真菌Shannon呈极显著的正相关(P<0.01),与真菌Richness、Chao 1和Simpson呈显著的正相关(P<0.05)。土壤全氮与细菌Richness、Shannon呈极显著的正相关(P<0.01),与细菌Chao 1和Simpson呈显著的正相关(P<0.05);土壤全氮与真菌Shannon呈极显著的正相关(P<0.01),与真菌Richness、Chao 1和Simpson呈显著的正相关(P<0.05)。土壤速效氮与Richness、Shannon、Evenness、Chao 1和Simpson呈显著的正相关(P<0.05),与真菌Shannon、Evenness、Chao 1和Simpson呈显著的正相关(P<0.05)。土壤速效磷与细菌Shannon、Chao 1和Simpson呈极显著的正相关(P<0.01),与Evenness呈显著的正相关(P<0.05);土壤速效磷与真菌Shannon、Evenness、Chao 1和Simpson呈显著的正相关(P<0.05)。
3 讨 论
通过研究分析得知,对于玉米种植区而言,无论是根际土壤,还是非根际土壤,虽然季节不同,但是其变化趋势基本一致,对于其pH值而言,其先降后升的态势较为明显,尤其是春季表现更为突出,其次是冬季、秋季,而夏季变化最小,其值最低。而电导率则与之呈现截然不同的变化,且在夏秋季节,根际与非根际之间是存在较大差异的,其差异达到了显著水平,也就是我们常说的根际富集现象比较明显。对于玉米种植区土壤养分而言,随着季节的变化,其先升后降的变化态势较为明显,尤其是有机碳等养分,且最高值出现在夏季,无论是根际土壤还是非根际均是如此。随着季节的转换,碱性盐离子被植被吸收,这使得土壤的酸性更为明显,在其根际的不断发展之下,可溶性离子显著增加,有机酸分泌增多,加之微生物活动的影响,降低了土壤pH值。从中也可以看出,为了促进土壤养分,可以采取降低其pH值的方法进行,这将明显利于有效养分的利用效率,在可溶离子不断增多的情况下,电导率也随之上升[16-17]。

图5 基于Weighted unifrac 距离的土壤微生物群落的主坐标分析(PCoA)Fig.5 Principal coordinate analysis of soil microbial community based on Weighted unifrac distance (PCoA)
不少学者通过实验对比分析得知,对于根际及非根际土壤而言,其虽然都是与根系关系密切的土壤分布,但是其养分含量并不相同,且存在的差异较为明显[18-19]。通过本实验分析得知,在季节变化的情况下,二者的养分含量水平相差明显,且二者随着季节变化而呈现出较为明显的规律,其先升后降的态势较为明显,尤其是夏季表现更为突出,呈现出峰值,其次是秋季、春季,而冬季变化最小,其值最低。对于玉米根际土壤而言,夏秋季节养分含量明显较高,且与春冬季节的差异呈现显著水平[20]。在季节变化影响之下,玉米土壤的菌群分布特点呈现较大差异,尤其是细菌及真菌分布,其盖度、丰度及均匀度都呈现出明显的季节特点,其先升后降的变化态势明显,且根际土壤分布明显较高,二者呈现较大差异;对于ACE、Chao 1指数亦是如此[22-23]。主要原因在于夏秋季节属于玉米生长旺盛期,根系生长旺盛的同时分泌较多根系分泌物,对于促进生物量增长作用明显,加之养分富集效应,形成了更高水平的根系养分含量[22]。此外,对于玉米根系而言,其在降尘物质的作用下及腐殖质影响下,根际沉积更为明显,这对于微生物活动也起着积极作用[21-22],能够促进微生物生长发育,进而加快有机质分解和降解,对于养分的转化起着积极作用,因此形成更高的养分含量[23-25]。

表3 土壤养分与土壤细菌和真菌多样性相关性
注:*,**分别表示在0.05和0.01水平上差异显著。
Note: * and ** indicate significant differences at the level of 0.05 and 0.01, respectively.
通过此次玉米种植试验,无论是根际土壤还是非根际土壤,其pH值与养分之间的相关程度较高,养分与微生物之间的相关程度也较高,对于玉米根系而言,其能够分泌一定的有机酸,该物质对于养分的活化起着积极作用。在pH值不断降低的情况下,养分的转化得以提升,其活化效果更为显著,在根系呼吸作用下,大量的二氧化碳被释放,有机酸水平提升,形成了更低的pH值[18-19]。过高或过低的酸性水平均不利于植被生长,也对微生物活动起着不利影响,在其值不断下降的情况下,根区更容易酸化[20-21,24]。对于玉米而言,春季属于萌芽期,其长势并不快,光合作用相对较弱,也并无大量的根际微生物活动;但是到了夏秋季节,长势逐渐旺盛,生长加速,新陈代谢加快,各项生理特点达到高峰,对于养分及微生物来说均呈现了较为明晰的根际效应,这有利于植被对于养分的吸收利用效率提升,同时对于微生物活动也起着积极作用[25]。进入秋冬季节,玉米生长状况下降,养分含量呈现大幅下降,微生物活动明显降低,影响了根际土壤各项指标。
4 结 论
(1)不同季节玉米根际与非根际土壤养分含量(有机碳、全氮和全钾)随季节变化趋势相一致,由春季到冬季,玉米根际、非根际养分含量均呈先增加后降低趋势,以夏季玉米根际、非根际土壤养分含量最高,冬季玉米根际、非根际土壤养分含量最低,并有所波动。
(2)不同季节玉米根际与非根际土壤细菌和真菌覆盖度、丰富度指数、Shannon-Wiener 指数、均匀度Evenness、ACE、Chao 1指数、Simpson指数随季节变化趋势相一致,由春季到冬季,根际、非根际土壤细菌和真菌多样性指数均呈先增加后降低趋势,并且不同季节根际土壤细菌和真菌多样性指数均显著高于非根际。
(3)玉米土壤细菌和真菌Coverage、ACE与土壤养分均没有显著的相关性(P>0.05);土壤pH与土壤细菌和真菌多样性呈负相关,土壤电导率和全磷与土壤细菌和真菌多样性均没有显著的相关性(P>0.05)。玉米土壤根际和非根际细菌和真菌群落具有很好的相似性,并且根际和非根际细菌群落产生明显的分离效应。
