结直肠癌围手术期营养治疗的几个问题
2020-06-19董明
结直肠癌(colorectal cancer,CRC)是人类常见的恶性肿瘤之一。早期发现及规范化手术治疗仍然是当今治愈CRC的重要手段。CRC围手术期营养治疗对提高手术安全性、加速病人康复、减少手术并发症等具有重要意义。为此,中华医学会外科学分会结直肠外科学组组织相关领域专家共同发表了“结直肠癌围手术期营养治疗中国专家共识(2019版)”(简称“共识2019”)[1],引起业内广泛关注和认可。然而由于其篇幅所限,仍有许多问题需要深入解读。特别是很多读者反映“共识2019”过于提纲挈领,缺乏临床可操作性。本文重点探讨CRC围手术期营养治疗中需要注意的几个问题,旨在进一步解读“共识2019”。
一、CRC流行病学趋势
2018年世界卫生组织发布的全球肿瘤报告“Global Cancer Statistics 2018”显示,全球新发癌症病例1,810万例,其中CRC占6.1%,如果包括肛管恶性肿瘤则为10.22%,居恶性肿瘤发病率的第3位。死亡960万例,其中结肠癌加肛管恶性肿瘤占总死亡总数的9.2%,居恶性肿瘤死亡率的第2位[2]。
2020年美国癌症协会发布美国肿瘤报告“Cancer Statistics,2020”显示,美国新发癌症病例1,806,590例,其中CRC占8.19%。如果包括肛管恶性肿瘤(anus,anal canal & anorectum),则占恶性肿瘤发病率的8.67%。死亡606,520例,其中结肠癌加肛管恶性肿瘤总死亡率为9.01%(文献无单纯直肠癌死亡数据)。CRC无论发病率和死亡率均列恶性肿瘤的第三位[3]。
2018年中国国家癌症中心发布的全国癌症报告显示,2014年我国新发恶性肿瘤380万例,其中CRC占9.74%,发病率占恶性肿瘤的第三位。死亡229万例,CRC占7.8%,死亡率占恶性肿瘤的第五位[4]。
综上,发达国家CRC发病率与死亡率均有所下降,而中国CRC流行病学趋势无明显改善。
二、营养风险筛查及状况评估工具
50%CRC病人出现体重丢失,20%出现营养不良[5]。营养不良导致CRC病人失去最佳手术时机,降低辅助治疗效果,延长病人住院时间,增加病人经济负担,并导致病人并发症和病死率上升[6-9]。因此,越来越多的外科医生认识到肿瘤病人术前营养风险筛查与营养状况评估的重要性。营养治疗已成为CRC病人多学科综合治疗的重要组成部分。合理、有效地提供营养治疗对保证手术安全性、改善病人的预后及生活质量具有重要作用。
选择有效的营养筛查与评估工具是规范化实施CRC围手术期营养治疗的前提,也是提高手术安全性、加速病人康复、减少手术并发症的重要保证。目前普遍使用的工具有营养风险筛查2002(nutritional risk screening 2002,NRS2002),主观全面评定量表(Subjective Global Assessment,SGA),病人自评主观全面评定量表(patient-generated subjective global assessment,PG-SGA),微型营养评定量表(mini nutritional assessment,MNA)和营养不良通用筛查工具(malnutrition universal screening tool,MUST)等。目前很多文献强调应用简化工具,没有充分理解这些工具的意义。因此在规范化实施CRC围手术期营养治疗前有必要强化认识这些工具。
NRS2002是目前公认的营养风险筛查工具,由丹麦Kondrup等[10]于2002年提出。该工具有128项RCT研究(纳入8944病例)支持,以≥3分为界限,筛查有营养风险的敏感度62%,特异度93%。阳性结果预测率85%,阴性结果预测率79%。工具发布后,经过欧洲、美洲和亚洲等不同种族群体的多中心研究证明,此工具筛查后的结论相似。由于NRS2002临床参数简洁,评分标准分明、操作流程易用,是目前国际上公认的首选营养风险筛查工具[10]。
SGA在1984年由加拿大Detsky等[11]提出,1987年发表。实为筛查性工具。该工具由医生主观完成五项营养筛查提问和三项查体评定而做出判断,是适用于一般住院病人的营养筛查与评估的标准。由于SGA完全由医生主观评定,主观判断分值过多,从而容易产生误导信息。目前CSPEN仍推荐应用SGA,而国外多被作为开发新的评价工具的依据,其临床应用已被PG-SGA工具取代。
PG-SGA是美国Ottery[12]于1994年改良SGA形成的工具,分为分类诊断和评分诊断。该工具由医患共同完成主客观营养状况评估,病人完成1~4项,医生完成5~7项。PG-SGA比SGA更加完善,是一种有效的肿瘤病人特异性营养状况评估工具,可以快速识别肿瘤病人的营养不良,并监测营养治疗效果。
MNA是美国的Guigoz[13]于1994年发表的工具,包括人体测量、整体评定、膳食问卷以及主观评定等18 项内容,具有很高的准确性,是65岁以上老年病人首选的营养筛查工具。MNA总分30分,≥24分营养良好,17~23.5分存在营养不良风险,<17分可诊断营养不良[13]。
MUST是英国Elia[14]于2003年开发的简便、快捷,无需特殊临床检测指标的营养筛查工具。尤其适用于门诊或社区人群,对预测术后住院时间、病死率或并发症率更为敏感。总分6分。0分为低营养风险,1分为中营养风险,≥2分为高营养风险。有学者推荐MUST+NRS2002是临床确定营养不良最为有效方法[15]。
2018年全球四大肠外肠内营养委员会(ESPEN、ASPEN、PENSA、PELANPE)协作发布全球领导人发起的营养不良评定(诊断)标准共识(The Global Leadership Initiative on Malnutrition,GLIM)[16]。该工具纳入了以往各种营养工具参数的精华,理论上更完美。由于目前无法直接测定GLIM标准中的关键参数肌肉减少量,而各种替代测定方法样本量不足,判断肌肉量减少的标准也极不统一,从而严重影响GLIM评定结果。因此,尽管“共识2019”发表在GLIM发布之后,我们仍没有推荐GLIM标准。
综上,NRS2002营养风险筛查工具仍是目前普遍接受和认可的工具,也得到了中国及亚洲临床实践的充分肯定。营养状况评估工具多覆盖营养风险筛查参数,而且更侧重于筛查。CSPEN及国内推荐的任何评估工具均源自国外,从这些评估工具产生的历史看,均有其服务地域和对应人群特点,故均有其针对性和局限性[11-14]。因此,CSPEN积极组织多中心开发适合中国人的营养状况评估工具势在必行。在实施CRC围手术期营养治疗前,应该根据营养治疗的目的,如提高病人对术前综合治疗的耐受性及降低副反应、减轻手术应激反应、预估术后并发症风险等选择合适的工具。因此,临床工作中,既要避免一味追求简化工具,又要有的放矢单独或联合应用各种工具,以使CRC病人的康复更能获益。
三、CRC病人围手术期能量供给
“共识2019”推荐按照间接测热法测量机体静息能量消耗值提供CRC病人的能量目标需要量,无条件测定时可按照25~30 kcal/(kg·d)提供。CRC病人蛋白质目标需要量为1.0~1.5 g/(kg·d)。提高CRC病人膳食和营养治疗配方中脂肪供能的比例,增加膳食能量密度。补充生理需要量的维生素及微量元素,避免机体维生素及微量元素缺乏[1]。以上目标需要量是以欧美及中国相关指南为依据的日常能量需求,没有考虑CRC病人围手术期应激程度系数。
CRC病人围手术期涉及三个阶段的营养干预,即术前肿瘤源性营养不良,病人可能因接受新辅助治疗所致的额外营养消耗;术中应激反应分解代谢增加;术后恢复期蛋白质合成增加。因此,围手术期能量供给应该在“共识2019”推荐的机体静息能量消耗值基础上,乘以应激程度系数。临床参考值为:择期手术无明显并发症者1.05~1.15,感染1.2~1.4,肿瘤1.45,以及败血症1.6等[17]。就CRC病人的术式而言,肿瘤的临床分期和部位均可影响手术应激反应差异。可供评估这些差异的指标还有手术时间、术中出血量,以及合并器官切除等。然而,针对CRC病人术后并发感染、心脑血管并发症、多器官功能障碍/衰竭等严重应激反应期,多主张低热量供给,如15~20 kcal/(kg·d)。文献报道,低热量可以较好控制血糖,从而减少术后应激反应引起胰岛素抵抗致高血糖相关并发症,并有缩短住院时间倾向。术后胰岛素抵抗可持续2~3周,应根据病人恢复情况及时上调热量供给。在严重应激反应导致的机体高分解代谢期,加量、常量、或减量蛋白质供应仍有争议。有文献报告尽管给手术病人补充足够的蛋白水解产物,但氮的丢失仍然保持在高水平状态。也有数据显示,在蛋白质分解代谢增高的情况下,补充外源性氨基酸可有效提高蛋白质的合成,进而改善氮平衡[18]。从临床观察看,加量补充蛋白质的严重应激病人获益更多,加量蛋白质可达1.5~1.7 g/(kg·d)[19]。CRC病人的围手术期脂肪需要量首先要考虑防止必须脂肪酸缺失。因此,应保证摄入的亚油酸和a-亚麻酸所提供的能量应占总能量的1%~2%和0.5%。CRC围手术期营养治疗中,正常情况下,脂肪功能供能应占总能量的20%~30%,应激状态下可提高到50%[19]。
因此,CRC病人围手术期的能量供给应该根据病人的实际情况,调整热卡、蛋白质和脂肪需要量。
四、肠内营养制剂的选择
目前临床常用普通型肠内营养制剂的成分及热量大同小异,普通营养制剂能够满足80%以上CRC病人需求。近年来,膳食纤维作为第七大营养素日益得到临床医生的重视。对伴有高血压、高血脂、高胆固醇血症、心脑血管疾病的CRC病人,选择高比例可溶性膳食纤维营养制剂有助于降低围手术期并发症风险。对于肠道功能紊乱、肠道菌群失调、特别是功能性排便异常者,增加营养制剂中的非溶性膳食纤维比例,有利于改善症状[20]。考虑到医用高膳食纤维营养制剂与日常富含膳食纤维食材的性价比,如果病人可以经口饮食,可进食富含树脂、果胶、藻胶、魔芋等可溶性膳食纤维食品。以及富含纤维素、半纤维素、木质素等非溶性膳食纤维食品。
随着社会的老龄化,伴有糖尿病、胃肠疾病、肝胆胰疾病等伴存病的CRC病人日渐增多。针对这部分病人应该充分考虑特殊配方营养制剂,以保证病人安全度过围手术期应激反应。目前常用特殊型肠内营养制剂能够满足大多数伴有慢性疾病的CRC病人。有些配方含有牛磺酸、左旋肉碱、ω-3脂肪酸等成分均有其特殊用途,因篇幅所限不再赘述(表1)。值得注意的是,目前结肠癌病人伴有痛风者明显上升,国内市场尚没有针对痛风病人的肠内营养制剂,这类病人的围手术期营养治疗应参考痛风治疗指南实施。
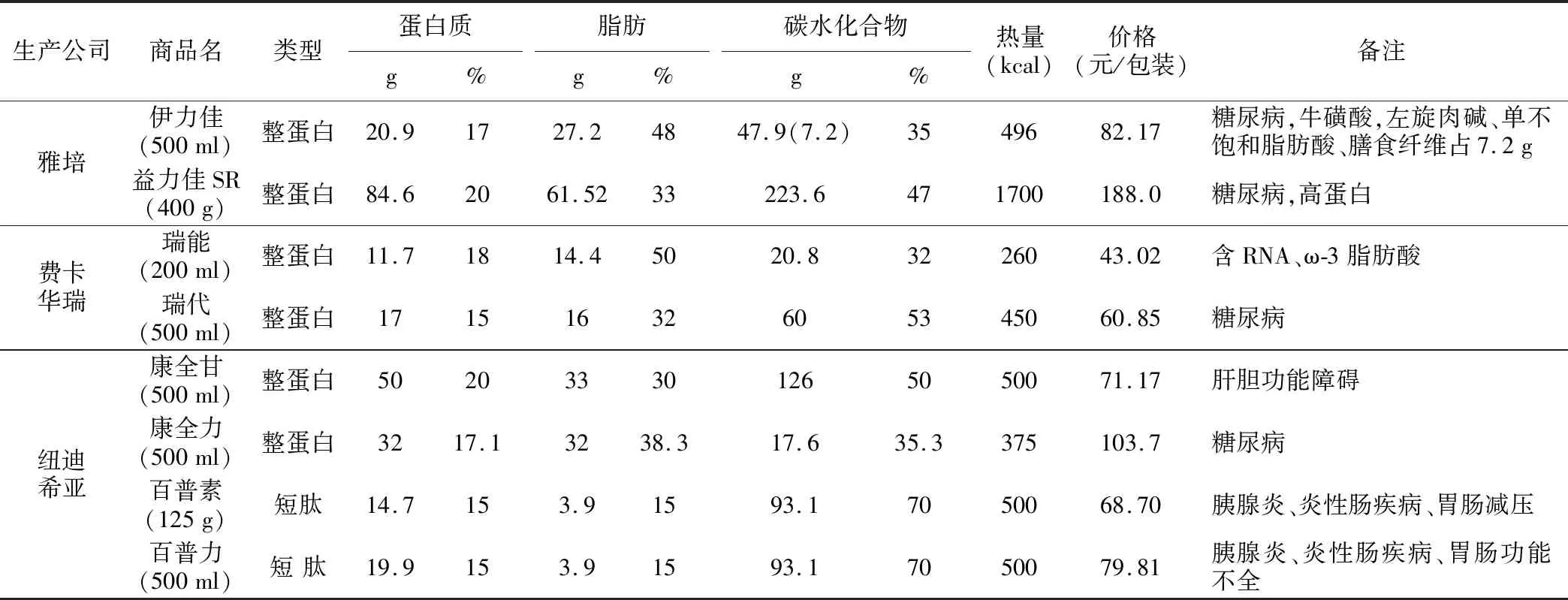
表1 部分特殊配方肠内营养制剂
五、 特殊营养素的评价
特殊营养素主要指ω-3多不饱和脂肪酸(ω-3 PUFA)、谷氨酰胺(Gln)等,目前临床应用争议颇多。
1.ω-3 PUFA:上世纪60年代有学者基于爱斯基摩人心脑血管系统发病率较低而展开流行病学调查,推断ω-3 PUFA可能具有预防心血管疾病作用。然而,最新文献显示,ω-3 PUFA不能显著降低心肌梗死、中风和心血管疾病死亡率,但与完全心肌梗死、经皮冠状动脉介入治疗和致命心肌梗死的显著减少有关[21]。
ω-3 PUFA在肿瘤代谢中的作用是当今营养学领域的热点。检索近15年的PubMed数据库显示,略占数量优势的文献支持ω-3 PUFA具有抗炎和调节免疫功能,但超过三分之二文献的OCEBM证据级别较低,且多限于危重症,特别是严重感染病人可能获益[22-23]。目前有关ω-3 PUFA影响胃肠肿瘤病人化疗效果的研究甚少,但显示出获益趋势[24]。如果将ω-3 PUFA作为能量来源,从性价比看是巨大资源浪费。因此,“共识2019”建议CRC病人的围手术期营养治疗不推荐常规补充ω-3PUFA。
2.Gln:目前关于Gln对肿瘤病人放化疗、抗肿瘤和预后影响的相关研究无一致结论。药理学上,Gln参与细胞的核酸、脂质、蛋白质等代谢,进而发挥能量生成和大分子合成作用,使机体多方面获益:首先、Gln为机体提供必需的氮源而改善氮平衡,促进肌细胞内蛋白质的合成;第二、Gln参与合成谷胱甘肽,后者可提高机体的抗氧化能力,进而稳定细胞膜和蛋白质结构;第三、Gln是免疫系统的重要燃料,能够增加淋巴细胞总数,提高免疫系统的功能。通过抑制炎性介质释放而减轻机体应激反应;最后、Gln是胃肠道管腔细胞的基本能量来源,有利于保护胃肠道黏膜屏障[25]。
另一方面,大量的研究表明,Gln在代谢过程中产生大量的胺,可加重肝脏和肾脏功能的损害。Gln在正常细胞和癌细胞生长中是把双刃剑。近年来,Gln的促癌作用日益引起学者们的重视。血液中高浓度Gln提供的氮源,有利于癌细胞的生物合成、能量代谢和细胞内稳态,促进肿瘤的生长。特别是在营养不良条件下,癌细胞可以通过激活多种癌基因通路,分解大分子获得包括Gln在内的氨基酸,为肿瘤细胞提供能量。由于肿瘤细胞对Gln代谢的依赖性,使其成为一种有潜力的抗癌靶点。许多针对Gln酶抑制剂的研究,现已成为基础与临床研究的热点。其中Gln代谢是在T细胞的活化和调节CD4+T细胞向炎症亚型转变具有重要的作用。Gln对于癌症-杀伤T细胞的活化过程非常关键。通过阻断癌细胞中Gln通路来提高肿瘤微环境氨基酸的含量,增强免疫细胞的杀伤作用[26-27]。Gln在肿瘤放化疗中的应用也极具争议,主要表现在对放化疗敏感性和缓解副作用方面的影响。据此,最新版ESPEN指南不推荐在放疗、化疗或靶向药物治疗期间补充Gln[28]。因此,“共识2019”建议CRC病人围手术期不推荐常规补充Gln。
近年来肿瘤病人的营养治疗已经引起外科医生的广泛重视,然而如何规范实施营养治疗仍然是外科医生面临的棘手问题。究其原因,一方面是把营养治疗定位于科普范畴,而缺乏规范化营养学专业培训;另一方面是基础研究转化临床应用的脱节,导致盲目接受营养制剂适应证扩大化的宣传。因此,加强临床营养学基础理论培训,深入领会相关指南、共识、建议的内涵显得尤为必要。
致谢:感谢美国奥古斯塔大学佐治亚医学院儿科系主任董艳彬教授提供的部分参考文献。
