山楂叶总黄酮对高脂血症大鼠血脂的影响及其机制*
2020-06-18刁婷婷张雨晨陈创张朵朵梅雨吴一昊吕伟闵清
刁婷婷,张雨晨,陈创,张朵朵,梅雨,吴一昊,吕伟,闵清
(1.湖北科技学院药学院,咸宁 437100;2.湖北省咸宁市中心医院药学部,咸宁 437100)
山楂叶为蔷薇科植物山里红(CrataeguspinnatifidaBge.var.major N.E.Br.)或山楂(CrataeguspinnatifidaBge.)的干燥叶,《中华人民共和国药典》2015年版记载山楂叶味酸,性平,归脾、胃、肝经;具有活血化瘀,理气通脉,化浊降脂的功能,用于气滞血瘀、胸痹心痛、胸闷憋气、心悸健忘、眩晕耳鸣、高脂血症[1]。研究发现,山楂叶提取物中主要成分为山楂叶总黄酮(Hawthorn leaves flavonoids,HLF),包括槲皮素、金丝桃苷、黄酮苷、荭草素、葡荆牡黄酮等多种黄酮类化合物[2],是一种作用广泛、不良反应较少的天然药物。现代研究表明,HLF在心、脑血管,糖尿病及其并发症,肝细胞的修复等方面具有很好的药理作用[3]。
前人在研究HLF调节血脂的作用时,在实验中大多是对动物血液中对应指标进行检测和研究。杨宇杰等[4]研究表明,山楂叶总黄酮可明显降低高脂血症模型血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C),提高高密度脂蛋白胆固醇(HDL-C)。刘全亮等[5]研究表明,不同纯度山楂叶总黄酮均可以降低高脂血症模型小鼠的TC和TG水平,降低小鼠体质量,高纯度山楂叶总黄酮优于低纯度。笔者在前人实验基础上,建立高脂血症动物模型,观察HLF对高脂血症大鼠血脂含量和肝脏功能的影响,通过测定肝脏组织中腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和乙酰辅酶A羧化酶(acetyl carboxylase,ACC)的蛋白表达水平,探讨HLF对高脂血症大鼠调节血脂及肝脏的影响及其可能机制,为HLF的进一步开发提供相关实验资料。
1 材料与方法
1.1实验动物 清洁级SD雄性大鼠,体质量170~220 g,由辽宁长生生物技术股份有限公司提供,实验动物生产许可证号:SCXK(辽)2015-0001。动物房温度(22±2)℃,湿度55%~60%,大鼠自由饮水、摄食。高脂饲料(20180604)由北京博泰宏达生物技术有限公司提供,主要含蛋白质24.2%,碳水化合物42.1%,脂肪25.4%,粗纤维5.5%,钙1.7%,磷1.1%。基础饲料由武汉万千嘉兴公司提供,主要含玉米40%,豆粕20%,进口鱼粉7%,面粉23%,进口酵母3.5%,复合矿物盐4%,复合维生素0.2%,复合氨基酸0.8%,油1.5%。
1.2药品与试剂 山楂叶总黄酮(临沂爱康药业有限公司,批号:AKH16-3,含量为93.5%);辛伐他汀片(杭州默沙东制药有限公司,批准文号:国药准字J2913068);TG试剂盒(批号:20180731)、TC试剂盒(批号:20180731)、HDL-C试剂盒(批号:20180817)、LDL-C试剂盒(批号:20180816)、油红O染液(批号:20180815)均购自南京建成生物工程研究所;ACC抗体(产品编号:AF1867)、p-ACC抗体(产品编号:AA110)、AMPK抗体(产品编号:AF1627)、p-AMPK抗体(产品编号:AF2677)、β-Actin抗体(产品编号:AF0003)均购自碧云天试剂有限公司。
1.3动物分组 将SD雄性大鼠,采用随机数字表法分为正常对照组、模型对照组、辛伐他汀组及HLF小、中、大剂量组,每组8只。
1.4造模及给药 参照文献[6]的方法,制备高脂血症大鼠模型,检测大鼠血浆中TC和TG含量,确定高脂血症大鼠模型建立是否成功。适应性饲养1周后,正常对照组大鼠给予基础饲料,其余各组大鼠给予高脂饲料,造模8周。高脂饲料喂养的同时给予药物干预。辛伐他汀组给予辛伐他汀4 mg·kg-1,HLF小、中、大剂量组给予HLF,剂量分别为100,200,400 mg·kg-1,正常对照组和模型对照组给予纯化水1 mL·(100 g)-1,每天1次,连续灌胃给药8周。
1.5生化指标与肝脏指数测定 末次给药后禁食不禁水12 h,麻醉,腹主动脉取血,4 ℃,3500 r·min-1离心15 min,收集血浆。处死大鼠,摘取肝脏,称质量并计算肝脏指数,肝脏指数(%)=肝脏湿质量/大鼠体质量×100%。取部分肝脏组织制备肝匀浆,待测。按照试剂盒说明书测定大鼠血浆中的TG、TC、HDL-C、LDL-C含量及肝匀浆中TG、TC含量,观察HLF对高脂血症大鼠血脂的影响。
1.6苏木精-伊红(HE)染色观察肝脏组织病理学改变 将分离的大鼠肝右叶条形组织块用4%缓冲多聚甲醛固定48 h后,制作病理切片,进行HE染色,光学显微镜下观察各组大鼠肝脏组织病理学变化。
1.7油红O染色观察肝脏脂质聚集情况 将分离的各组大鼠肝脏组织用4%多聚甲醛缓冲液固定48 h后,放到10%、20%、30%蔗糖溶液梯度脱水,直至组织沉底。然后用聚乙二醇/聚乙烯醇混合物(OTC)包埋后于-20 ℃条件下进行冷冻切片,按照油红O染液试剂盒说明书进行染色,光学显微镜下观察各组大鼠肝脏脂质聚集情况。
1.8Western blotting法分析肝脏AMPK、p-AMPK、ACC、p-ACC蛋白表达 将大鼠肝脏组织块剪成小块置于匀浆器,加入裂解液,冰上操作充分匀浆使其裂解完全,4 ℃,12000 r·min-1,离心15 min,收集上清液。BCA法测蛋白浓度,取调整好蛋白浓度的样本上样,按照电泳程序进行电泳、转膜。转膜结束后,5%脱脂奶粉封闭1 h,4 ℃孵育一抗过夜,洗涤3次,室温摇动孵育二抗1.5 h,洗涤3次,凝胶成像系统采集图像,分析数据。

2 结果
2.1动物一般情况 正常对照组大鼠毛发光滑,饮食活动正常,体质量正常,精神状态良好。模型对照组大鼠体质量增加量高于正常对照组,实验前期毛发粗糙,微黄色,活跃程度下降。各给药组大鼠生长较正常,体质量略有增长,饮食活动较正常,精神状态较好。
2.2HLF对高脂血症大鼠肝脏指数的影响 结果见表1。与正常对照组比较,模型对照组大鼠肝脏指数显著升高(P<0.01),说明高脂饲料使得肝脏被脂肪浸润,损伤肝脏,提示高脂血症大鼠模型成立;与模型对照组比较,HLF小、中、大剂量组和辛伐他汀组肝脏指数均显著降低(P<0.05或P<0.01),并具有一定的浓度依赖性,说明HLF能够明显减轻肝脏的脂肪浸润,改善肝功能。
表1 6组大鼠肝脏指数检测值


组别剂量/(mg·kg-1)肝脏质量/g肝脏指数/%正常对照组-6.3±0.692.01±0.1模型对照组-11.6±1.122.59±0.12①辛伐他汀组810.4±1.202.41±0.19②HLF 小剂量组10010.1±1.102.31±0.21③ 中剂量组2008.9±0.792.27±0.12③ 大剂量组4009.0±0.492.24±0.11③
①与正常对照组比较,t=10.06,P<0.01;②与模型对照组比较,t=2.19,P<0.05;③与模型对照组比较,t=3.18,5.06,6.02,P<0.01。
①Compared with normal control group,t=10.06,P<0.01;②compared with model control group,t=2.19,P<0.05;③compared with model control group,t=3.18,5.06,6.02,P<0.01.
2.3HLF对高脂血症大鼠血浆血脂的影响 结果见表2。与正常对照组比较,第8周模型对照组大鼠血浆中TG、TC以及LDL-C含量明显高于正常对照组,差异有统计学意义(P<0.05),说明高脂血症大鼠模型建立成功,HDL-C含量低于正常对照组,但差异无统计学意义;与模型对照组比较,第8周HLF小剂量组和辛伐他汀组大鼠血浆中TG、TC以及LDL-C含量均显著降低,差异有统计学意义(P<0.05或P<0.01),并具有一定的浓度依赖性,其中,HLF中、大剂量组大鼠血浆中TG、TC以及LDL-C含量极显著降低,差异有统计学意义(P<0.01)。
2.4HLF对高脂血症大鼠肝脏脂肪含量的影响 结果显示,正常对照组大鼠肝细胞结构正常,胞质呈蓝色,未见明显红色脂滴;与正常对照组比较,模型对照组大鼠肝细胞内出现大量大小不等的红色脂滴,在切片的视野内可以观察到整个肝脏切面的大面积的脂滴分布;与模型对照组比较,HLF小、中、大剂量组和辛伐他汀组大鼠肝细胞红色脂滴明显减少,且HLF大剂量组大鼠肝细胞内红色脂滴减少较HLF小、中剂量组更明显。见图1。
2.5HLF对高脂血症大鼠肝脏病理变化的影响 结果显示,正常对照组大鼠肝小叶和肝细胞索结构完整、清晰,肝细胞大小均匀,无明显脂肪变性;与正常对照组比较,模型对照组的大鼠肝细胞内出现较多大小不等的脂肪滴,部分肝细胞核被脂肪滴挤压而明显偏位,脂质沉积和肝脏脂肪变性程度较为严重;与模型对照组比较,HLF小、中、大剂量组和辛伐他汀组肝小叶和肝细胞索结构较为清晰,且肝细胞内脂质沉积和肝脏脂肪变性程度明显减轻。见图2。
表2 6组大鼠血浆血脂的检测值
Tab.2 Plasma Lipid of six groups of rats

组别剂量/(mg·kg-1)TGTCHDL-CLDL-C正常对照组-0.65±0.061.48±0.351.24±0.110.50±0.11模型对照组-1.07±0.10①3.80±0.34①1.11±0.201.26±0.03①辛伐他汀组80.64±0.12②2.14±0.32②1.17±0.260.93±0.14②HLF 小剂量组1000.83±0.07②3.23±0.44③1.22±0.241.10±0.07③ 中剂量组2000.81±0.13②2.85±0.46②1.27±0.211.03±0.08② 大剂量组4000.70±0.18②2.65±0.37②1.27±0.150.89±0.06②
①与正常对照组比较,t=10.71,14.15,19.16,P<0.01;②与模型对照组比较,P<0.01;③与模型对照组比较,P<0.05。
①Compared with normal control group,t=10.71,14.15,19.16,P<0.01;②compared with model control group,P<0.01;③compared with model control group,P<0.05.
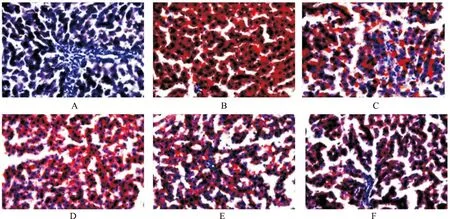
A.正常对照组;B.模型对照组;C.辛伐他汀组;D.HLF小剂量组;E.HLF中剂量组;F.HLF大剂量组。
A.normal control group;B.model control group;C.simvastatin group;D.low-dose HLF group;E.media-dose HLF group;F.high-dose HLF group.
Fig.1 Oil red O staining of liver tissues in six groups of rats (×400)
A.normal control group;B.model control group;C.simvastatin group;D.low-dose HLF group;E.media-dose HLF group;F.high-dose HLF group.
Fig.2 Image of HE staining on liver tissues in six groups of rats (×400)
2.6HLF对高脂血症大鼠肝脏AMPK、ACC蛋白表达的影响 与正常对照组比较,模型对照组大鼠AMPK蛋白表达显著性下调(P<0.01);与模型对照组比较,HLF小,中,大剂量组及辛伐他汀组AMPK蛋白表达差异无统计学意义。与正常对照组比较,模型对照组大鼠p-AMPK/AMPK蛋白表达显著性下调(P<0.01);与模型对照组比较,HLF大剂量组及辛伐他汀组p-AMPK/AMPK蛋白表达显著性上调(P<0.05或P<0.01),但HLF小、中剂量组表达差异无统计学意义。与正常对照组比较,模型对照组大鼠ACC蛋白表达显著性上调(P<0.01);与模型对照组比较,HLF小、中、大剂量组及辛伐他汀组ACC蛋白表达均差异无统计学意义。与正常对照组比较,模型对照组大鼠p-ACC/ACC蛋白表达显著性上调(P<0.01);与模型对照组比较,HLF小、中、大剂量组及辛伐他汀组p-ACC/ACC蛋白表达均显著性下调(P<0.05或P<0.01),其中HLF大剂量组p-ACC/ACC蛋白表达下调最为明显。见图3。
3 讨论
高脂血症是由各种原因导致血浆中TC、TG和(或) LDL-C过高或HDL-C过低的一种脂代谢异常性疾病,又被称为脂质异常血症[7]。近年来,随着生活水平的提高,人们饮食结构的改变,高脂血症已严重危害人类的身体健康,长期血脂过高引发机体代谢紊乱,进而产生动脉粥样硬化、冠心病、心肌梗死等心脑血管疾病,已成为全球人类健康“第一杀手”[8]。
高脂血症的预防以及治疗对降低慢性病特别是由脂质代谢异常引起的心血管疾病、肥胖以及糖尿病等是有效的。尽管西药在调脂方面一直占据主导地位,但是高脂血症患者使用西药时的不良反应以及部分患者的不耐受性,使得人们对中医药治疗高脂血症越来越感兴趣。中医药治疗高脂血症的优势在于其价格便宜,效果与西药药效相当,且副作用少[9-15]。

A.正常对照组;B.模型对照组;C.辛伐他汀组;D.HLF小剂量组;E.HLF中剂量组;F.HLF大剂量组;①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.01;③与模型对照组比较,P<0.05。

A.normal control group;B.model control group;C.simvastatin group;D.low-dose HLF group;E.media-dose HLF group;F.high-dose HLF group;①Compared with normal control group,P<0.01;②compared with model control group,P<0.01;③compared with model control group,P<0.05.

肝脏是体内代谢的重要器官之一,肝组织内含有多种代谢酶,参与机体各种代谢活动。AMPK被誉为“细胞能量感受器”[16],是一种广泛存在的丝氨酸/苏氨酸激酶,对细胞内脂质代谢具有重要的调节作用,p-AMPK/AMPK是生物能量代谢调节的关键分子,是研究高脂血症及其他代谢相关疾病的核心。ACC可以催化乙酰辅酶A生成丙二酸单酰辅酶A,是脂肪合成的限速酶[17],后两者均为前者的下游效应因子,ACC/p-ACC在脂肪酸的合成速度调节中此起着主要作用。大量研究表明,激活AMPK,抑制ACC可以改善和治疗高脂血症[18]。
本实验通过高脂饲料建立的高脂血症大鼠模型来评价HLF的调节血脂作用及其机制。经过高脂饲料诱导后,与正常对照组比较,高脂血症大鼠血浆中TC含量大幅提高(P<0.01),血清TG含量也大幅提高(P<0.01),血清LDL-C含量提高(P<0.01),肝脏指数升高,肝脏酯滴沉积明显,提示造模成功。给予HLF小、中、大剂量后,SD大鼠血清TC、TG、LDL-C的含量均明显降低(P<0.05或P<0.01),肝脏指数显著降低(P<0.05或P<0.01),肝脏脂滴沉积明显减少,提示HLF具有调节血脂作用。
综上所述,HLF可调节高脂血症大鼠血脂水平,减轻肝脏的脂肪浸润,通过调节AMPK/ACC通路在大鼠肝脏中的蛋白表达水平,并具有一定的浓度依赖性,提示其调节血脂的可能机制为:通过诱导体内p-AMPK和抑制p-ACC的表达,增加脂肪酸氧化,抑制胆固醇和减少脂肪合成来改善高脂血症。
