放线菌JXJ 0170对铜绿微囊藻的溶藻活性
2020-06-17田宝玉张炳火
肖 瑶,田宝玉,张炳火
1福建师范大学生命科学学院,福州 350000;2九江学院药学与生命科学学院,九江 332000
蓝藻水华是一个突出的世界性环境问题[1],爆发时产生的蓝藻毒素等有毒物质严重威胁人类健康[1,2],给鱼类等水产养殖业带来巨大经济损失[3]。因此,蓝藻水华的防治受到国内外的高度关注。
长期以来,蓝藻水华的防治主要依赖于CuSO4等化学杀藻剂[4]。虽然这些传统化学杀藻剂控制水华快速高效[5],但它们选择性差,抑制整个浮游生物,毒害水生动物,并导致重金属富集[5,6],造成二次污染,对水体生态系统具有潜在危害[7]。因此,寻找环境友好的新型杀藻剂具有重要的意义。
放线菌以代谢产物种类极为丰富而著称。研究表明,水陆环境中均存在大量溶藻放线菌,目前报道的主要是其中的链霉菌属,诸如不产色链霉菌(Streptomycesachromogenes)[8]、生暗链霉菌(S.phaeofaciens)[9]、脱叶链霉菌(S.exfoliatus)[10]、寝屋川链霉菌(S.neyagawaensis)[11]、灰霉素链霉菌(S.griseinus)[12]、九江链霉菌(S.jiujiangensis)[13]、庐山链霉菌(S.lushanensis)[14]和S.eurocidicus[15]等,它们对水华蓝藻具有较好的特异性,可分泌包括蛋白质[11]、氨基酸[9,13]、抗生素[16,17]和其他多种活性成分[15,18],产生溶藻作用。因此,从放线菌及其代谢产物中筛选高效环保的蓝藻水华防治剂具有很大前景。本文研究了放线菌JXJ 0170溶藻活性成分的发酵时间、孢子、胞外产物和菌丝体的溶藻效率、溶藻活性成分的部分理化性质和作用机制、发酵液对水生动物的毒性以及该菌在野外对水华的防治效果等,以评价该菌在研制蓝藻水华防治剂方面的潜力。
1 材料与方法
1.1 研究菌株、铜绿微囊藻和培养基
放线菌JXJ 0170,为本实验室从庐山土样中分离获得。铜绿微囊藻(MicrocystisaeruginosaFACHB-905),购自中国科学院武汉水生生物研究所淡水藻种库。
放线菌JXJ 0170发酵培养基和藻培养基见参考文献[19]。
1.2 溶藻菌株初步鉴定
采用插片法观察菌丝形态特征。采用溶菌酶法提取菌株基因组DNA,并扩增其16S rRNA基因序列,从数据库EzBioCloud’s Identify Service(http://www.ezbiocloud.net/identify)中调出相似性高的菌株序列,用软件CLUSTAL_X1.83进行多重序列比对,软件MEGA 5构建16S rRNA基因序列系统进化树。
1.3 菌株发酵
用无菌水洗下菌株斜面上的孢子,将孢子悬液接入液体发酵培养基中,使孢子终密度为1.0×105CFU/mL,于28 ℃、160 rpm条件下培养,每24 h取样1次,样品置于无菌离心管内离心(4 500 rpm,20 min),取上清液2 mL,加入100 mL藻液(5.0×106CFU/mL)中,空白对照组加入2 mL无菌水,培养基对照组加入2 mL无菌发酵培养基,于25 ℃、光照强度为3 000 lx的人工气候箱中静置培养,光暗比为12∶12,每天摇动4次,每次约30 s,3天后镜检藻细胞数量,每组试验做3个平行。
1.4 溶藻活性成分的理化性质
1.4.1 对热和酸碱处理的稳定性
将发酵6天的放线菌发酵上清液进行以下处理:(1)分别置于40、50、60、70、80、90和100 ℃的水浴处理2 h后,冷却至室温;(2)用1.0 mol/L的NaOH和HCl溶液,将样品pH值分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0,静置24 h后再将pH值调至原始值。取各处理样品2 mL加入100 mL藻液(5.0×106CFU/mL)中,对照组加入2 mL无菌水,培养3天后镜检藻细胞密度,每组试验做3个平行。
1.4.2 发酵产物溶藻活性
将发酵上清液减压蒸馏浓缩至原体积的1/3,用乙酸乙酯充分萃取,除去乙酸乙酯即得极性较小的脂溶性组分;萃余相减压蒸馏至膏状物后,分别先后用丙酮、甲醇和无菌水充分溶解,除去各溶剂后即分别得到丙酮、甲醇和水溶解的组分,重新减压蒸馏、称重;再将4个组分用相应溶剂重新溶解,使各组分样品浓度相同,取一定体积的样品溶液于无菌滤纸片上,使每张滤纸片含1 mg样品,待溶剂完全挥发后,再将滤纸片置于藻平板上,3天后观察溶藻圈的产生情况。
1.5 溶藻机制
1.5.1 对藻细胞形态的影响
在藻液(1.0×107/mL)中加入2%(V/V)的放线菌发酵上清液(空白对照不加),培养3天后按照参考文献[20]制样并观察藻细胞形态变化。(1)将藻液离心,收集沉淀,加入2.5%的戊二醛(用0.1 mol、pH7.0的磷酸缓冲液配制)固定藻细胞样品1 h;(2)先后采用50%、70%、80%、90%、100%的乙醇溶液对藻细胞脱水(每次脱水时间不超过5 min);(3)将样品置于盖玻片上自然干燥;(4)用扫描电镜(VEGAⅡLSU,TESCAN)对藻细胞形态进行观察。
1.5.2 对藻细胞光合作用的影响
采用密封培养装置(上有导管可通气体或加入液体样品)培养藻液,藻液(1.0×107CFU/mL)中加入2%的放线菌发酵上清液,光照条件下培养,产生的氧气通入装满液体的密闭装置(上有一根内径1 mm的两端开口的玻璃管),记录玻璃管中的水柱高度。对照组不加代谢产物。根据水柱高度判断放线菌代谢产物抑制藻细胞光合作用的效率。
1.6 孢子、发酵上清液和菌丝体的溶藻活性
根据文献[19]制造藻平板,将放线菌孢子接种于藻平板上,25 ℃、3 000 lx光照强度下静置培养,每天观察孢子萌发、菌丝生长和藻平板颜色变化情况。采用1.4中的条件培养菌株JXJ 0170,6天后离心,分别收集上清液和菌丝体备用。在藻液(5.0×106CFU/mL)中加入1%、2%和3%(V/V)的上清液,培养3天后镜检藻细胞密度。将菌丝体用无菌水洗涤3次,除去胞外产物,再在无菌条件下称取0.5、1.0、1.5和2.0 g菌丝体(湿重)分别加入100 mL藻液(5.0×106CFU/mL)中,培养3天后镜检藻细胞密度,每组试验做3个平行。以不加菌藻液为对照组。
1.7 发酵液对水生动物的毒性
取20条生长良好的彭泽鲫鱼(平均重量约50 g/条),放入45 L自来水中,并加入1%(V/V)的放线菌发酵液和100 g大米,每天换水一次,同时加入1%(V/V)的发酵液和100 g大米,连续饲喂7天,观察鱼有无中毒死亡现象,并计算死亡率。取生长良好的田螺120个(平均重量约2.87 g/个),放入5 L自来水中,并加入1%(V/V)的发酵液和50 g小白菜叶,每天换水一次,同时加入1%(V/V)的发酵液和50 g小白菜叶,连续饲喂7天,观察田螺有无中毒死亡,并计算死亡率。对照组以无菌液体发酵培养基代替放线菌发酵液,其他条件相同。试验时室温15 ℃,所有试验重复3次。
1.8 野外水华防治试验
试验池塘位于九江市郊区农村,面积约为1 660 m2,平均水深约为1.5 m,试验前在池塘中间筑坝,将池塘一分为二。两个分区水中分别于6月1日和9月1日投放硝酸钠和复合肥各50 kg,增加水中氮磷元素含量,试验组投放20 L溶藻放线菌发酵液,对照组投放20 L无菌发酵培养基,每月1号和15号于水面15~20 cm处取样一次,取样点3个,采用热乙醇法[15]测样品的叶绿素a(Chlorophyll a,Chl-a)含量。试验时间,2018年6月1日至2018年10月30日。
1.9 数据统计与分析
采用软件SPSS19.0对数据进行统计处理。确定3次重复实验的平均值(mean value)和标准偏差(standard deviation,SD),绘图数据取3次试验的平均值,试验组与对照组数据采用单因素方差分析,P≤0.05为差异显著,P≤0.01为差异极显著。溶藻效率=(1-试验组藻细胞密度或Chl-a含量/对照组藻细胞密度或Chl-a含量)×100%。
2 结果与分析
2.1 菌丝形态特征和16S rRNA基因序列分析
放线菌JXJ 0170气生菌丝灰白色,孢子丝链状,孢子卵圆形(图1)。16S rRNA基因序列(1535 bp,GenBank登录号:KY613504)分析表明,该菌是链霉菌属(Streptomyces)的成员,且与S.anulatusNRRL B-2000T、S.cyaneofuscatusNRRL B-2570T、S.fulvissimusDSM 40593T和S.luridiscabieiNRRL B-24455T的亲缘关系最近,相似性均为99.93%,然而该菌仅与S.cyaneofuscatus和S.griseussubsp.griseusKCTC 9080T聚在一大支上(图2),而与其它三株菌聚在不同分支上,因此,该菌的确切分类学地位尚需要进一步的试验数据。
2.2 菌株溶藻发酵时间
如图3所示,试验条件下培养3天后,空白对照组藻细胞密度由5.0×106CFU/mL增加到1.41×107CFU/mL,发酵培养基对照组(即未接菌的培养基)藻细胞密度只有空白对照组的78.51%,溶藻效率为21.49%(P<0.01),这说明发酵培养基中的一些成分对藻细胞生长有抑制作用,但这些物质随着孢子的萌发与菌丝生长而被消耗。因此,接种培养1天后的发酵上清液对藻细胞基本没有溶藻活性,2天后的发酵上清液甚至促进了藻细胞的生长,但此后发酵液的溶藻活性迅速增加,5天后到达91.85%(P<0.01),6天后变化不大,8天后略有下降。因此,确定该菌发酵时间为6天。

图1 放线菌JXJ 0170培养4天后的孢子丝扫描电镜照片Fig.1 Scanning electron micrograph of spore chains of actinomycete JXJ 0170 after culturing for four days

图2 以邻接法构建菌株JXJ 0170系统进化树Fig.2 Neighbour-joining phylogenetic tree based on 16S rRNA gene sequences of strain JXJ 0170 注:>50%的步长值(以重复1 000次的百分率表示)在节点处标注;标尺:0.05%的序列分歧度。Note:Bootstrap values (expressed as percentages of 1 000 replications) > 50 % are shown at the nodes.Bar,0.05% sequence divergence.

图3 菌株JXJ 0170不同发酵时间上清液的溶藻效率Fig.3 Alga-lysing efficiency of fermentation broth supernatant of strain JXJ 0170 at different culture time注:**表示试验组与对照组在P<0.01水平上差异显著。Note:** indicated the significant differences between the controls and the tests at the level P<0.01.
2.3 溶藻活性成分的理化性质
2.3.1 对热和酸碱处理的稳定性
如图4所示,未进行热处理的试验组(28 ℃)藻细胞密度为1.20×106CFU/mL,为对照组1.43×107CFU/mL的8.49%,即溶藻效率为91.51%;处理温度≤70 ℃时,发酵上清液的溶藻活性没有显著变化,溶藻效率在90.23%以上,达到未处理组溶藻效率的98.60%以上;但处理温度分别为80~100 ℃时,发酵上清液的溶藻活性比未处理组降低了4.38%~31.78%(P<0.05或P<0.01)。如图4所示,在pH7.0~8.0时发酵上清液溶藻效率最高,约为91.37%,当处理pH≤7.0时,发酵上清液的溶藻效率随pH值的增加而增加,当处理pH≥8.0时,发酵上清液的溶藻效率随pH值的增加而降低。
2.3.2 发酵产物溶藻活性
试验结果显示,乙酸乙酯和丙酮溶解的样品没有形成溶藻圈,甲醇溶解的样品形成的溶藻圈直径约为1.7 cm(图5 C),而水溶性成分形成的溶藻圈直径约为3.5 cm(图5 D),这说明菌株JXJ 0170产生的溶藻活性成分主要是水溶性物质。
2.4 溶藻机制
2.4.1 对藻细胞形态的影响
扫描电镜观察结果(图6)显示,空白对照组的藻细胞球形,表面有黏液,且有大量细胞正在分裂繁殖;而加了菌株JXJ 0170发酵产物的试验组藻细胞变形,且其表面粘性物质丧失,细胞壁和细胞膜穿孔,最终藻细胞裂解死亡。
2.4.2 对藻细胞光合作用的影响
试验结果显示,培养6 h后,空白对照组的藻细胞培养装置壁上有大量气泡,其玻璃管中的液柱高度为27.58±0.85 cm;而加了菌株JXJ 0170发酵产物的试验组藻培养装置的壁上没有气泡,其玻璃管中的液柱高度仅为8.18±0.37 cm,仅为空白对照组的29.66%(P<0.01),即6 h内菌株JXJ 0170发酵产物对藻细胞光合作用的抑制率达到70.34%,这说明该菌发酵产物对铜绿微囊藻的光合作用具有较强的抑制作用。

图4 不同温度和pH处理后的发酵上清液的溶藻效率Fig.4 Alga-lysing efficiencies of fermentation broth supernatant treated with different temperatures and pH values注:**表示试验组与对照组在P<0.01水平上差异显著,*和**分别表示未处理组与处理组在P<0.05和P<0.01水平上差异显著。Note:** indicated the significant differences between the controls and the tests at the level P<0.01;* and ** indicated the significant differences between the untreated groups and the treated groups.

图5 菌株JXJ 0170发酵产物的溶藻活性Fig.5 Alga-lysing activities of fermentation substances of strain JXJ 0170 注:A、B、C和D分别为乙酸乙酯、丙酮、甲醇和水的提取物。Note:A,B,C and D,extracted by acetic ether,acetone,methanol and H2O,respectively.

图6 菌株JXJ 0170代谢产物对藻细胞形态的影响Fig.6 The influences of metabolites produced by strain JXJ 0170 on the morphology of algae cells 注:A和B分别为对照组和试验组的藻细胞。Note:A and B are the cells in control and test groups,respectively.
2.5 孢子、发酵上清液和菌丝体的溶藻活性
2.5.1 孢子的溶藻活性
菌株JXJ 0170的孢子在藻平板上能够萌发生长,并形成溶藻圈,随后其生长范围和溶藻圈直径均逐渐扩大,15天后单菌落溶藻圈直径为12.71 mm,25天后溶藻圈直径达到29.42 mm,这说明该菌株孢子在缺乏有机碳源的组合培养基中能够正常萌发、直接杀死藻细胞,并利用藻细胞裂解后释放的有机物作为营养成分继续生长,再产生溶藻活性成分,进而发挥活性成分溶藻作用。
2.5.2 发酵上清液和菌丝体的溶藻活性
如图7所示,发酵上清液和菌丝体均有良好的溶藻活性,且呈剂量效应。当上清液剂量为1.0%(V/V),3天后藻细胞密度为2.8×106CFU/mL,是对照组1.31×107CFU/mL的21.37%,即溶藻效率为78.63%,当剂量为3.0%时,溶藻效率达到96.70%;在藻液中加入0.5 g菌丝体,3天后溶藻效率为50.51%,当使用剂量增到2.0 g时,溶藻效率达到93.39%。
2.6 发酵液对水生动物的毒性
试验结果显示,试验组和对照组的鲫鱼生长均正常,未出现死亡,这说明菌株JXJ 0170及其代谢产物对鲫鱼的生长没有不利影响,不会导致鱼类中毒死亡。田螺试验结果表明,试验组和对照组的田螺死亡率分别为7.22%±1.92%和6.67%±3.00%,没有显著差异(P>0.05),因此,菌株JXJ 0170及其发酵产物对软体动物田螺也没有显著性致死作用。
2.7 野外防治试验
如图8所示,在试验期间,试验组池塘中的水没有出现明显颜色变化,水面水样虽然有悬浮颗粒存在,但基本无色,且透明(图8 A);对照组池塘水的颜色逐渐变绿,其水面水样深蓝绿色,不透明,水面漂浮一层蓝绿色的浮膜(图8 B)。水面15~20 cm下的水样,对照组叶绿素a含量在试验期间,由起始0.008 8±0.001 6 mg/L逐渐增加到0.126 0±0.008 1 mg/L,而试验组叶绿素a含量为0.005 8±0.000 3~0.023 7±0.000 5 mg/L(图9),只有对照组的6.20%~24.20%,对水华的防治效率为75.80%~93.80%。
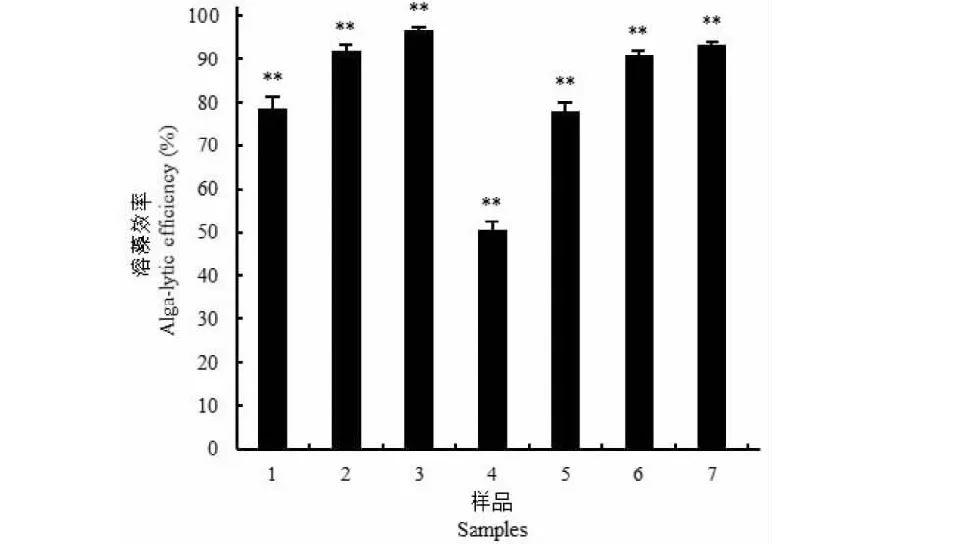
图7 菌株JXJ 0170发酵上清液和菌丝体的溶藻效率Fig.7 Alga-lysing efficiencies of fermentation broth supernatant and mycelia of actinomycete strain JXJ 0170注:1~3分别为1%、2%和3%的发酵上清液;4~7分别是湿重为0.5、1.0、1.5和2.0 g的菌丝体。**表示试验组与对照组在P<0.01水平上差异显著。Note:1-3 were the fermentation broth supernatant of 1%,2% and 3%,respectively;4-7 were mycelia of wet weight 0.5,1.0,1.5 g and 2.0 g,respectively.** indicated the significant differences between the test and control at the level P<0.01.

图8 试验组和对照组池塘的表面水样颜色Fig.8 Surface water color of the ponds of the experimental group and control group 注:A和B分别为试验组和对照组的池塘水面。Note:A and B and the surfaces of test and control ponds,respectively.
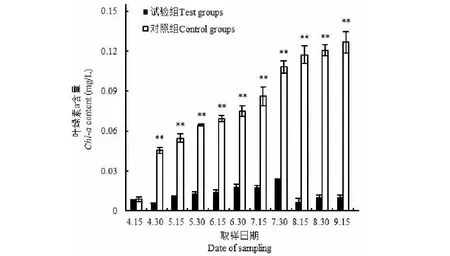
图9 野外水华防治的试验组和对照组叶绿素a含量Fig.9 The chlorophyll a contents of the experimental group and control group of water bloom prevention and cure in the wild注:**表示试验组与对照组在P<0.01水平上差异显著。Note:** indicated the significant differences between the test and the control at the level P<0.01.
3 讨论与结论
放线菌JXJ 0170是链霉菌属的成员,与该菌16S rRNA基因序列亲缘关系最近的链霉菌均未见溶藻活性的报道,这说明该菌是一株新的溶藻链霉菌。
微生物一般可通过两种作用方式溶藻:微生物细胞接触藻细胞后导致藻细胞溶解,即直接溶藻[21]、通过分泌活性成分而导致藻细胞溶解,即间接溶藻[9]。目前文献报道的放线菌一般通过分泌活性成分而发挥溶藻作用[9,11,15-18]。本研究表明,菌株JXJ 0170发酵上清液具有很强的溶藻活性,且具有一定的剂量效应,这说明该菌能通过分泌活性成分而发挥间接溶藻作用;同时,该菌的菌丝体和孢子也具有很强的溶藻活性,特别是其孢子在藻平板上能够萌发,并表现出良好的溶藻活性,这说明该菌亦具有直接溶藻作用。
目前文献报道的链霉菌分泌的溶藻活性成分,多是热稳定性和酸碱稳定性较好的非蛋白质物质[9,15-18]。菌株JXJ 0170分泌的溶藻活性成分对高温和酸碱处理相对较稳定,这说明该活性成分也是非蛋白质性质的,但具体是何种物质还需要进一步的研究。
链霉菌产生的溶藻活性化合物能够促进藻细胞活性氧的产生,抑制其抗氧化剂的合成,破坏叶绿素a、细胞膜和细胞壁[15],最终导致藻细胞死亡,本研究结果也证明了这一点。
Sigee等[10]研究表明,脱叶链霉菌(S.exfoliatus)RG12在实验室可控条件下具有很强的溶藻活性,但在野外条件下,其溶藻活性大大降低,因而难以用来防治蓝藻水华。本研究表明,菌株JXJ 0170无论在实验室可控条件下,还是在野外全开放条件下,均具有较好的溶藻效果,且该菌的溶藻作用方式多样,对鱼类和软体动物等水生经济动物生长没有不良影响,因此,该菌在研制高效、环保的放线菌源蓝藻水华防治剂方面具有较大的潜力。
