COX-2抑制剂联合顺铂通过Wnt/β-catenin信号通路对肺癌细胞增殖与凋亡的影响
2020-06-15赵一波
赵一波 邢 述
肺癌无论是发病率还是死亡率均高居全世界恶性肿瘤之首。虽然当今肺癌治疗手段有很大发展,但其预后仍然较差。以铂类为主的联合化疗方案仍然是目前肺癌治疗的重要手段,常规化疗虽然取得了较大的进步,但是大剂量、多疗程、多联合化疗会加剧患者毒副作用、严重抑制免疫系统,使得机体的免疫力下降,严重损伤患者的机体。同时化疗药物产生的耐药性成为肺癌治疗的难点[1]。肺癌的发病是1个多因素、多阶段、多基因及多信号通路共同作用的复杂机制,Wnt/β-catenin信号通路的异常激活在肺癌的发生、发展中也起着重要作用[2]。近年来COX-2抑制剂的抗肿瘤作用日益受到人们的关注,其可以通过多种途径对肿瘤生长产生抑制作用[3]。因此,本研究拟以肺腺癌A549细胞系为研究对象,研究探讨COX-2抑制剂(塞来昔布)联合顺铂对肺腺癌细胞增殖和凋亡的影响,以及与Wnt/β-catenin信号通路之间的关系,为两药联合应用临床治疗肺癌提供实验和理论依据。
1 材料与方法
1.1 主要药品和试剂
人肺腺癌A549细胞株购于中科院上海细胞库,塞来昔布胶囊(西乐葆)(0.2g,辉瑞制药有限公司,批准文号:国药准字J20180063),注射用顺铂(冻干型)(10mg,齐鲁制药有限公司,批准文号:国药准字H20183652);RT-PCR试剂盒购于日本TaKaRa公司,MTT试剂盒购于美国Sigma公司;兔抗人Wnt、β-Catenin和c-myc单克隆抗体均购于美国Abcam公司,GAPDH单克隆抗体、FITC标记羊抗兔IgG购于武汉博士德生物工程有限公司;Hoechst3358试剂染液购于北京百奥莱博科技有限公司,TUNEL试剂盒购于美国罗氏公司,ABI Prism7500型荧光定量PCR仪购于美国应用生物系统公司,流式细胞仪购于美国CST公司。
1.2 方法
1.2.1 人肺腺癌A549细胞培养 肺腺癌A549细胞株培养于含10%胎牛血清、青链霉素(青链霉100 U/ml,链霉素100 μg/ml)的RPMI-1640培养基,于37 ℃、95%饱和湿度,5% CO2培养箱,每2 d更换一次培养基,实验均取处于对数生长期的细胞,制备成单细胞悬液。
1.2.2 细胞药物处理及分组 塞来昔布去除糖衣后溶解于DMSO制成浓度为0.1 mmol/l母液,实验用PBS溶液稀释至目标浓度,保持终溶液DMSO浓度<0.1%。取对数生长期肺腺癌A549细胞5×105/ml接种于6孔板,培养24 h后吸出孔内培养液,加入相应药物,实验分组:对照组(不加任何药物);塞来昔布组(塞来昔布;25 μmol/l);顺铂组:(顺铂;1 mg/l);联合组:(塞来昔布;25 μmol/l+顺铂;1 mg/l),均以RPMI 1640培养液配置浓度。
1.2.3 甲基偶氮哇盐法(MTT)检测细胞细胞活力检测 取对数生长期细胞制成单细胞悬液,每孔按100 μl(1×104/孔)接种于96孔培养板中培养,24 h后分别加入不同处理药物及全培养液的空白对照组,置常规培养箱中培养48h后,分别培养0 h、24 h、48 h、72 h时间后每孔加入MTT溶液20 μl(50 mg/ml),37 ℃孵育4 h;去除上清液,每孔加150 μlDMSO,酶标仪检测每孔波长490 nm吸光度值(A值),求其平均值,并计算细胞抑制率,抑制率(E)=(1-实验组平均A值/对照组平均A值)×100%,并绘制细胞生长抑制曲线。
1.2.4 流式细胞术检测细胞周期的变化 接种A549细胞24 h后分别加药,48 h后收集细胞,PBS洗2次,参照检测试剂盒说明书逐步操作,最后流式细胞仪上机检测,采用软件分析细胞周期分布变化。
1.2.5 Hoechst3358染色法检测细胞凋亡率 接种A549细胞24 h后加药,48 h后收集不同处理组细胞,4%多聚甲醛固定20 min,添加10 μg/ml Hoechst3358的染液,37 ℃孵育30 min,荧光显微镜观察随机选择至少10个观察视野,计算细胞凋亡率(%)=凋亡阳性细胞数/细胞总数。
1.2.6 免疫荧光法检测细胞Wnt、β-Catenin蛋白的表达 以5×105/ml细胞接种盖片上,24 h后分组处理,孵育48 h后,取出细胞爬片,预温PBS洗涤,4%预冷多聚甲醛固定20 min,PBS洗涤;0.2% Triton X-100通透10 min,PBS洗涤;山羊血清封闭30min,PBS洗涤;添加Wnt和β-Catenin一抗(1∶200),4 ℃湿盒过夜,PBS洗涤;FITC标记二抗(1∶200),37 ℃避光孵育1.5 h,PBS洗涤;甘油封片,荧光显微镜采片。
1.2.7 Real-Time PCR方法检测Wnt、β-Catenin和c-myc的mRNA水平 参照Trizol试剂说明书操作提取总RNA,-80 ℃保存备用,鉴定总RNA浓度及纯度。采用Real-Time PCR试剂盒,按照上面反应体系进行cDNA的合成逆转录反应体系。基因引物序列:GAPDH:上游5'-CAGAGTGGACGGATTTTGGTCCTAT-3',下游:5'-ATCCTTCTCAATCGTGGTGATGTC-3';Wnt:上游:5'-CAGTGAGCTGGTTGTCACCT-3',下游:5'-CTGAGCTGCTCCTTGAAGTG-3';β-Catenin上游:5'-CAAGGAGCAGGTAATCGCAAGT-3',下游5'-GGAACCAGAATGGGAGAAACG-3';c-myc:上游:5'-TGAGGAAACGAC GAGAACAG-3',下游:5'-ACGAGAGATTCCAGCTCCCTTGATTCAAACGC-3'。ABI Prism7500型荧光定量PCR仪中扩增,反应条件:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火2 min,40个循环。以内参GAPDH进行标准化,采用2-△△Ct法计算基因的相对表达量。
1.3 统计学分析
2 结果
2.1 细胞增殖能力
塞来昔布组、顺铂组、联合组较对照组细胞抑制率增高,细胞增殖能力下降(P<0.05),尤以联合组细胞抑制率最高,细胞增殖能力最低(P<0.05);且各组对细胞的杀伤效应呈时间依赖性,见图1。

图1 MTT检测各组细胞增殖生长状况
2.2 细胞周期变化
塞来昔布组、顺铂组、联合组较对照组处于G0/G1期细胞增多(P<0.05),以联合组处于G0/G1期细胞最多(P<0.05);塞来昔布组、顺铂组S期、G2期细胞减少(P<0.05),以联合组处于S期、G2期细胞最少(P<0.05),见表1。
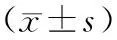
表1 流式细胞仪检测细胞周期变化
注:※为与对照组比较,P<0.05。
2.3 细胞凋亡率
对照组细胞较多,无边聚,胞质染色均匀一致,荧光较弱;联合组细胞较少形态饱满,形状规则,染色较深、染色质浓集、荧光强,细胞核呈现核固缩浓染,核分叶呈月牙状或蚕豆状,碎裂呈米粒状大小不等的碎片,形成凋亡小体。对照组、塞来昔布组、顺铂组、联合组凋亡率分别为:(0.78±0.04)%、(32.56±1.67)%、(25.67±1.98)%、(63.37±2.12)%。塞来昔布组、顺铂组、联合组较对照组细胞凋亡率增高(P<0.05),尤以联合组细胞凋亡率最高(P<0.05)。
2.4 Wnt、β-Catenin和c-myc的蛋白表达
Wnt主要表达于A549细胞胞膜和胞质,β-Catenin主要表达于A549细胞胞质,c-myc主要表达于A549细胞胞质。对照组细胞Wnt、β-Catenin和c-myc荧光很强,塞来昔布组和顺铂组荧光强度减弱,联合组荧光强度显著减弱。塞来昔布组、顺铂组、联合组较对照组细胞Wnt、β-Catenin和c-myc的蛋白均降低(P<0.05),以联合组降低最显著(P<0.05),见表2。
2.5 Wnt、β-Catenin和c-myc的mRNA表达
塞来昔布组、顺铂组、联合用药组较对照组细胞Wnt、β-Catenin和c-myc的mRNA表达均降低(P<0.05),其中以联合组降低最显著(P<0.05),见表3。
3 讨论
非小细胞肺癌(NSCLC)约占肺癌总数的80%。含铂化疗方案是目前NSCLC一线标准化疗方案[4]。而目前化疗药物由于缺乏特异性,毒性反应成为使用剂量受到限制的关键因素,且化疗过程中耐药现象,同时也使患者的依从性和耐受性降低,影响远期疗效和患者的生存质量。环加氧酶(cyclo-oxygenase,COX-2)过度表达与肿瘤的发生、发展密切相关,COX-2促进合成大量前列腺素,提高肿瘤的免疫耐受,降低宿主抗恶性肿瘤免疫监视,导致肿瘤细胞增殖[5]。COX-2抑制剂可抑制其催化产物前列腺素E2的合成,促进干扰素γ及TNF-α产生而恢复和维持免疫平衡,提升免疫监视功能,增加细胞杀伤能力,抑制肿瘤生长,发挥增强免疫的机制[6]。选择性COX-2抑制剂塞来昔布已经证实其对多种肿瘤细胞有很好的抑制作用,化疗药物联合选择性COX-2抑制剂可降低单纯化疗药物所引起的不良反应,具有协同化疗药物通过调节细胞因子,增强机体细胞免疫,杀伤抑制癌细胞生长,从而增强化疗药物敏感性及疗效,还可以减轻化疗药物的毒性,克服化疗药物的耐药性问题[7]。
Wnt/β-catenin信号通路在肺癌发病中发挥了非常重要的作用,其依赖于β-catenin表达调控,参与多种肿瘤的发生、发展的相关作用机制,涉及肿瘤细胞信号传导、细胞周期、细胞增殖、凋亡以及细胞黏附、浸润、转移等一系列过程[8]。Wnt信号异常活化,转导细胞内的信号,Wnt配体与其受体结合,β-catenin被活化,在胞浆异常大量聚集,并进入胞核,并与Axin-APC-GSK-3β形成复合物,与核内转录因子T细胞因子(TCF)/淋巴结增强因子(LEF)相结合,激活下游cyclinD1、Survivin、c-myc等细胞周期相关靶基因的转录,导致肿瘤细胞异常增殖、浸润和转移[9-10]COX-2抑制剂通过药抑制肿瘤细胞胞质内β-catenin向核内转移,减少Wnt/β-catenin信号通路下游靶基因异常表达,从而抑制肺癌的发展[11]。
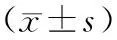
表2 免疫荧光检测A549细胞Wnt、β-Catenin和c-myc的表达
注:※为与对照组比较,P<0.05。
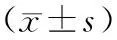
表3 RT-PCR法检测A549细胞Wnt、β-Catenin和c-myc的mRNA表达
注:※为与对照组比较,P<0.05。
本研究表明,COX-2抑制剂(塞来昔布)和顺铂单独及联合应用均能抑制肺癌细胞增殖,促进癌细胞凋亡,降低Wnt、β-Catenin和c-myc蛋白表达,下调Wnt、β-Catenin和c-myc的mRNA表达,且两药联合效应优于各自单独用药,表明两药联合应用可以共同抑制COX-2-Wnt/β-catenin信号通路,进而抑制其下游靶基因c-myc水平表达。因此,Wnt/β-catenin信号通路的活化状态的变化必然会引起其下游靶基因c-my水平的变化。王玲婵等[12]研究表明艾瑞昔布联合洛铂能够抑制非小细胞肺癌侵袭和转移,艾瑞昔布对洛铂化疗可能具有增敏作用。熊建萍等[13]研究发现COX-2抑制剂塞来昔布联合顺铂可增强对A549人肺腺癌细胞的生长抑制效应。陈刚等[14]研究表明塞来昔布可抑制人肺癌裸鼠移植瘤的生长和血管生成。塞来昔布与奥沙利铂联合应用提高了奥沙利铂的抗肿瘤效果。
综上所述,塞来昔布联合顺铂可协同抑制肺癌细胞生长增殖,促进细胞凋亡,发挥协同抗肿瘤作用,其作用机制可能为两药通过共同抑制Wnt/β-Catenin信号通路,进而发挥协同抗肿瘤的效应。为临床上两药联合应用治疗肿瘤患者提供一定的实验及理论基础。随着本研究的不断深入,Wnt/β-catenin信号通路调控肺癌的关系网络将更加清晰,将更加全面揭示COX-2抑制剂抑制肿瘤,联合化疗药增效的作用机制,为塞来昔布治疗肺癌提供新的实验依据。同时,塞来昔布的最佳剂量、毒副反应等也尚有待于动物实验以及临床实验进一步研究证实。
