荷斯坦牛HH5遗传缺陷基因快速检测方法的建立及应用
2020-06-13孙愉洪王铭正肖炜张胜利张毅
孙愉洪,王铭正,肖炜,张胜利,张毅
(1.中国农业大学动物科技学院,北京 100193;2.北京市畜牧总站,北京 100107)
在过去几十年里,奶牛经高强度选育,产奶性能持续提升,但与此同时,群体近交程度不断增加,隐性有害基因快速扩散风险增大[1]。HH5是新近发现的一种荷斯坦牛隐性遗传缺陷基因,美国农业部最早通过全基因组标记分析,将其定位于牛9号染色体[2],后续深入研究揭示致病机理为9号染色体上长达138kb的DNA片段缺失,导致二甲基腺苷转移酶1(TFB1M)基因丢失[3]。突变型纯合个体因缺少TFB1M基因导致核糖体功能障碍,最终造成该基因型的胚胎在妊娠60d左右死亡。HH5基因的共同祖先为1957年出生的加拿大著名公牛Thornlea Texal Supreme[3,4],其基因在世界范围内广泛扩散,奶业发达国家已将HH5列为常规检测的遗传位点。
目前,HH5遗传缺陷基因的检测方法较为繁琐或成本较高,如基于高分辨率溶解曲线的检测方法[3]虽然可以准确分型,但需要专门仪器和试剂盒,检测成本很高。此外,有国外商业公司(如Neogen)也提供HH5检测服务,但检测周期较长。本研究通过测序发现HH5等位基因包含一段特异性序列,在此基础上建立一种快速、简便的筛查HH5遗传缺陷基因携带者的新方法,并对北京郊区一个荷斯坦牛群进行了检测。

表1 HH5突变型和野生型等位基因Sanger测序引物信息
1 材料与方法
1.1 HH5突变型和野生型等位基因Sanger测序
1.1.1 样本及DNA提取
利用中国农业大学荷斯坦牛基因组信息数据库,依据经单倍型推断[2]的HH5基因型信息,挑选53头荷斯坦公牛,其中野生型纯合子46头,HH5携带者7头。基因组DNA提取自公牛冻精,采用高盐法[5]。
1.1.2 引物设计及PCR条件
基于已知的HH5遗传缺陷基因突变(138kb缺失)所在牛参考基因组(Bos taurus genome assembly UMD3.1)上的位置(BTA9:93.23~93.37Mb)[3],提取该缺失片段前后两个断裂位点附近的参考基因组序列,设计特异性引物(表1)。
PCR反应体系:总体积25μL,其中10×Buffer 2.5μL ,dNTP混合物(各2.5mmol/L)2μL,Taq酶(5U/μL)0.5μL,上下游引物(20μmol/L)各0.5μL,基因组DNA模板1μL(50ng),ddH2O补至25μ L。
PCR反应条件:94℃预变性5min;然后35个循环,94℃变性30s,60℃或55℃(表1)复性30s,72℃延伸30s;最后72℃延伸7min。
1.1.3 PCR产物Sanger测序
Wild-head引物组合的PCR产物,利用下游引物HH5-1Rnew进行测序;Wild-end引物组合的PCR产物,利用上游引物HH5-2F进行测序;Mutant引物组合的PCR产物,利用内部引物HH5mutF(5’-AAAATACTGG TTTGTTTTGC-3’)进行测序。
1.2 荷斯坦牛HH5遗传缺陷基因检测方法
本研究设计采用等位基因特异性PCR对HH5进行分型,优化双重PCR条件,在一个PCR体系中同时扩增野生型等位基因和突变型等位基因。
1.2.1 样本
从上述测序样本中选取野生型和HH5携带者各2头。
1.2.2 引物设计
通过Oligo6引物设计软件(https://www.oligo.net/),基于上述测序获得的野生型等位基因和突变型等位基因部分序列,结合参考基因组序列,设计等位基因特异性引物(图1),引物序列及PCR产物长度见表2。
HH5-2F与HH5-2Rshort引物组合用于特异性扩增野生型等位基因,HH5-1F与HH5-1mutRnew引物组合用于特异性扩增突变型等位基因。

图1 HH5突变型和野生型等位基因特异性PCR分型引物位置示意图

表2 HH5突变型和野生型等位基因特异性PCR分型引物信息
1.2.3 PCR反应体系
反应体系:总体积25μL,其中金牌Mix快速PCR预混液(内含缓冲液、dNTP、Taq酶)(北京擎科新业生物技术有限公司)22μL,4条引物(浓度均为10μmol/L)各0.5μL,基因组DNA模板1μL(约50ng)。
反应条件:94℃预变性5min;然后35个循环,94℃变性30s,56℃复性30s,72℃延伸30s;最后72℃延伸7min。
1.2.4 PCR产物凝胶电泳检测
制作浓度为2%的琼脂糖凝胶,取PCR产物4μL点样,在TAE缓冲液中110V电压下电泳20min。
1.3 HH5携带率分析
从北京延庆某奶牛场,随机采集372头荷斯坦母牛血液样本,采用天根DP318试剂盒(天根生化科技(北京)有限公司)提取基因组DNA。通过本研究建立的等位基因特异性PCR分型方法检测HH5基因型。
2 结果与分析
2.1 HH5野生型及突变型等位基因序列
将Sanger测序获得的野生型等位基因的部分序列与牛参考基因组(Bos taurus genome assembly UMD3.1)比对,确认序列一致。比较突变型等位基因序列与野生型等位基因序列,发现突变型等位基因可以分为三部分,最前面部分(AACCATTCAA)对应于野生型等位基因序列的前端,最后面部分(TTACA ATGAT)对应于野生型等位基因序列的尾端,中间部分为1个9bp序列(TGATTACAA)(图2)。
Wild type (left)为138kb缺失片段前端(3'端)断裂位点附近的野生型等位基因序列,Wild type (right)为138kb缺失片段后端(5'端)断裂位点附近的野生型等位基因序列,Mutant type为突变型等位基因序列。
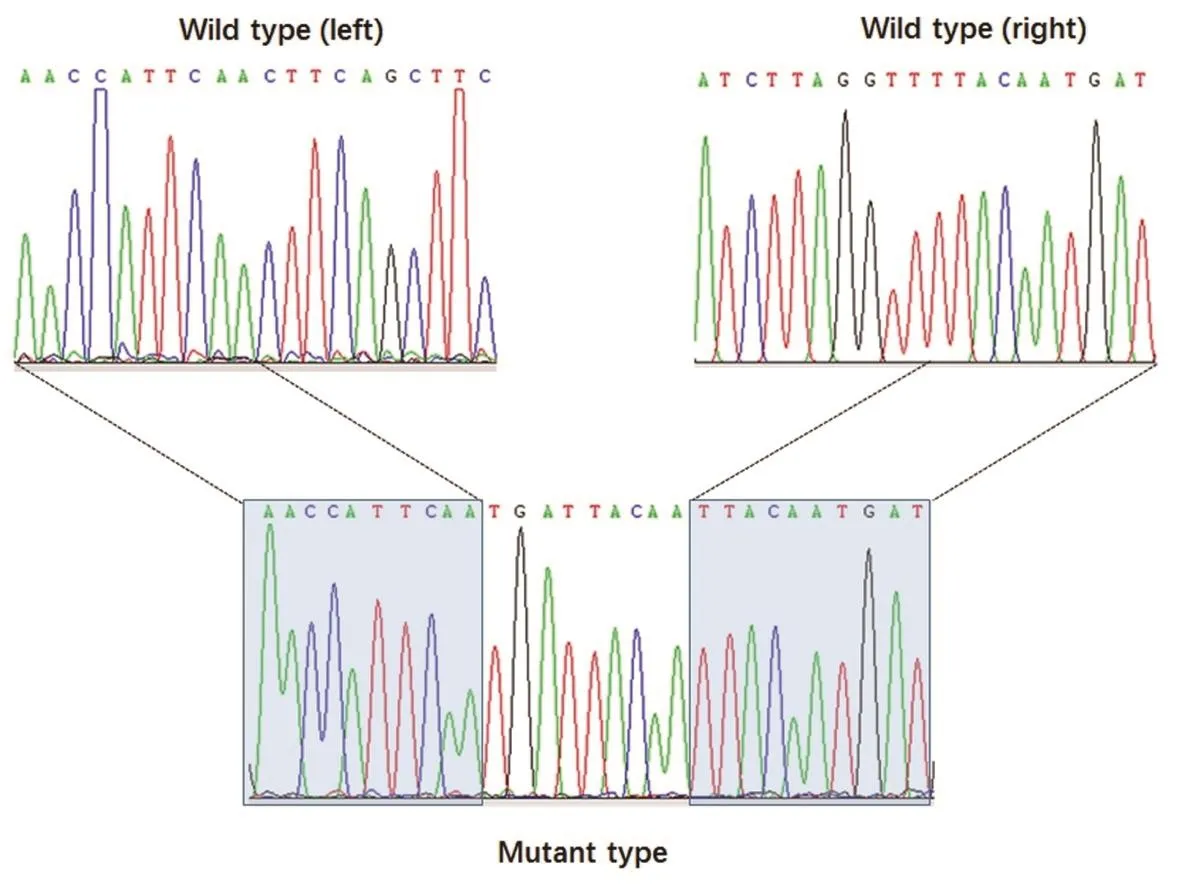
图2 HH5野生型及突变型等位基因Sanger测序结果示意图
2.2 HH5等位基因特异性PCR产物的电泳结果
HH5等位基因特异性PCR扩增产物经琼脂糖凝胶电泳,电泳图显示扩增产物符合预期,野生型纯合子仅出现一条209bp条带,而携带者出现209bp和347bp两种条带(图3),表明本研究设计的2对引物组合可以用于准确鉴别荷斯坦牛是否携带HH5遗传缺陷基因。
通过观察电泳图(图3)发现,在目的条带下方,各泳道都存在明显的引物二聚体条带,但不影响对基因型的判断。
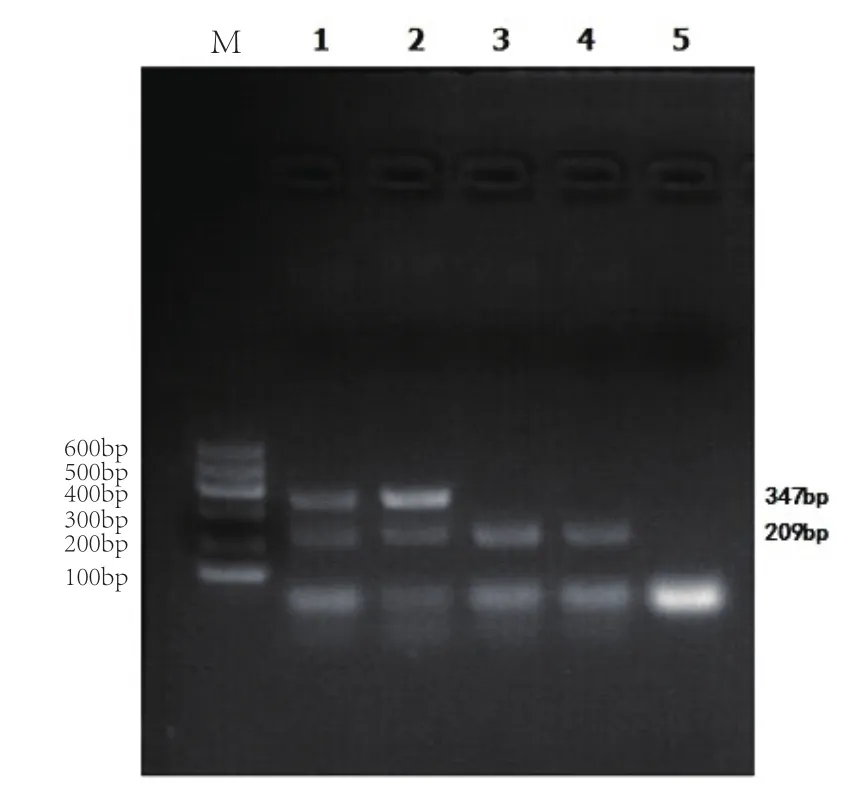
图3 HH5等位基因特异性PCR产物琼脂糖凝胶电泳结果
2.3 荷斯坦母牛群HH5携带率分析
在372头荷斯坦母牛中,检出12头HH5携带者,携带率为3.23%。为了验证分型结果准确性,本研究对所有12头携带者和5头随机挑选的非携带者进行Sanger测序,结果与PCR分型的结果完全一致,证明本研究建立的等位基因特异性PCR分型方法的可靠性。
3 讨论
过去20多年的时间里,在荷斯坦牛中已先后报道了多种遗传缺陷基因,包括白细胞黏附缺陷(BLAD)[6]、脊柱畸形综合征(CVM)[7,8]和短脊柱畸形综合征(Brachyspina)[9]等。近年来,随着奶牛全基因组标记数据的积累,多种新的有害基因被鉴定出来,例如HH1~HH5[10~12]。HH5是当前荷斯坦牛中一种常见的遗传缺陷基因,在美国和德国牛群中频率分别达到2.22%[12]和2.76%[13]。本研究在北京郊区372头荷斯坦母牛中,检出12头HH5携带者,携带率为3.23%。尽管本研究样本量较小,但显示HH5已经存在于我国牛群中,奶牛场需要关注其负面影响。
HH5缺陷基因的分子机理为9号染色体上138kb大片段缺失,造成二甲基腺苷转移酶1(TFB1M)基因丢失[3],本研究通过Sanger测序验证了突变型与野生型的序列差异,并发现突变型除了缺失138kb大片段之外,还发生了1个9bp序列(TGATTACAA)的插入(图2)。TFB1M基因对于线粒体中启动蛋白翻译至关重要,其主要功能是使位于线粒体12S rRNA 3'端发夹环的腺嘌呤残留发生二甲基化,此过程对核糖体小亚基的合成和生物功能起决定性作用[14]。HH5呈常染色体隐性遗传,缺陷型等位基因携带者表现正常,但若携带者公牛与携带者母牛之间交配,1/4后代为隐性纯合子,可导致胚胎发育早期死亡。德国学者研究显示,HH5缺陷基因纯合子胚胎在发育56~90d之间死亡,风险交配(母牛的父亲及母牛的与配公牛均为携带者)较非风险交配(均为非携带者)可导致青年牛和成母牛56d非返情率分别下降5.4%和8.9%[13]。以母牛一次流产的经济损失200美元[12]测算,遗传缺陷为奶牛繁殖带来的负面效应相当可观,因此亟需采取科学选配方法,避免因风险交配导致的有害基因纯合。
采用有效手段筛查有害基因携带者是科学选配的前提。本研究针对突变型和野生型等位基因的序列差异,建立了一种基于等位基因特异性PCR检测方法,通过常规PCR反应及琼脂糖凝胶电泳即可准确分型(图3)。与已报道的高分辨率溶解曲线的检测方法[3]相比,具有简便、易操作、低成本的优点。此外,本研究通过引物设计优化,实现两对引物在同一个反应体系中完成,大幅提高了检测效率,为在我国奶牛场开展针对HH5缺陷基因的科学选种和选配提供了技术手段。
