双酶法制备牡蛎干酶解液及其体外抗氧化活性评价
2020-06-13庞忠莉郑建仙
庞忠莉 - 郑建仙 -
(华南理工大学食品科学与工程学院,广东 广州 510640)
牡蛎又称海蛎子、蚝,是中国卫生部首批药食两用原料之一[1]。牡蛎中富含蛋白质、糖原、多不饱和脂肪酸和多种人体必需氨基酸等生物活性物质。干牡蛎肉中蛋白质含量高达 45%~57%,其中必需氨基酸质量比例和完善程度要优于人乳和牛乳[2],糖原含量为20%~40%,脂肪仅占7%~10%。
蛋白质通过酶工程技术加工可获得富含多种氨基酸及小分子多肽的酶解物。相较于蛋白质,小分子多肽具有提供能量迅速、消化吸收利用率高、促进物质代谢、低毒性和低免疫原性等优点[3]。利用动物蛋白水解酶和风味蛋白酶对动物蛋白水解,具有水解效率高,产物风味好、苦味低的特点[4-5]。因此,酶解技术的应用一直是牡蛎高值化开发的重要手段,尤其是利用牡蛎蛋白制备生物活性肽一度成为研究者们关注的热点。目前已有的研究大多以新鲜牡蛎肉为酶解对象,大量研究表明牡蛎蛋白源的生物活性肽具有抗菌[6]、降血压[7]、抗氧化[8-9]、抗疲劳等多种生理功效,是开发功能性食品的优质基料。Wang等[10]对比了牡蛎及牡蛎碱性蛋白酶解物的体内及体外抗氧化活性,结果表明无论在体内还是体外,牡蛎酶解物的抗氧化活性均显著高于牡蛎本身。
牡蛎是中国第一大经济养殖贝类,其产量位于世界之首。然而当前牡蛎利用仍然以生销和制备耗油为主。较新鲜牡蛎而言,牡蛎干来源不受季节限制,储藏期长,价格低廉,更适合作为工业化生产的原料。研究拟以来源广泛且价格低廉的牡蛎干为研究对象,选用动物蛋白水解酶及风味蛋白酶对牡蛎干蛋白进行深度复合酶解,获得富含多种氨基酸及小分子活性多肽的牡蛎酶解液,并对该酶解物进行体外抗氧化评价试验。旨在为牡蛎干的精深加工、提高牡蛎相关制品附加值开辟一条可行性的路径提供理论参考。
1 材料与方法
1.1 材料与试剂
牡蛎干:广西北海市海城区市售;
动物蛋白水解酶:10万U/g,南宁庞博生物有限公司;
风味蛋白酶:2万U/g,南宁庞博生物有限公司;
DPPH:美国Sigma公司;
ABTS、生育酚:美国Aldrich公司;
甲醛:湖北奥生新材料科技有限公司;
其他试剂:分析纯。
1.2 主要仪器
水浴恒温振荡器:SHA-C型,江苏省金坛市农仪器厂;
高速冷冻离心机:GL-21M型,长沙湘仪离心机仪器有限公司;
自动凯氏定氮仪:KDN-103F型,上海纤检仪器有限公司;
消化炉:HYP-308型,上海纤检仪器有限公司;
数显pH计:PHS-25型,上海精密科学仪器有限公司;
分光光度计:22PC型,上海棱光技术有限公司;
冷冻干燥机:SCIENTZ-10N型,宁波新芝生物科技股份有限公司;
全自动氨基酸分析仪:L-8900型,日本Hitachi公司。
1.3 试验方法
1.3.1 牡蛎干的酶解
(1) 酶解工艺流程:
牡蛎干除杂及去内脏→粉碎→过60目筛→按一定比例加蒸馏水→调节适宜pH,加酶酶解→沸水浴灭酶10 min→4 000 r/min离心10 min→取上清待测
(2) 酶解的单因素试验:固定加酶量3%,动物蛋白水解酶∶风味蛋白酶质量比1∶1,酶解时间3 h,温度50 ℃,设定料液比为1∶5,1∶10,1∶15,1∶20 (g/mL);固定加酶量3%,50 ℃,动物蛋白水解酶∶风味蛋白酶质量比1∶1,料液比1∶10 (g/mL),设定酶解时间为2,3,4,5,6 h;固定时间3 h,50 ℃,动物蛋白水解酶∶风味蛋白酶质量比1∶1,料液比1∶10 (g/mL),设定加酶量为1%(总酶活/底物=600 U/g),2%(总酶活/底物=1 200 U/g),3%(总酶活/底物=1 800 U/g),4%(总酶活/底物=2 400 U/g),5%(总酶活/底物=3 000 U/g);固定加酶量3%,料液比1∶10(g/mL),酶解时间3 h,温度50 ℃,设定复合酶质量配比(动物蛋白水解酶∶风味蛋白酶)为4∶1,2∶1,1∶1,1∶2,1∶4。以水解度为指标,对各单因素进行试验,每组试验平行测定3次。
(3) 酶解条件正交优化试验:在单因素试验结果基础上,以水解度为指标,对酶解时间、加酶量、料液比进行三因素三水平的正交优化试验。
1.3.2 水解度的测定 参照周慧江等[11]的方法,并作以下修改:取8 mL酶解液于烧杯中,加入60 mL无二氧化碳蒸馏水,开动磁力搅拌器,滴加0.1 mol/L的NaOH标准溶液调节pH=8.2,再加入10 mL的中性甲醛,再滴加0.1 mol/L的NaOH标准溶液使pH=9.2,记录加入甲醛后消耗的NaOH体积为V1。取等质量底物的未酶解液,进行上述操作,作空白试验,记V0。每组试验进行3次平行。按式(1)计算牡蛎蛋白的水解度。
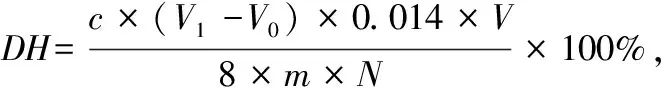
(1)
式中:
DH——水解度,%;
c——NaOH标准溶液的浓度,mol/L;
V1——酶解液中加入甲醛后消耗NaOH的体积,mL;
V0——未酶解液中加入甲醛后消耗NaOH的体积,
mL;
V——酶解液的总体积,mL;
m——酶解底物的质量,g;
N——酶解底物的总氮含量,g;
0.014——氮的毫克当量。
1.3.3 蛋白质回收率的测定 参考GB 5009.5—2016方法采用凯氏定氮仪进行蛋白质含量测定,按式(2)计算蛋白质回收率。
(2)
式中:
m1——酶解液中蛋白质含量,g;
m2——原料中蛋白质含量,g。
1.3.4 酶解液氨基酸的测定 参考GB 5009.124—2016采用全自动氨基酸分析仪进行测定。
1.3.5 体外抗氧化活性测定
(1) DPPH自由基清除能力:参照Shyu等[12]的方法稍作修改。用无水乙醇配置0.2 mmol/L DPPH溶液,取适量酶解液按体积比1∶1与0.2 mmol/L的DPPH混合,室温下避光反应30 min,记为A1;无水乙醇与等量酶解液混合,记为A2;无水乙醇与等量0.2 mmol/L的DPPH混合,记为A0。以VE做阳性对照试验。每组平行测定3次取平均值。按式(3)计算DPPH自由基的清除率。
(3)
式中:
a——DPPH自由基的清除率,%;
A1——加入试样组的吸光值;
A2——不加DPPH的样液吸光值;
近年来,随着核桃进入丰产期,拜城县大部分核桃园存在着许多低产低质的杂品种、实生核桃树,严重影响了拜城县核桃产量。且品种混杂造成了拜城县核桃品质差,价格低,严重影响了拜城县核桃种植农户的收入。
A0——未加试样组的吸光值。
(2) 羟基自由基清除能力:采用Fonton反应—水杨酸法测定羟基自由基清除能力。向试管加入试样和9 mmol/mL水杨酸—乙醇溶液、9 mmol/mL硫酸亚铁溶液及8.8 mmol/mL过氧化氢溶液各1 mL。37 ℃恒温下反应30 min,510 nm处测定吸光度值。以VC做阳性对照。每组平行测定3次。按式(4)计算羟基自由基的清除率。
(4)
式中:
b——羟基自由基的清除率,%;
A0——不加试样组的吸光度;
A1——加试样时的吸光度。
(3) ABTS自由基清除能力:配制含有7 mmol/L的ABTS溶液和2.45 mmol/L 的过硫酸钾溶液的ABTS+·溶液,使用前在黑暗室温环境中放置12~16 h,使用时用乙醇稀释ABTS+·溶液,使其在734 nm下吸亮度值为0.70±0.02。取0.2 mL样品液,加入7.8 mL上述稀释后的ABTS+·溶液,在室温下反应6 min,然后在734 nm处测定其吸光度值[3]。以VE做阳性对照。按式(4)计算ABTS自由基的清除率。
1.3.6 数据处理 采用Excel 2013进行数据统计并作图及使用SPSS 22.0中的最小显著性差异法(Least-Significant Difference,LSD)对试验数据进行单因素方差分析(one-way ANOVA)。
2 结果与分析
2.1 酶解单因素试验
2.1.1 料液比对水解度的影响 水是酶解反应中重要的反应介质和运输载体。适量的水可以使原料肌肉组织吸水膨胀,结构变得疏松,提高酶与蛋白的反应几率;而且水可以使产物快速分散,避免局部浓度过高,对酶解形成抑制。然而,水分含量过高会导致有效的酶浓度降低,酶解速率也会随之减缓,此外过低的底物浓度会导致酶自溶[13]。如图1所示,牡蛎蛋白水解度随加液量的增加而增大,料液比为1∶15 (g/mL)时水解度增长的幅度基本趋于平缓。因此以料液比1∶15 (g/mL)作为后续优化试验的参考。

字母不同表示差异显著(P<0.05)图1 料液比对牡蛎蛋白水解度的影响
Figure 1 Effect of material to liquid ratio on the degree of hydrolysis of oyster protein
2.1.2 酶解时间对水解度的影响 由图2可以看出:牡蛎蛋白水解度随时间的延长不断提高,5 h之后基本趋于平缓,是由于水解前期底物充足,酶活高。随着酶解时间的延长不仅酶活力下降,产物浓度不断提高,从而一定程度上限制了酶促反应的进行。通过方差分析可知,5 h之前,不同的酶解时间对牡蛎蛋白水解度的影响存在显著差异(P<0.05)。因此在后续试验中选择3~5 h进行酶解时间优化。
2.1.3 加酶量对水解度的影响 酶解反应中,加酶量影响着酶解效率,一般而言,加酶量越大蛋白酶解效率和程度越高,但当酶用量大于适宜浓度时,容易导致酶自溶增强[14],从而影响酶解效率。从图3可以看出,随着加酶量的增大水解度先增大后趋于平缓,当酶添加量>3%后,蛋白水解度基本不变,因此选用3%作为后续优化试验的参考点。
2.1.4 复合酶质量酶比对水解度的影响 从图4可以看出:随着风味蛋白酶相对添加量的增加,牡蛎蛋白水解度基本处于下降的趋势,表明相对于动物蛋白水解酶而言,风味蛋白酶对牡蛎干蛋白的酶解结合位点相对较少,酶切范围相对较小。动物蛋白水解酶∶风味蛋白酶=4∶1时的牡蛎蛋白水解度显著(P<0.05)高于其他酶比条件下的水解度,因此选取酶比(动物蛋白水解∶风味酶)为4∶1用于后续试验。
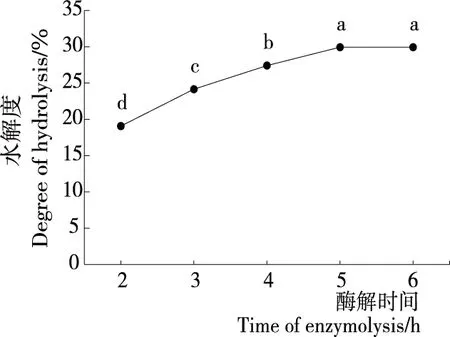
字母不同表示差异显著(P<0.05)图2 酶解时间对牡蛎蛋白水解度的影响
Figure 2 Effect of time on the degree of hydrolysis of oyster protein

字母不同表示差异显著(P<0.05)图3 加酶量对牡蛎蛋白水解度的影响
Figure 3 Effect of amount of enzyme on the degree of hydrolysis of oyster protein
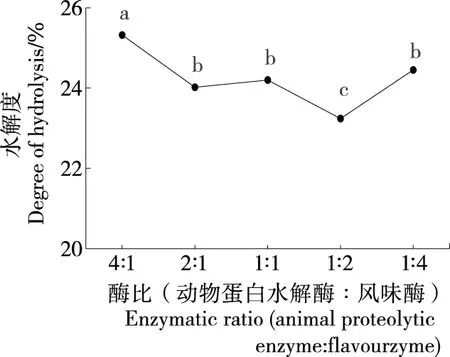
字母不同表示差异显著(P<0.05)图4 酶比对牡蛎蛋白水解度的影响
Figure 4 Effect of enzymatic ratio on the degree of hydrolysis of oyster protein
2.2 酶解正交优化试验
在单因素试验结果基础上,确定的正交试验设计见表1。
表1 牡蛎干酶解的正交试验设计
Table 1 Orthogonal experimental design of enzymatic hydrolysis of dried oyster

水平A 时间/hB 料液比(g/mL)C 总酶量/%131∶102241∶153351∶204
由表2可知,通过极差分析得到各因素对牡蛎蛋白水解度的影响主次顺序为:时间>料液比>加酶量。此外,由RA、RB均大于空列的极差可得酶解时间及料液比对水解度存在影响是可靠的。正交优化试验的最优组合为A3B2C3,通过验证对比试验得到最优组合下的水解度为33.95%,稍微大于水解度最高试验组A3B3C2。由于加酶量对水解度的影响较小,综合考虑经济成本,选取加酶量为3%,将A3B3C2定为最优酶解工艺组合。验证实验表明:此组合下牡蛎酶解的平均水解度为33.7%(n=3),蛋白质平均回收率达78.75%。
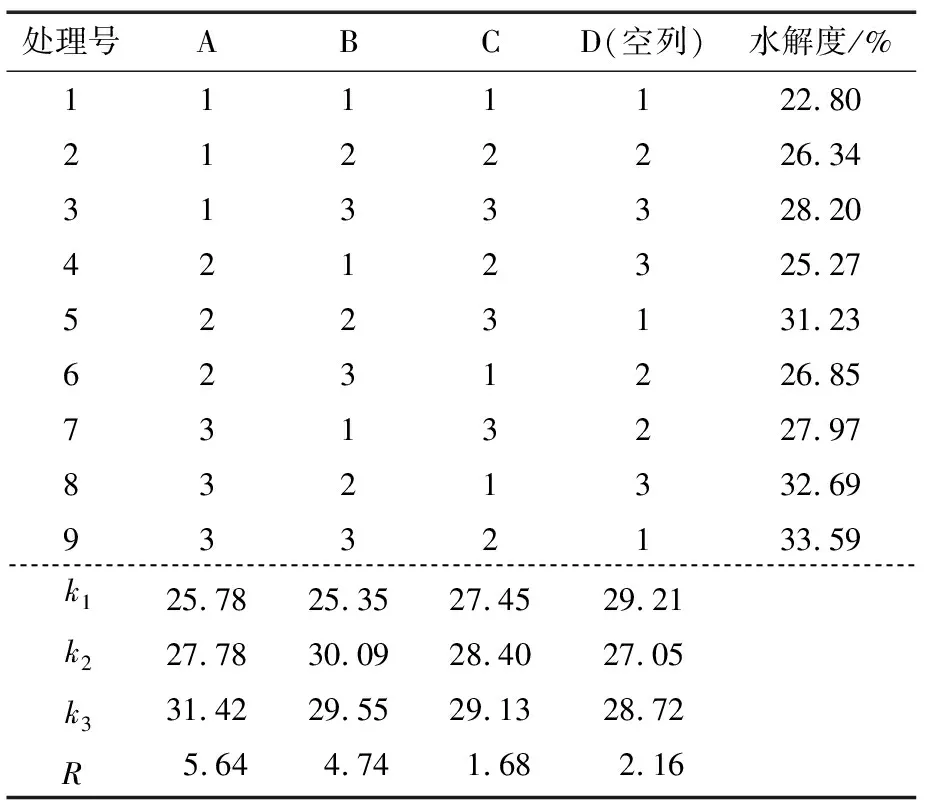
表2 正交优化试验结果Table 2 Orthogonal optimization experiment results
2.3 牡蛎酶解液的氨基酸分析
如图5及表3所示,采用全自动氨基酸分析仪测定牡蛎干酶解液中总氨基酸,可以测出17种氨基酸。采用峰面积归一化法计算得出:必需氨基酸占总氨基酸含量的38.93%,其中谷氨酸、天冬氨酸等鲜味氨基酸含量丰富。必需氨基酸(EAA)与非必需氨基酸(NEAA)的比例为63.74%。符合FAO/WHO的理想模式:EAA/TAA为40%左右,EAA/NEAA为60%以上。因此可以得出该牡蛎酶解液氨基酸种类齐全且营养丰富。
2.4 牡蛎酶解液体外抗氧化试验
2.4.1 DPPH自由基清除能力 如图6、7所示,牡蛎酶解液及生育酚对DPPH自由基的清除率均随浓度的增大而不断升高,且均具有显著的正相关性(P<0.01)。Dong等[15]探究了大连湾牡蛎肉蛋白酶解物的抗氧化活性,结果表明DPPH自由基清除能力与牡蛎酶解物浓度存在显著的量效关系,与试验结果相似。根据线性方程分别可得出生育酚对DPPH自由基的半数清除率IC50=11.72 μg/mL,牡蛎酶解液对DPPH自由基的半数清除率IC50=5.95 mg/mL。
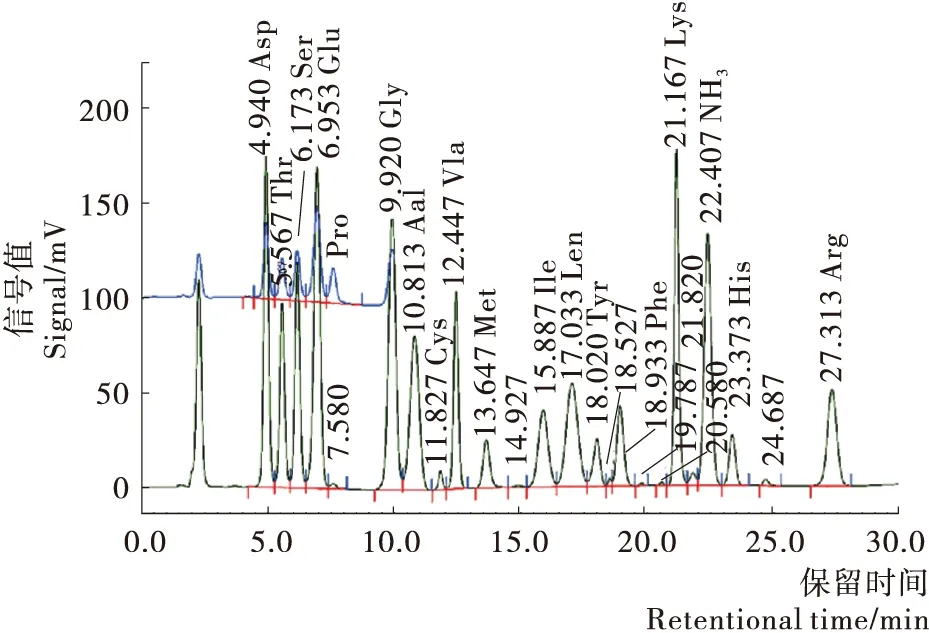
图5 酶解液氨基酸分析图谱Figure 5 The map of amino acid analysis of hydrolysate
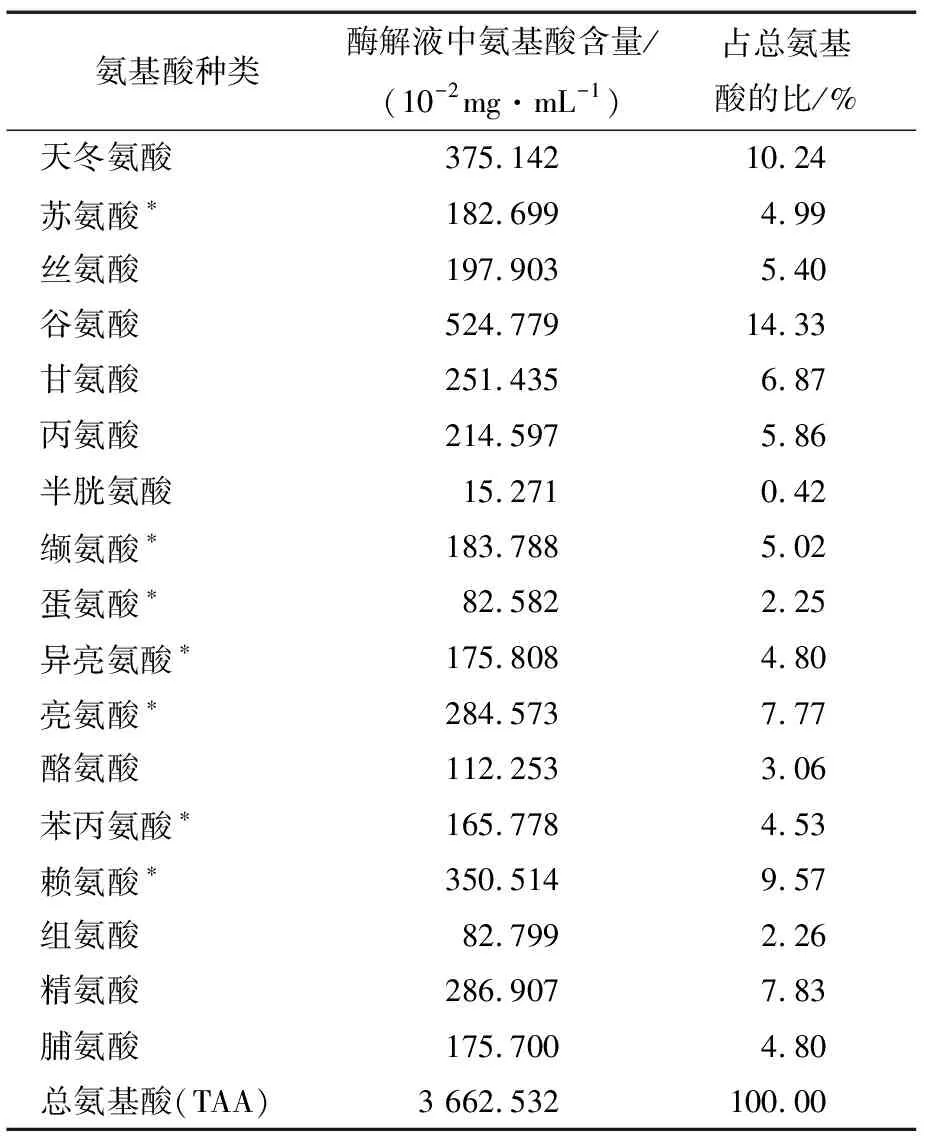
表3 酶解液中氨基酸的组成†Table 3 Amino acid composition of hydrolysate
† *表示必需氨基酸(EAA)。
2.4.2 羟基自由基清除能力 羟基自由基是生命体内存在最活跃的活性氧,几乎可以与机体内所有的细胞成分反应,破坏力极强。如图8所示,当VC浓度为1 mg/mL
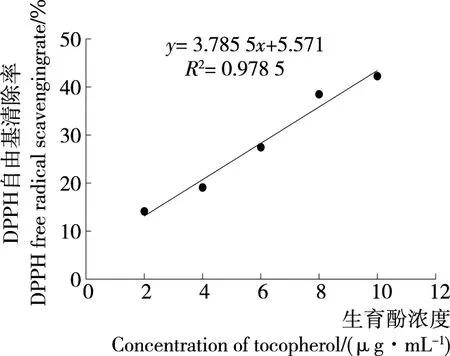
图6 生育酚对DPPH自由基的清除作用
Figure 6 Effect of tocopherol on DPPH free radical scavenging
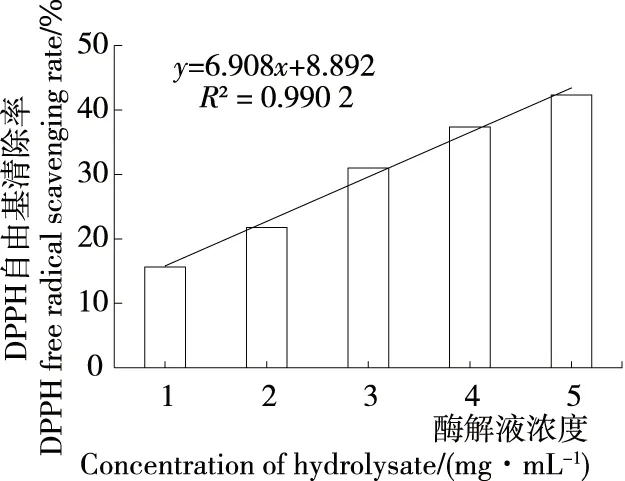
图7 牡蛎酶解液对DPPH自由基的清除作用
Figure 7 Effect of oyster hydrolysate on DPPH free radical scavenging

图8 VC对羟基自由基的清除作用
Figure 8 Effect of vitamin C on hydroxyl free radical scavenging
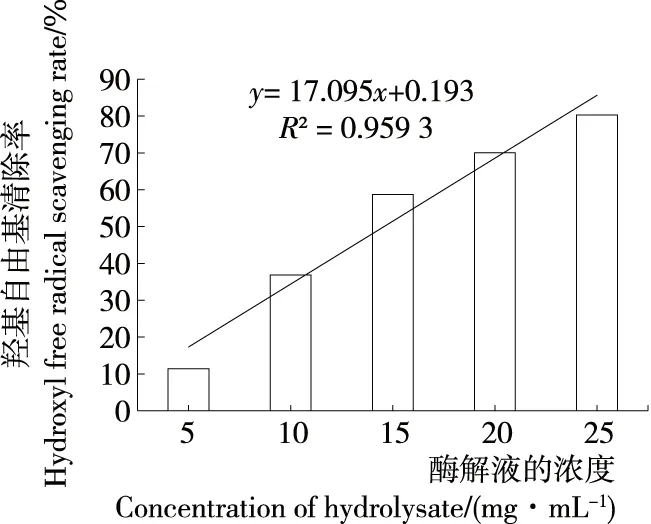
图9 牡蛎酶解液对羟基自由基的清除作用
Figure 9 Effect of oyster hydrolysate on hydroxyl free radical scavenging
时,其对羟基清除率达到98.8%,其半数清除率IC50=589.15 μg/mL。如图9所示牡蛎酶解液对羟基自由基清除率随浓度的增大不断提高,且具有显著的正相关性(P<0.01),其半数清除率IC50=14.56 mg/mL。
2.4.3 ABTS自由基清除能力 如图10、11所示,生育酚及牡蛎蛋白酶解液对ABTS自由基的清除率均随浓度的增大而显著提高(P<0.01),结合线性方程可得生育酚对ABTS自由基的半数清除率(IC50)为118.1 μg/mL,牡蛎蛋白酶解液对ABTS自由基的半数清除率IC50=10.80 mg/mL。
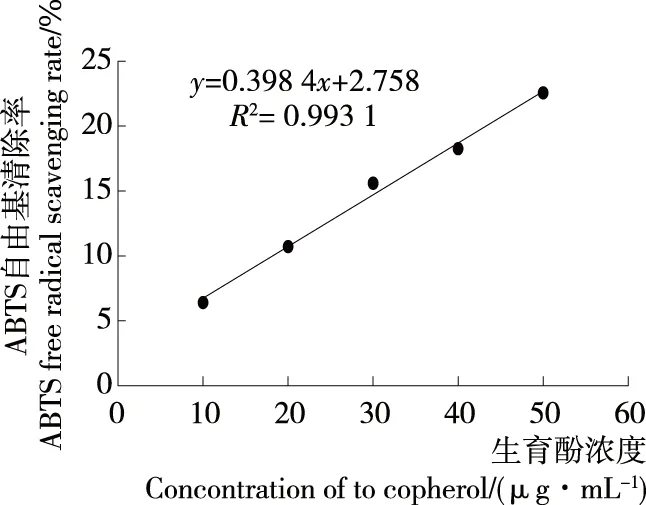
图10 生育酚对ABTS自由基的清除作用
Figure 10 Effect of tocopherol on ABTS free radical scavenging
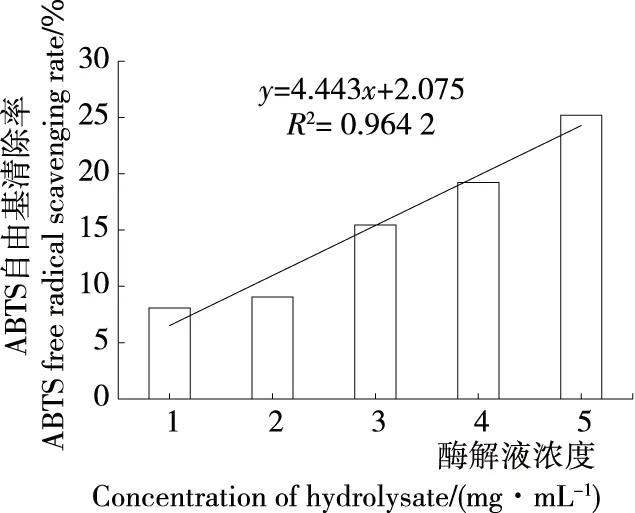
图11 牡蛎酶解液对ABTS自由基的清除作用
Figure 11 Effect of oyster hydrolysate on ABTS free radical scavenging
3 结论
研究选用动物蛋白水解酶及风味蛋白酶复合对牡蛎干进行深度酶解,进一步探究了最优酶解工艺得到的牡蛎干蛋白酶解物的体外抗氧化活性。研究结果显示该牡蛎干蛋白水解物清除DPPH自由基的IC50=5.95 mg/mL,清除ABTS自由基的IC50=10.8 mg/mL,清除羟基自由基的IC50=14.56 mg/mL。表明在该研究的酶解条件下得到的牡蛎干酶解物具备一定抗氧化能力。
但牡蛎干酶解液腥味较重,限制了其在食品领域的应用,因此在今后的研究中可继续探究酶解液的风味改善方法及腥味产生的机制。或者可进一步对酶解液中的活性多肽进行分离纯化,结合动物试验探究其抗氧化活性机制。最终可作为功能性基料用于开发营养丰富、具有保健功能的食品,从而提升牡蛎产业的整体经济社会效益。
