CGRP对人牙周膜干细胞成骨分化和成血管能力影响的体外研究
2020-06-12李汉青何家才
王 芳,李汉青,何家才
颌骨缺损修复的传统骨替代材料如自体骨、异体骨等,在临床应用中存在不可忽视的局限性[1]。骨组织工程因具有骨再生能力、无免疫源性、创伤小的优势,应用前景广泛,但血管化问题限制了其临床应用于大体积颌骨缺损的修复,因此具有促进骨再生和血管形成的双重调控因子逐渐成为研究热点[2-3]。降钙素基因相关肽(calcitonin gene- related peptide,CGRP)是神经肽类物质,体内含量丰富且生物学效应广泛,血管扩张作用显著[4]。同时近年CGRP在调控骨折愈合、骨重塑中的重要作用引起了关注[5-6]。因此,CGRP有望成为组织工程骨中具有促进骨再生和血管形成的双重调控因子,但CGRP对间充质干细胞成骨成血管能力影响的研究尚未深入。鉴于此,该实验体外运用CGRP探讨其对人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)成骨分化和成血管能力的影响。
1 材料与方法
1.1 主要试剂与仪器胎牛血清(以色列Biolnd公司);胰酶消化液、DMEM培养基(美国Gibco公司); PBS缓冲剂 (美国Solarbio公司);CGRP(美国Sigma公司);CCK-8试剂(日本同仁公司);CO2恒温孵箱(美国 Thermo公司);茜素红(美国Sigma公司);BCIP/ NBT碱性磷酸酯酶试剂盒(上海碧云天生物技术有限公司) ;OCN、VEGF、RUNX2兔单克隆抗体(美国Abcam公司);PCR引物(上海生物工程股份有限公司);实时荧光定量 PCR仪(美国Stratagene公司);荧光倒置显微镜(德国Leica公司);酶标仪(美国Bio-tek公司);流式细胞仪(美国 Beckman Coulter公司)。
1.2 方法
1.2.1hPDLSCs体外分离培养 于临床收集牙周健康且无龋坏因正畸需要而拔除的前磨牙,超净台内,离体牙用含3倍双抗的PBS冲洗。使用手术刀片从牙根表面的中1/3轻轻刮取牙周膜组织(避免根尖组织和牙龈混入),尽量剪碎,以合适的密度铺在6孔板皿底,加入适量含20%FBS、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养液,避免晃动培养板,37 ℃、5%CO2条件下培养。每3 d左右换液,镜下观察当细胞生长达皿底60%左右时,用胰酶消化传代。
1.2.2流式细胞术检测hPDLSCs表型 取第2~3代hPDLSCs,消化后PBS洗涤2遍,使细胞悬液密度为5×106/ml,并向每个EP管加入200 μl细胞悬液。分别使用空白对照、CD34、CD45、CD44、CD90、CD105、CD146抗体标记,避光孵育, PBS洗涤2遍,细胞筛过滤细胞团块以防阻塞机器,上机检测。
1.2.3CCK-8检测CGRP对hPDLSCs增殖能力的影响 实验组根据培养液中CGRP的浓度分别分为0 mol/L组、10-10mol/L组、10-9mol/L组、10-8mol/L组、10-7mol/L组、10-6mol/L组。取对数生长期的hPDLSCs,以4×103/孔接种于96孔板,次日分别加入不同浓度的CGRP(0、10-10、10-9、10-8、10-7、10-6mol/L),培养1、2、3、4、5 d后,弃上清液,每孔加入90 μl标准培养基+10 μl的CCK-8液,孵育2 h在避光环境中,酶标仪测定450 nm处的吸光度(optical density,OD)值,每组设5个复孔。
1.2.4RT-PCR检测 实验分为5组分别为0 mol/L组、10-10mol/L组、10-9mol/L组、10-8mol/L组、10-7mol/L组。将hPDLSCs均匀铺于6孔板密度调整为1×105/孔,培养12 h,每孔分别加入含不同浓度CGRP(0、10-10、10-9、10-8、10-7mol/L)的基础培养基,培养3、7、14 d分别提取细胞总RNA,进行RT-PCR定量检测分析成骨成血管相关基因碱性磷酸酶(alkalinephosphatase,ALP)、核心结合因子2(runt-relatedtranscription factor2,RUNX2)、骨钙素(osteocalin,OCN)、血管内皮生长因子(VEGF)的表达水平。PCR引物序列见表1。

表1 PCR引物列表
1.2.5Western blot检测 实验分组同1.2.4。将hPDLSCs均匀铺于6孔板密度为1×105/孔,培养12 h,每孔分别加入含不同浓度CGRP(0、10-10、10-9、10-8、10-7mol/L)的基础培养基,培养第7、14天分别将各组细胞裂解、提取蛋白。Bradfort蛋白定量后进行凝胶电泳、PVDF膜转膜,然后5% BSA封闭液封闭(室温1 h),分别加一抗β-actin(1 ∶ 1 000)、RUNX2、OCN(1 ∶ 500), VEGF(1 ∶ 2 000),4 ℃环境下过夜,加入相应二抗(1 ∶ 5 000),孵育1 h,蛋白条带滴加ECL显色液,曝光成像。
1.2.6ALP染色 将hPDLSCs接种于12孔板密度为5×104/孔,12 h后更换为含不同浓度CGRP的成骨诱导分化培养基,培养7 d后One-Step TMNBT/BCIP溶液(PIERCE)染色,并拍照;hPDLSCs以4×103/孔的密度接种96孔板,培养方法同前,培养7 d后ALP检测试剂盒处理,测量405 nm处OD值。
1.2.7茜素红染色 hPDLSCs铺板培养方法同ALP染色,培养21 d,2%茜素红染液染色,观察拍照;然后将10%氯化十六烷基吡啶加入已染色的各样本孔中,待各孔结节完全溶解,取溶解液测562 nm处的OD值。

2 结果
2.1 hPDLSCs体外分离培养组织块法分离和培养hPDLSCs,约5~8 d光镜下可观察到原代细胞从组织块周围迁移出,细胞多呈长梭形,快速生长后呈放射状排列。传代培养后,细胞贴壁牢固,状态良好。见图1。
2.2 hPDLSCs鉴定流式细胞术检测结果显示,hPDLSCs高表达间充质干细胞细胞表面标志抗原CD44、CD90、CD105、CD146,低表达造血细胞表面标志抗原CD34和CD45。见图2。
2.3 CCK-8检测CGRP对hPDLSCs增殖能力的影响培养1 d,各组间细胞OD值无显著差异;培养2、3、4、5 d,与0 mol/L组相比,10-8mol/L组、10-9mol/L组细胞OD值明显升高,差异有统计学意义(F=45.564、96.624、147.952、162.069,P<0.05),10-7mol/L组、10-10mol/L组细胞OD值无明显变化,10-6mol/L组细胞OD值明显降低,差异有统计学意义(P<0.05)。这表明一定浓度范围的CGRP促进hPDLSCs的细胞增殖,10-6mol/L组的CGRP抑制hPDLSCs的细胞增殖。见表2。
2.4 RT-PCR检测CGRP对hPDLSCs成骨相关基因(ALP、RUNX2、OCN)和成血管相关基因VEGF表达的影响检测成骨相关基因(ALP、RUNX2、OCN)和成血管相关基因VEGF在第3、7、14天的相对表达水平。结果表明:一定浓度CGRP作用于hPDLSCs,与0 mol/L组比较,ALP的表达水平在第3、7、14天时不同程度升高(F=12.383、55.967、958.389,P<0.05);Runx2的表达水平在第7、14天升高(F=46,341、395.544,P<0.05);14 d时OCN表达水平明显增加(F=389.195,P<0.05),差异有统计学意义。VEGF的表达水平在第3天增加,持续至第14天 (F=73.210、201.754、295.48,P<0.05)差异有统计学意义。见图3。
图1 hPDLSCs体外培养
A:原代培养10 d ×100; B:第二代hPDLSCs ×100;C:第二代hPDLSCs ×500

图2 流式细胞术检测细胞表面标志物
A:CD34;B:CD45;C:CD44;D:CD90;E:CD105;F:CD146

表2 CCK-8检测不同时间和组别的细胞OD值
与0 mol/L组比较:*P<0.05
2.5 Western blot检测RUNX2、OCN、VEGF蛋白水平的表达Western blot结果显示:第7、14天,与0 mol/L组比较10-9mol/L组、10-8mol/L组RUNX2、OCN、 VEGF表达水平不同程度增加(P<0.05)差异有统计学意义。见图4。
2.6 ALP染色及茜素红染色成骨诱导培养7 d后的ALP染色结果表明:与0 mol/L组比较,10-10mol/L组、10-7mol/L组的ALP活性无明显差异;10-9mol/L组、10-8mol/ L组的ALP活性明显增高,半定量分析显示分别为0 mol/L组的1.4倍和1.7倍(F=387.989,P<0.05);茜素红染色结果显示:成骨诱导培养21 d,10-10mol/L组、10-7mol/L组结节生成量与0 mol/L组比较无明显差异;10-9mol/L组、10-8mol/L组钙结节生成明显,半定量分析结果显示分别为0 mol/L组的1.5倍和1.8倍(F=306.593,P<0.05),见图5、6。ALP染色及茜素红染色半定量分析中OD值,见表3。
3 讨论
临床上hPDLSCs通常取自正畸牙或阻生齿,获取hPDLSCs时患者额外创伤较小。有研究[7-8]表明hPDLSCs具有多向分化潜能,如分化为成骨样细胞、脂肪样细胞、神经样细胞等。研究[7]发现hPDLSCs在体外培养过程中,其增殖率明显高于骨髓间充质干细胞和牙髓干细胞, 因此在组织再生研究中有广阔的应用前景。本实验采用组织贴壁法培养hPDLSCs,方法成熟且操作方便。流式细胞术检测结果显示hPDLSCs表面间充质干细胞细胞表面标志抗原CD44(99.82%)、CD90(98.75%)、CD105(99.75%)、CD146(68.98%)表达为阳性,造血细胞表面标志抗原CD34(0.10%)、CD45(0.13%)表达为阴性,表明分离培养的细胞符合间充质干细胞的特性,可用于后续实验。
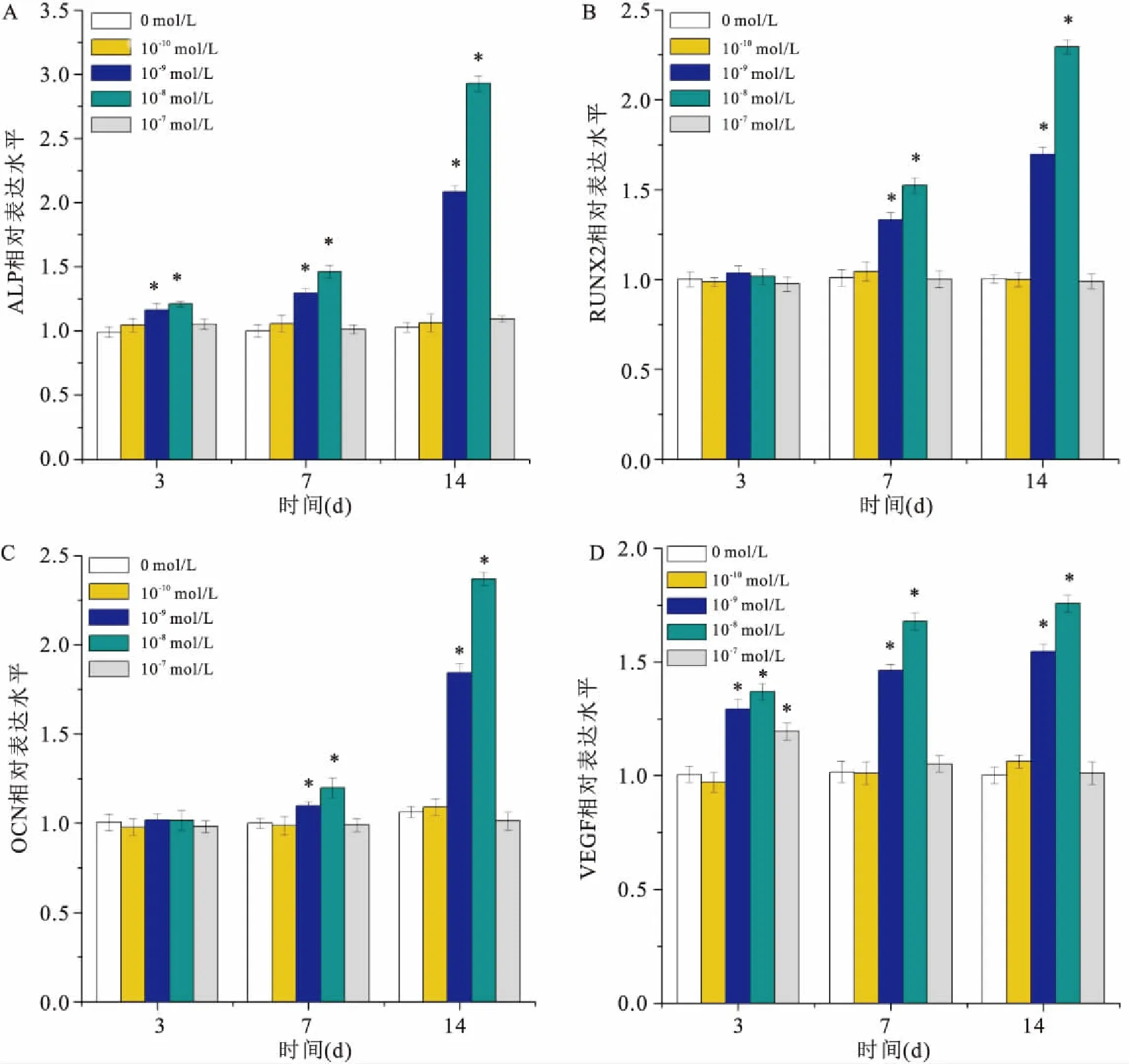
图3 RT-PCR检测成骨分化相关基因和VEGF基因表达
A:ALP;B:RUNX2;C: OCN;D:VEGF;与0 mol/L组比较:*P<0.05
表3 ALP染色和茜素红染色半定量分析中的OD值

半定量分析0 mol/L10-10 mol/L10-9 mol/L10-8 mol/L10-7 mol/LALP染色1.105±0.0421.130±0.0361.570±0.009∗1.867±0.032∗1.189±0.020茜素红染色0.863±0.0430.87±0.0281.289±0.036∗1.530±0.057∗0.832±0.028
与0 mol/L组比较:*P<0.05
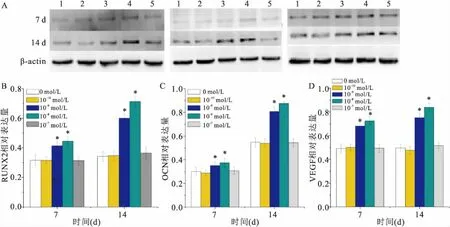
图4 Western blot 检测RUNX2、OCN、VEGF蛋白水平的表达
A:蛋白条带;B:RUNX2;C:OCN;D:VEGF;1:0 mol/L;2:10-10mol/L;3:10-9mol/L;4:10-8mol/L;5:10-7mol/L;与0 mol/L组比较:*P<0.05
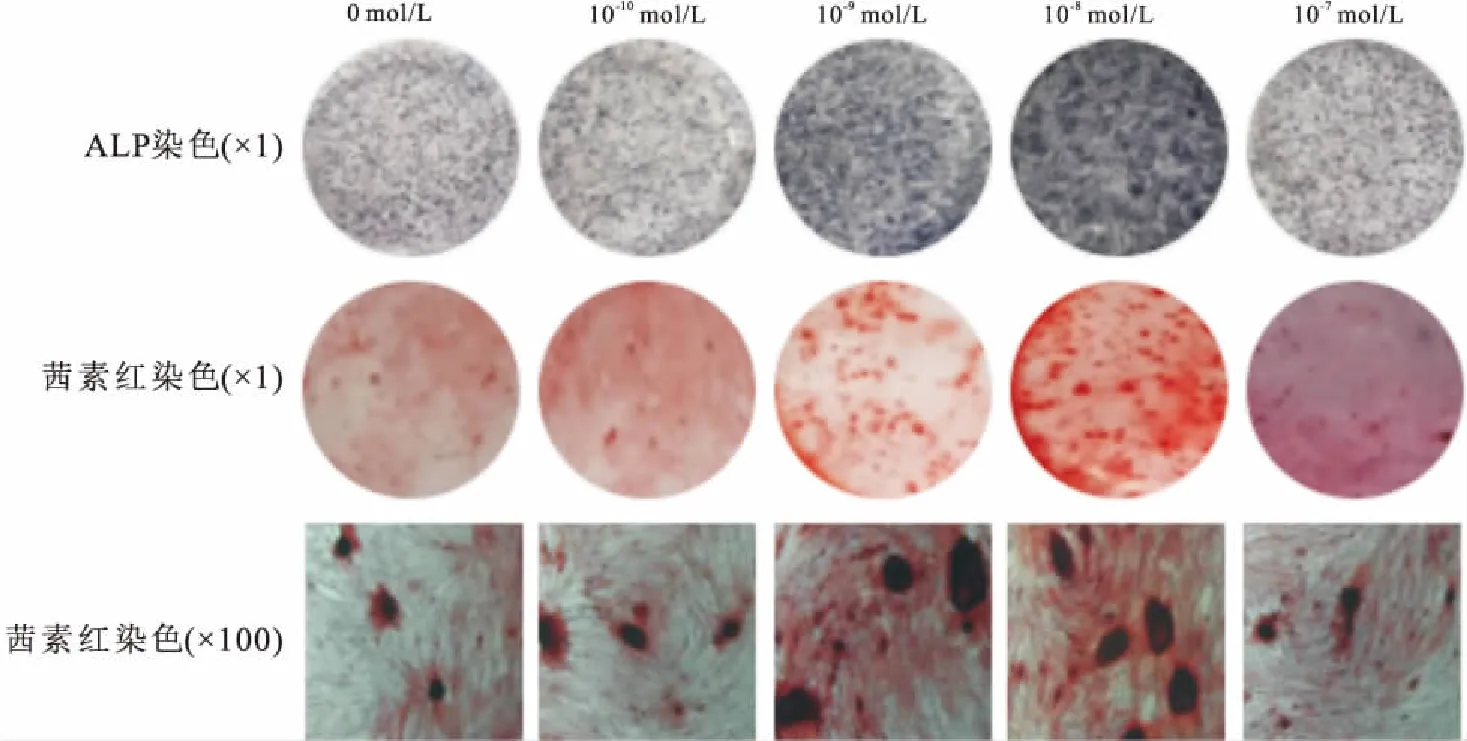
图5 ALP染色及茜素红染色

图6 ALP染色及茜素红染色半定量分析
A:ALP染色半定量分析;B:茜素红染色半定量分析;1:0 mol/L;2:10-10mol/L;3:10-9mol/L;4:10-8mol/L;5:10-7mol/L; 与0 mol/L组比较:*P<0.05
血管化对于修复大体积的颌骨缺损非常重要,它可以提供营养物来支持支架内的细胞并及时排出代谢物促进新骨形成[3]。VEGF是目前公认的最强的促血管形成的生长因子,可促进内皮细胞的增殖和分化并诱导新血管形成[9]。CCK-8结果表明浓度为10-8mol/L的CGRP显著促进hPDLSCs增殖。RT-PCR和Western blot 检测结果显示一定浓度的CGRP使VEGF的基因和蛋白表达量上升,说明CGRP能促进hPDLSCs分泌VEGF,故推测CGRP可通过提高hPDLSCs成血管能力间接提高骨修复能力。
CGRP是骨组织中分布最广泛的神经肽,被认为是骨骼的天然活化剂,其潜在的治疗效果受到越来越多的关注[10]。体外实验显示CGRP特异性受体降钙素受体样受体存在于成骨细胞和破骨细胞上,CGRP可促进成骨细胞的分化和增殖[11],抑制破骨细胞的发育[12]。Zhou et al[13]研究发现CGRP可通过激活Wnt信号转导通路促进BMSC成骨分化。ALP是成骨分化过程中的标志物,转录因子RUNX2有着调节间充质干细胞向成骨前细胞的分化的作用,OCN在骨形成和骨转换中都起着重要作用。因此ALP、RUNX2、OCN的表达水平的反映着hPDLSCs的成骨分化能力[14]。RT-PCR、Western blot检测、ALP染色和茜素红染色结果显示,10-8mol/L浓度组的CGRP可显著提高hPDLSCs成骨分化能力。
