hPMSCs对哮喘大鼠肺组织保护作用及机制研究
2020-06-12钟哲峰
吕 剑,钟哲峰
支气管哮喘(简称哮喘)是一种常见临床疾病,主要表现为气促伴或不伴咳嗽、反复发作的喘息[1]。以往有研究[2]表明,辅助性T1/2细胞(Thelper1/2,Th1/Th2)细胞在哮喘发病中起着重要作用,而Th2 细胞的分化发展是其发病的始动环节。大量研究[3]表明,急慢性哮喘发病过程中Notch 信号通路与 Th1/Th2 共同参与调控,但其机制仍有待明确。人胎盘来源干细胞(human placenta-derived mesenchymal stem cells,hPMSCs)是具有多向分化潜能的间充质干细胞(mesenchymal stem cells, MSCs),hPMSCs的致瘤性实验呈阴性,具有正常的染色体核型,这说明遗传性状稳定,使其在治疗免疫疾病方面有广阔前景。现建立哮喘大鼠模型,在移植hPMSCs后通过HE染色、RT-qPCR和Western blot等方法观察其对哮喘大鼠肺组织的影响,以及调节Notch信号通路表达,为哮喘治疗提供可能的新方法。
1 材料与方法
1.1 实验动物SPF级SD雌性大鼠30只(6~8周),购自湖南斯莱克景达实验动物有限公司,体质量(185±12.5)g,实验动物许可证[SCXK(湘)2018-0016],单位使用许可证编号:SYXK(湘)2015-0033。大鼠统一饲养在南华大学动物房,室温18~26 ℃,40%~70%相对湿度,适应性喂养7 d。本研究通过我院伦理委员会审查,实验过程动物符合3R原则。
1.2 仪器与试剂胰蛋白酶(美国Sigma公司);低糖DMEM 培养基、胎牛血清(美国 HyClone 公司);cDNA 反转录试剂盒(日本Takara公司);卵白蛋白(Ovalbumin,grate Ⅱ、Ⅴ)(美国Sigma公司);SYBR Green 荧光试剂盒(美国 Biomiga公司); Jagged1兔抗大鼠单克隆抗体(美国SANTA CRUZ公司);Notch1、2、3、4 兔抗大鼠单克隆抗体(美国Cell signaling公司);图像分析系统(美国Media Cybernetics公司);酶标检测仪(美国GeneCore公司);石蜡切片机(德国Leica公司)。
1.3 方法
1.3.1hPMSCs的分离、培养与鉴定 取足月剖宫产胎儿胎盘侧组织,经PBS多次冲洗去除血迹,剪成1×1×1 mm3,0.1% Ⅳ型胶原酶中,37 ℃消化30 min,200目筛网过滤收集细胞,细胞悬液离心后置于培养箱内培养(37 ℃、5% CO2),7 d后首次全量换液弃去未贴壁细胞,以后每3 d换液1次,待细胞汇合度达70%~80%时传代培养。取第 3 代 hPMSCs 消化分离,收集细胞悬液(5×106个/ml ),加入不同 EP管中,采用流式细胞仪检测hPMSCs表面标志物CD90、CD45、CD44、CD29、CD34。
1.3.2哮喘模型的建立及分组 大鼠随机均分为3组,即对照组、哮喘模型组(OVA组)及hPMSCs 移植组(hPMSCs组)。造模第1天腹腔注射1 ml OVA混悬液致敏(200 mg 氢氧化铝,V级OVA 1 mg溶于1 ml生理盐水),1周后加强致敏1次,将大鼠置于雾化吸入箱,每天雾化30 min/次(1%的Ⅱ级OVA 雾化液),共7次,制作出SD大鼠哮喘模型[4]。其余组均按相同造模方法,对照组采用生理盐水进行致敏和激发。而hPMSCs组在首次激发后,将第 3 代的hPMSCs尾静脉注入1 ml细胞混悬液(密度为1×107个/ml)。对照组和OVA组采用尾静脉注射1 ml PBS溶液。
1.3.3肺组织HE染色 各组大鼠取左侧一叶肺组织,石蜡包埋,做厚度4 μm的连续切片,进行苏木精-伊红(HE)染色后,中性树胶封片,在显微镜下观察病理改变。
1.3.4ELISA法检测大鼠血清中免疫球蛋白E(immunoglobulin E, IgE)、白细胞介素-4(interleukin 4, IL-4)和干扰素-γ(interferon-γ, IFN-γ)含量 末次激发24 h后,20%乌拉坦腹腔麻醉大鼠,经腹主动脉取血,置于抗凝离心管内,3 000 r/min离心10 min,分取血清,-20 ℃保存备用。按照ELISA试剂盒说明书检测大鼠血清中IgE、IL-4和IFN-γ含量。
1.3.5RT-qPCR法检测大鼠肺组织中Notch信号通路相关mRNA表达 取冻存大鼠肺组织50 mg,TRIzol试剂提取总RNA,根据 Revertaid First Strand CDNA Synthesis Kit说明书进行反转录反应,合成cDNA,保存在-80 ℃。采用上海生工生物技术公司合成的Notch1、Notch2、Notch3及Jagged1的引物序列,参照SYBR Green荧光PCR试剂盒说明书,配置反应体系,依次进行逆转录及扩增反应。实验重复3次,最后由软件计算并读出各组Ct值,并对照组基因表达设为1,采用2-△△Ct法计算目的mRNA的含量。
1.3.6Western blot检测肺组织中Notch1、Notch2、Notch3及Jagged1蛋白变化 每组取冻存大鼠肺组织100 mg,用预冷的蛋白裂解液提取总蛋白,1 200 r/min离心5 min,采用BCA法测定蛋白浓度。每孔以50 μg蛋白样品上样,经SDS-PAGE电泳分离、转膜,然后脱脂奶粉室温下封闭2 h,加入Notch1(1 ∶ 200)、Notch2(1 ∶ 200)、Notch3(1 ∶ 200)、Jagged1(1 ∶ 500)一抗4 ℃孵育过夜,洗膜后加入辣根过氧化物酶(HRP)标记的山羊抗兔二抗(1 ∶ 1 000)室温孵育1 h,ECL染色后,曝光、显影。

2 结果
2.1 hPMSCs培养与鉴定培养7 d后可见梭型细胞贴壁生长增多,培养21 d左右细胞大量增殖,呈漩涡状生长,见图1。培养3代后的细胞,经流式细胞仪分析表面标记的阳性率为CD44+[(94.11±1.44)%]、CD90+[(97.85±2.75)%]、CD29+[(92.17±2.16)%],阴性率为CD34-[(92.23±1.68)%]和CD45-[(95.19±2.47)%]。见图2。

图1 显微镜下观察hPMSCs形态 ×100
2.2 肺组织病理改变采用倒置显微镜观察拍照,对照组未见炎症细胞浸润,肺泡壁完整、支气管无任何改变,而OVA组存在严重炎性改变,支气管黏膜增厚,管腔狭窄,说明哮喘模型制备成功; hPMSCs组管腔轻微缩窄,炎性细胞浸润减轻,病理改变较OVA组好转。见图3。

图2 流式细胞仪鉴定hPMSCs

图3 各组大鼠肺组织学结构 HE×200
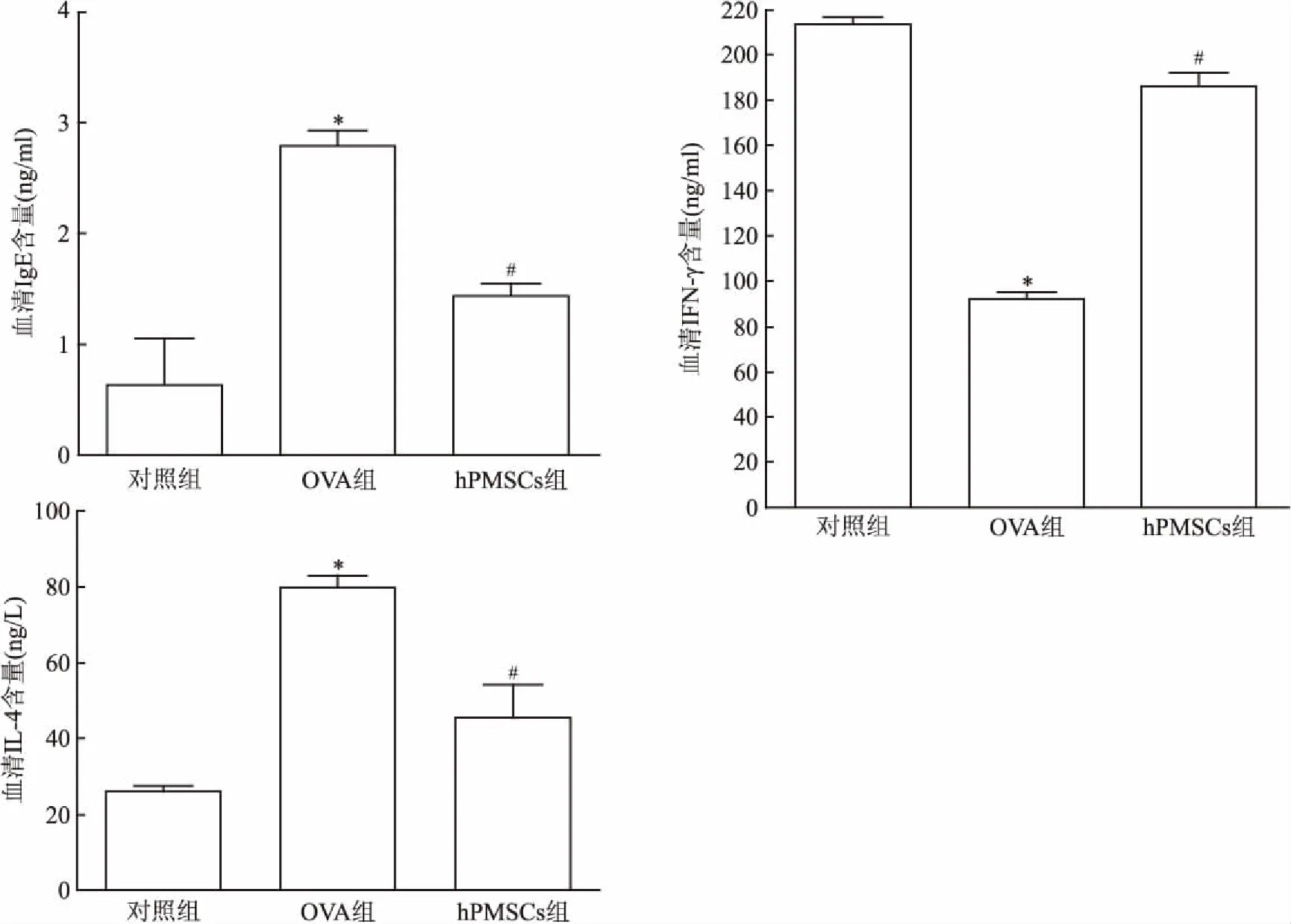
图4 大鼠血清中炎性因子表达
与对照组比较:*P<0.05;与OVA组比较:#P<0.05
2.3 ELISA检测大鼠血清炎症细胞因子OVA组血清中IgE、IL-4含量高于对照组(F=77.41,P<0.05;F=37.25,P<0.05),而与OVA组比较, hPMSCs组血清中IgE、IL-4含量下降(F=28.39,P<0.05;F=14.81,P<0.05);OVA组血清中IFN-γ含量低于对照组(F=58.10,P<0.05),而与OVA组比较, hPMSCs组血清中IFN-γ含量上升(F=155.23,P<0.05)。见图4。
2.4 大鼠肺组织中Notch1、Notch2、Jagged1 mRNA表达变化OVA组肺组织中Notch1、Notch2、Jagged1 mRNA表达水平高于对照组(F=56.20,P<0.05),而与OVA组比较,hPMSCs组Notch1、Notch2、Jagged1 mRNA表达水平下降(F=64.12,P<0.05);OVA组Notch3 mRNA表达水平低于对照组(P<0.05),而与OVA组比较,hPMSCs组Notch3 mRNA表达水平上升(P<0.05)。见图5。
2.5 Western blot检测大鼠肺组织中Notch相关蛋白表达水平OVA组肺组织中Notch1、Notch2、Jagged1 蛋白表达水平高于对照组(F=77.46,P<0.05),而与OVA组比较,hPMSCs组Notch1、Notch2、Jagged1蛋白表达水平下降(F=105.18,P<0.05);OVA组Notch3蛋白表达水平低于对照组,而与OVA组比较,hPMSCs组Notch3蛋白表达水平上升。见图6。

图5 大鼠肺组织中Notch相关mRNA表达水平
A:Notch1相对表达水平;B:Notch2相对表达水平;C:Notch3相对表达水平;D:Jagged1相对表达水平;与对照组比较:*P<0.05;与OVA组比较:#P<0.05
3 讨论
哮喘是一种呼吸系统的异质性疾病,表现为气道炎症导致持续性气道高反应性下出现的广泛而可逆性气道狭窄。哮喘气道炎症由多种细胞因子、黏附分子和炎症介质参与,如淋巴细胞、巨噬细胞和中性粒细胞等[5-6]。有研究[7-8]表明,Th1/Th2失衡可引起支气管哮喘,Th1辅助细胞为 CD4+细胞,分泌 IL-2、IFN-γ等对哮喘有一定的抑制作用,还能促进IgG的生成。Th2辅助细胞的主要执行细胞因子为IL-4、IL-5等,能对抗细胞外多细胞寄生虫的免疫反应,另外IL-4、IgE会活化肥大细胞而释放组胺、血清素等,造成气道收缩[9]。
hPMSCs是来源于胎盘组织的新MSCs,较其他来源MSCs抗炎能力更强,具备有多向分化潜能及免疫调节功能[10-11]。hPMSC具有多分化潜能,是一种理想的组织工程种子细胞。不同来源的MSCs生物学特性不尽相同,如骨髓来源MSC造血能力极强,脐血来源MSC有强的向神经细胞分化的潜能,胎盘来源MSC在免疫调控方面更优。由于hPMSCs具有低免疫原性[12]及免疫调节作用,它可向损伤或炎症部位迁移发挥修复、炎症抑制作用。研究[13]显示,hPMSCs较其他MSCs有更强的迁移能力,靶向治疗作用更明显,有着更广阔的应用前景。
HE染色显示,OVA组存在严重炎性改变,支气管黏膜增厚,管腔狭窄,这说明哮喘模型制备成功。hPMSCs组炎性细胞浸润减轻,黏液分泌下降,气道平滑肌增殖减弱,这说明hPMSCs能缓解哮喘发展,减轻哮喘诱发的支气管炎症、细胞浸润的产生;IFN-γ及IL-4分别是Th1和Th2类细胞的代表性细胞因子,ELISA检测结果显示,与OVA组比较,hPMSCs组血清中IgE、IL-4含量下降(P<0.05),而IFN-γ含量上升(P<0.05)。这说明hPMSCs能够抑制哮喘大鼠炎性细胞因子的分泌和IgE的生成,与HE检测结果基本一致。
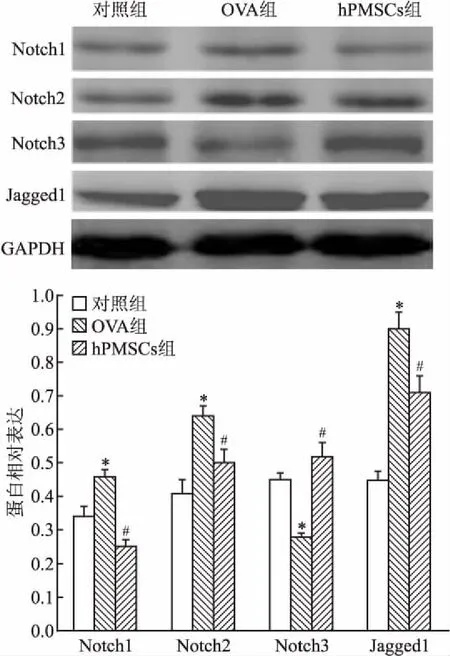
图6 大鼠肺组织中Notch相关蛋白表达水平
与对照组比较:*P<0.05;与OVA组比较:#P<0.05
Notch信号通路是一个在进化上十分保守的跨膜受体蛋白家族,在许多疾病过程中起到重要的作用[14]。一个完整的Notch信号通路包括 Notch受体、 Notch配体及其下游分子[15],对细胞的增殖、分化和凋亡具有重要调节作用。在哺乳类动物中存在有4种Notch受体(Notch1~ 4)及5种配体(Serrate家族配体:Jagged-1、2和Delta家族配体:Delta-1、3、4)。Notch配体能与细胞表面的Notch受体相互调节,激活Notch信号通路,调节外周T淋巴细胞、树突细胞和边缘区B细胞等,并参加细胞免疫功能的调节。哮喘发病的主要特征为活化的T细胞分泌过多的Th2类细胞因子(IL-4、IL-5、IL-13等),而Th1 细胞减少,导致Th1/Th2 失衡,产生包括气道重塑、气道高反应性、黏蛋白分泌过多和气道炎症等症状。研究[16]证明Notch信号通路参与Th1、Th2细胞的增殖、分化过程,阻断 Notch信号将影响Th1、Th2细胞应答。Jagged蛋白可诱导Th2细胞分化,而IFN-γ 能抑制 Th2 细胞的分化和功能。本实验RT-qPCR和Western blot结果表明,与OVA组比较,hPMSCs组Notch1、Notch2、Jagged1 mRNA及蛋白表达水平下降,而Notch3 mRNA及蛋白表达水平上升。这提示Notch信号通路在哮喘发病机制中起着重要作用,同时hPMSCs可能通过抑制Notch受体(Notch1、Notch2)和配体(Jagged1)表达,上调Notch3表达产生影响,改善哮喘气道炎症,而哮喘发生时Notch3表现为抑制作用,这与Maekawa et al[17]报道基本一致。
综上所述,本实验成功复制出哮喘大鼠模型,采用hPMSCs治疗后改善哮喘大鼠肺部病理症状,hPMSCs可能通过Notch通路的调节作用,降低IL-4、IgE水平和增加IFN-γ,减轻气道高反应性和炎症。目前的研究为将来进一步探讨hPMSCs与哮喘之间的关系奠定了基础,hPMSCs可能成为治疗哮喘的新思路。
