微生物法制备松仁肽-锌螯合物及其抗氧化功能的研究
2020-06-11孙家佳杨可心宋希明
孙家佳 张 智 杨可心 魏 罡 宋希明
(东北林业大学林学院1,哈尔滨 150040) (乌兰察布市林业和草原局2,乌兰察布 012000)
我国使用松子已有三千多年的历史,宋代人们把松子视为延年益寿的“长生果”。由于松仁是美味食物,又是食疗佳品,备受历代医学家、营养学家推崇。松仁中含有丰富的蛋白质、氨基酸、不饱和脂肪酸、维生素和矿物质等,尤其是人体所必需氨基酸含量较普通植物的高[1]。张智等[2]对于松仁蛋白的利用提出了微生物发酵生产松仁肽,改善了松仁肽的口味[3]的同时达到了蛋白吸收的营养预期。松仁肽具有良好的功能性及生物活性[4, 5],对人体代谢和生理调节功能,如促进免疫、降血压血脂、抗氧化[6]等作用,是当前国际药学和食品界热门的物质和极具发展前景的功能性因子[7]。
锌存在于众多的酶系中,如碳酸酐酶、呼吸酶、乳酸脱氢酶、超氧化物歧化酶、碱性磷酸酶、DNA和RNA聚合酶等中,是核酸、蛋白质、碳水化合物的合成和维生素A利用的必需物质。具有促进生长发育,改善味觉的作用。锌是人体必不可少的微量元素之一[8],在人体生长发育[9]、生殖遗传等起到至关重要的作用[10]。
多肽-锌螯合物既具有补锌作用[10, 11],同时也具有一些特殊的生物活性[12]。张亚丽[13]利用中性蛋白酶水解脱脂豆粕后形成的多肽与微量元素锌制备多肽螯合锌,添加多肽螯合锌的猪油和鱼油的过氧化值均低于对照组,说明其是具有抗氧化作用的;将多肽-锌螯合物喂食小鼠,发现多肽-锌螯合物具有一定的生物吸收利用率,可以作为食品锌强化剂。近年来,对活性肽的研究尤为突出,并以其为原料,开发易于身体吸收利用[14]、生理活性强的新型补锌剂,已成为热点研究问题[15]。基于螯合物的利用价值较高,并且现有研究仅仅局限化学方法进行螯合,本文主要介绍微生物法螯合,微生物通过自身的生理功能分解蛋白的同时与锌离子结合,形成螯合物,并对该方法及其抗氧化活性进行研究。
1 实验材料
1.1 主要原料与试剂
松仁粕,市售;蛋白胨、酵母膏、葡萄糖、1,1-二苯基-2-三硝基苯肼(DPPH)、铁氰化钾、三氯乙酸、Fe Cl3、H2O2、水杨酸、Fe SO4、98%硫酸等药品均为国产分析纯级。松仁肽(微生物法制备)。
1.2 仪器与设备
756PC紫外分光光度计;HPG-310培养箱;SW-CJ-IFD超净台;离心机LD4-2A等。
1.3 菌种
枯草芽孢杆菌(Bacillussubtilis)ls-45,来源于东北林业大学发酵实验室。
1.4 培养基
斜面培养基:葡萄糖20 g、牛肉膏1 g、蛋白胨5 g、氯化钠5 g、琼脂粉20 g,加热溶解于1 L水中;种子培养基: 葡萄糖20 g、牛肉膏1 g、蛋白胨5 g、氯化钠5 g,溶于1 L的水中;发酵培养基:一定量的松仁粉和硫酸锌溶于水中。
2 实验方法
松仁粕预处理→发酵加锌培养基配置→灭菌→接种→发酵→离心→取上层清液→透析→浓缩→冷冻干燥→粗制松仁肽-锌螯合物
微生物法松仁多肽制备的工艺流程:松仁粕预处理→发酵培养基配置→灭菌→接种→发酵→离心→取上层清液→浓缩→冷冻干燥→粗制松仁肽
2.1 微生物螯合的单因素实验
2.1.1 螯合单因素实验设计
固定发酵培养基中松仁粕的量为12%,以螯合率为指标,微生物螯合当中硫酸锌的添加量、螯合温度、螯合时间和pH等4个因素5个水平来对微生物法螯合松仁肽与锌的工艺进行优化。
2.1.2 微生物法螯合条件单因素实验
生物螯合硫酸锌添加量的影响:硫酸锌的添加量为0.1、0.2、0.4、0.6、0.8 g等5个因素水平,微生物螯合时间为50 h温度为35 ℃,以螯合率作为评价指标,得到最佳添加量。
微生物螯合pH的影响:运用上述实验得出最佳结果进行下一步,pH设计的值为5、6、7、8、9等5个因素水平,以螯合时间为50 h温度为35 ℃,螯合率为指标,寻找出最优的pH值进行螯合。
微生物螯合时间的影响:在以上实验的结果下,设计的时间为20、30、40、50、60 h等。硫酸锌添加量和pH值采用实验最佳结果,温度为35 ℃的条件下进行微生物螯合。指标为螯合率。
微生物螯合温度的影响:在以上三个因素最优的条件下,温度设计为33、35、37、39、41 ℃等5个因素水平。以螯合率为评价指标,得出最佳温度。
2.2 响应面优化实验
按照中心组合实验设计原理,以微生物螯合的硫酸锌添加量、pH、时间、温度等4个因素为自变量,每个因素3个水平,并以螯合率作为响应值,设计响应面实验,见表1。实验重复3次,每次3个平行。

表1 因素水平编码表
2.3 测定的方法
2.3.1 发酵液中肽含量的测定
对于肽的计算,本实验以氮的质量来计算。
氨基态氮的测定采用甲醛快速滴定法,氨基态的氮记作A1。
蛋白分解的可溶性氮(TCA)采用国标方法中的凯氏定氮测定法(GB/T 5009.5—1985),测之前用三氯乙酸处理,测得的氮记作Nt。
N(肽的质量以氮计)=Nt-A1
式中:Nt为发酵液中的可溶性氮(TCA)/g;
A1为发酵液中的氨基态的氮/g。
2.3.2 螯合率的测定
吸取处理后的发酵液5 mL装入透析袋中,以去离子水作为透析液,透析10 h后测透析液中未被螯合上的锌离子。锌离子的测定采用国标食品中锌的测定方法中的二硫腙比色法(GB 5009.14—2017),按标准绘制锌离子的标准曲线。此法测得的锌离子量记作M0;加入到发酵培养基的锌离子的量记作M1。

式中:M0为未被螯合上的锌离子的质量/μg;M1为加入螯合培养基中锌离子的质量/mg。
2.3.3 DPPH自由基清除率的测定
取DPPH 3.5 mg,用无水乙醇溶解,转入10 mL容量瓶,用无水乙醇定容至刻度。取2 mL至100 mL的容量瓶中,摇匀得浓度为0.017 8 mmol/L DPPH储备液备用。用乙醇将松仁肽-锌的螯合物稀释一定浓度,待测。在10 mL比色管中一次加入4 mL DPPH和螯合物的稀释液,加入乙醇至刻度,混均匀立即在517 nm的波长下测吸光值[16]记为Ai。将待测液在室温避光的条件下保存30 min后测吸光值。记为Aj。对照试验为只加DPPH的乙醇溶液,测吸光值为Ac,按下式计算自由基清除率(K)[17]。
2.3.4 还原力的测定
取1 mL三种不同质量浓度的3种待测样品溶液,分别与 pH为6.6,浓度为0.2 mol/L,2.5 mL的磷酸钠缓冲液和2.5 mL的铁氰化钾混合,在50 ℃,保温30 min,后迅速冷却,再加入2.5 mL三氯乙酸后离心3 000 r/min,10 min后取2.5 mL的上清液,加入2.5 mL蒸馏水和0.5 mL氯化铁溶液,混合均匀[18]。反应10 min,后在700 nm波长下测吸光度,比较3种被测样品的还原能力,吸光度越大说明还原能力越强[19]。
2.3.5 羟自由基的测定
H2O2与亚铁离子生成·OH,·OH自由基具有较高的反应活性,因为存活时间较短,加入水杨酸,会与·OH 自由基反应生产紫色络合物,该有色络合物在510 nm出有较大的吸收波长,吸光度与·OH 自由基的量成正比[20, 21]。反应体系中含有9 mmol/L乙醇-水杨酸溶液,9 mmol/L硫酸亚,8.8 mmol/L H2O2。比色管中依次加入硫酸亚铁,水杨酸、去离子水,最后加入H2O2,摇匀,在37 ℃条件下反应30 min,以蒸馏水归零,在510 nm的波长下测吸光度[22, 23]。
式中:A0空白对照组的吸光度;AX加入样品后的吸光度;AX0不加显色剂H2O2样品溶液本底的吸光度。
3 结果与分析
3.1 微生物螯合的单因素实验结果
通过实验得到的数据表明硫酸锌的添加量对螯合率的影响较大,由图1可知,当硫酸锌的添加量为0.6 g时的螯合率最高,这时的螯合物的结合状态最好,产生的螯合物量较多,综合的来看,发酵法螯合的硫酸锌添量为0.6 g最为合适;在pH为7 的条件下螯合率最高,在微生物学当中pH 对微生物来说具有较大的影响,在适宜的pH值下微生物能够很好地生长,通过微生物生理活性的作用下更能促进蛋白分解为小分子肽,并使多肽与锌离子更好的结合。所以综合分析,在微生物法螯合时应选择pH 7的条件;运用微生物法螯合,要选择合适的时间,使微生物处于最佳的菌龄,才能更好的发挥微生物的作用,在50 h时螯合率最高,想得到最佳的发酵工艺,使螯合率和螯合物的活性最强,所以选择发酵螯合时间为50 h;温度对于微生物的生长和锌离子的螯合是有着重要的影响,所以对于温度进行单因素实验,实验结果表明,随着温度的增加螯合率是呈先增长后下降的趋势,随着温度的增加将会影响微生物的一些生理活性,从而导致微生物的作用减少,影响了螯合率以及螯合物的生物活性,所以综合分析在运用微生物法螯合时温度应选择最为适宜的,该实验则选择温度为37 ℃。

图1 不同因素对螯合率的影响
3.2 螯合条件响应面优化实验
在单因素的实验基础上,根据表1,采用Box-Behnken设计方法,来对松仁肽与锌螯合工艺进行优化,响应面方案及结果见表2。
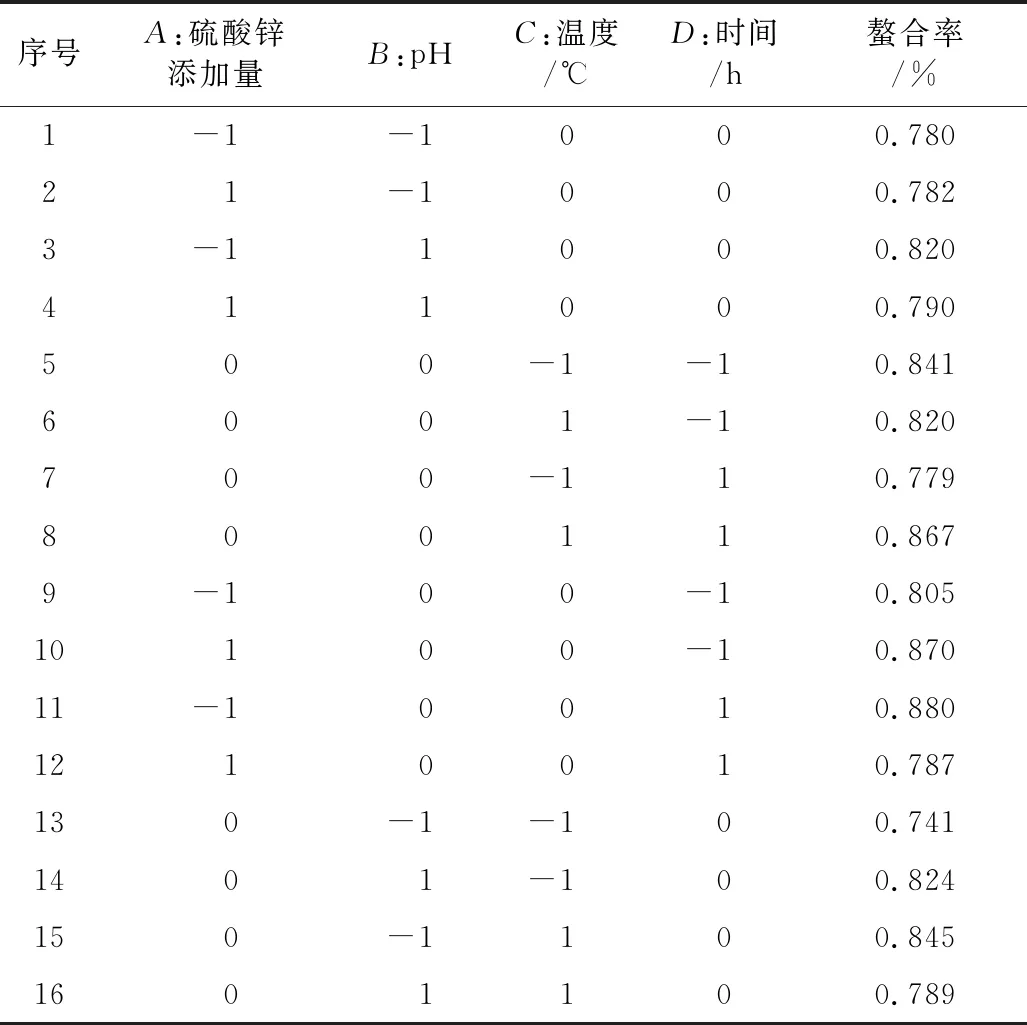
表2 Box-Behnken实验设计及数据分析

续表2
3.2.1 螯合率分析结果
采用 Design-Expert.8.0.6对实验数据进行拟合,以螯合率为指标,得到回归方程如下:Y1=0.938 2-0.006 4A+0.011B+0.019C-0.002 6D-0.038AC-0.039AD-0.035BC-0.022BD+0.027CD-0.071A2-0.068B2-0.072C2-0.033D2
由表3可知,模型中P<0.000 1,R2=0.982 1,表明此模型极其显著。失拟项P=0.845 8>0.05,影响不显著,说明结果可靠。由回归方程的显著性检验可知,模型中C、AC、BC、CD、B2、C2对螯合率的影响极显著,B、AD、BD对螯合率的影响显著,其他因子影响不显著。各因素对螯合率影响的大小依次为:C>B>A>D。
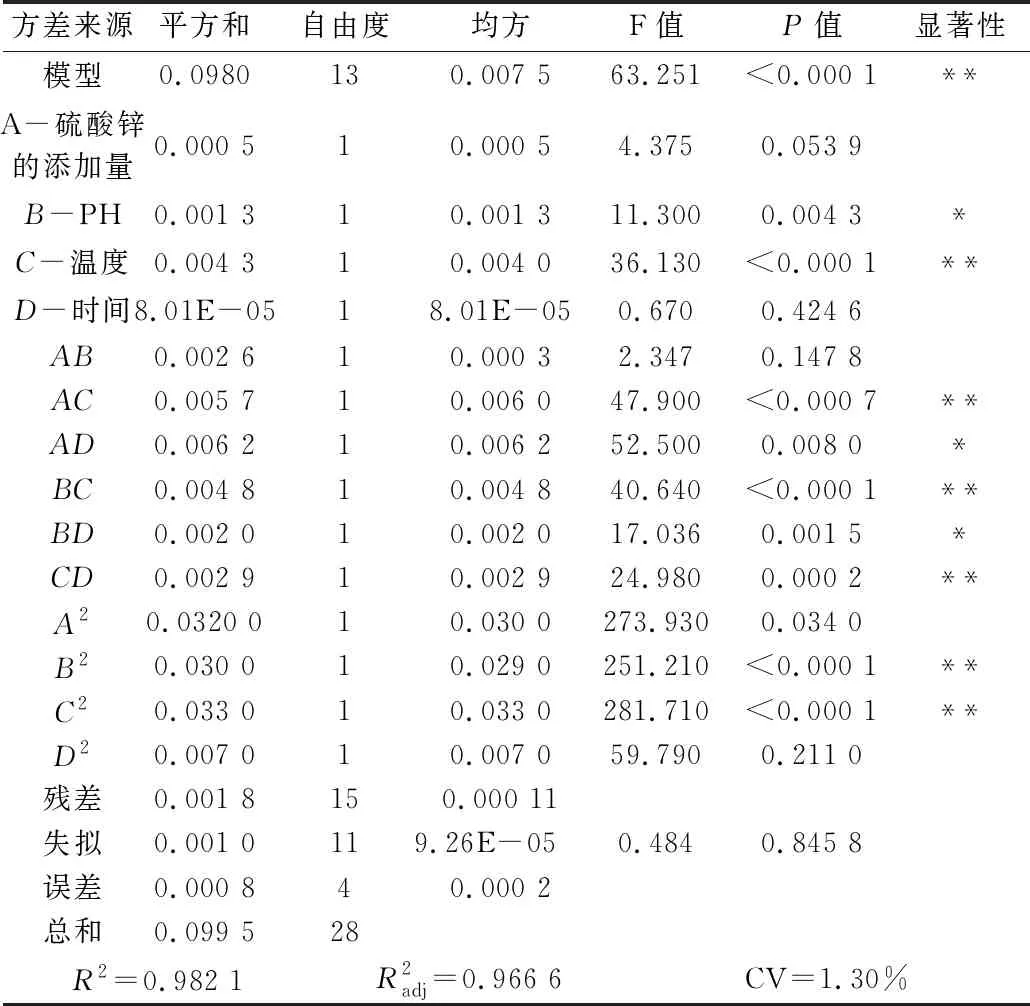
表3 螯合率回归模型的方差分析
注:“*”在 0.01 水平显著;“**”在 0.001 水平显著。
硫酸锌添加量、pH、时间和温度中任意2个因素为零水平时,剩下2个因素均可对螯合率产生不同程度的影响。通过面陡峭程度判断因素对响应值影响的显著性。结果显示: pH和温度对螯合率的影响显著,随着这2个因素值的升高,螯合率均先上升后下降,其他两个因素相比较没有那么显著。这与表3中的方差分析的结果一致。
3.2.2 最佳工艺参数及验证实验
根据方程计算可得最佳工艺方案为:硫酸锌的添加量为0.6 g,螯合时间为50.36 h,温度为38.46 ℃,pH为7.41。螯合率理论值为91.35%。根据实际情况将实验方案调整为,硫酸锌的添加量为0.6 g,时间为50 h,温度为38 ℃,pH值为7,在此条件下,实验重复三次,最终测得螯合率为90.60%、92.48%。与理论值相差不大,所以经响应面优化的工艺条件是可靠的。
3.3 松仁肽-锌螯合物的体外抗氧化性质实验
微生物发酵的松仁肽与松仁肽-锌螯合物抗氧化能力的对比,并以VC作为对照。
3.3.1 DPPH自由基的测定
由图2可知,松仁肽和松仁肽-锌螯合物在不同的浓度下均表现出来很强的DPPH自由基的清除能力,随浓度的增加,DPPH 自由基清除率也增加,VC对DPPH自由基的半数抑制质量浓度(IC50)为2.123 mg/mL,松仁肽对DPPH自由基的半数抑制质量浓度(IC50)为1.564 3 mg/mL,松仁肽-锌的螯合物对DPPH自由基的半数抑制质量浓度(IC50)为3.841 mg/mL,在实验测定的质量浓度范围内,10mg/mL样品的清除作用最强,松仁肽的自由基清除率为84.06%,松仁肽-锌螯合物的自由基清除率为90.31%,VC 的自由基清除率为94.36%。三者质量浓度均与DPPH自由基清除率有显著的正相关性(松仁肽、松仁肽-锌螯合物、VC的R2分别为0.941 01、0.922 85、0.918 8)。螯合物的DPPH 自由基清除率均

图2 不同浓度的螯合物和松仁肽对DPPH自由基的清除能力
高于单纯肽,DPPH自由基清除能力是基于DPPH自由基接受抗氧化剂提供的氢原子使奇数电子的氮原子减少从而引起体系中颜色的降低,抗氧化剂清除DPPH自由基效果主要依赖于其供氢的能力[24],由此可推测松仁肽-锌螯合物在清除自由等一些连锁反应具有一定的功能,且松仁肽-锌的螯合物要高于松仁肽,但是两者均小于阳性对照组VC的清除率。
3.3.2 还原力的测定
由图3可得,在一定质量浓度范围内,随着质量浓度的增大,松仁肽和松仁肽-锌螯合物的吸光度不断升高,还原能力不断增强,说明样品质量浓度越大,其还原作用越强,两者存在着明显的剂量依赖关系。松仁肽和松仁肽-锌螯合物的还原能力与其质量浓度之间基本上呈直线性关系,阳性对照VC的还原能力与质量浓度呈正相关,也存在剂量依赖关系,并且也是呈直线性关系。三者质量浓度均与还原能力有显著的正相关性(松仁肽、松仁肽-锌螯合物、VC的R2分别为0.965 99、0.949 18、0.980 12),但松仁肽的还原能力始终低于同质量浓度的松仁肽-锌螯合物,二者始终低于同质量浓度的VC。研究表明[25],多肽类物质的抗氧化性质与还原能力之间具有相关性,所以还原能力可以作为一种衡量抗氧化能力的指标。因此松仁肽和松仁肽-锌的螯合物就有较强的还原能力同时也具有抗氧化性。且松仁肽-锌螯合物的还原能力更强。

图3 不同浓度的螯合物和松仁肽的还原能力
3.3.3 羟自由基的测定
由图4可知,松仁肽和松仁肽-锌螯合物均表现出较强的清除·OH活性。在一定质量浓度范围内,对·OH的清除率随着质量浓度的增加而增加,但二者清除率均低于阳性对照VC。通过清除率-质量浓度回归曲线可知VC对·OH的IC50为0.513 mg/mL,松仁肽-锌螯合物对·OH的IC50为1.346 mg/mL,松仁肽对·OH的IC50为1.725 mg/mL,6 mg/mL样品的清除作用最强,松仁肽清除率达80.56%,松仁肽-锌螯合物清除率达88.96%,在相同质量浓度下VC对·OH的清除率为92.53%。三者质量浓度均与·OH清除率有显著的正相关性(松仁肽、松仁肽-锌螯合物、VC的R2分别为0.988 75、0.976 48、0.993 27)。·OH被认为是引发机体内组织细胞病变,导致疾病与加速衰老最直接的自由基[26],实验结果证明,松仁肽-锌螯合物具有较强的·OH清除率,因此推测其具有减少疾病的发生和延缓衰老的作用,且松仁肽-锌螯合物的清除能力强于松仁肽,但两者均弱于阳性对照VC。

图4 不同浓度的螯合物和松仁肽对·OH的清除能力
4 讨论
早在十九世纪六十年代中期,研究者就发现肽具有促进锌吸收的作用。大量的研究结果发现,肽能与锌离子发生反应,生成化学性质稳定、可溶的肽锌螯合物。这种螯合物能够使锌元素不受胃肠道中植酸等各类物质的影响,并能以肽的吸收模式进入体内,给人体补锌提供了新的途径[27]。本实验研究了微生物法对松仁肽-锌进行螯合,运用枯草芽孢杆菌将松仁蛋白分解为小分子肽的同时与锌离子螯合,得出最佳生产工艺参数为:硫酸锌的添加量为0.6 g,螯合时间为50.36 h,温度为38.46 ℃,pH值为7.41。影响发酵螯合反应的因素水平温度最大,其次是pH。优化得到螯合率为90.60%,与理论值相差不大,工艺参数可行。通过对松仁肽和松仁肽-锌螯合物抗氧化的研究,螯合物的还原能力高于松仁肽且还原能力随质量浓度升高而增强。二者均可有效的清除DPPH自由基和·OH,螯合物的清除力强于松仁肽。锌离子与肽形成配合物后呈现出多样的生物功能活性,如抗氧化、抗菌、免疫调节、抗衰老等生物活性,综合以上结论,松仁肽与锌螯合后得到了生物活性高而且毒性低的有机锌化合物,且能很好的为机体补锌,松仁肽螯合后的松仁肽-锌螯合物的抗氧化能力强于螯合前的松仁肽。同时松仁肽的抗氧化活性对于开发松仁肽-锌螯合物功能性食品提供了方向和理论基础,具有应用指导意义,但具体的抗氧化功能机理需进一步研究,微生物法制备松仁肽-锌螯合物的抗氧化功能性需要做体内的实验进行验证。
