一种检测生活饮用水和污水中生物有效性铜离子的微生物报告菌株的构建
2020-06-11周怀彬王娟娟赵建国洪旭芬庞一林李江辉谭国强
周怀彬,王娟娟,赵建国,洪旭芬,庞一林,李江辉,谭国强
(温州医科大学检验医学院生命科学学院检验医学教育部重点实验室浙江省医学遗传学重点实验室,浙江温州325035)
研究发现过量的重金属铜对所有的生命体都有毒害作用[1]。随着工农业的发展,许多含铜污染物被排放到环境中[2-4],对人们的生活与健康造成了巨大威胁,因此,监测与防治环境中重金属铜的污染已不容忽视。检测铜的传统方法主要有原子吸收光谱法[5]和电感耦合等离子体质谱法[6]。但这些方法检测成本高以及操作繁琐,并且重金属在环境中是以多种形态存在的,因此,通过检测其总量难以客观评价环境中重金属的生物有效性与毒性效应[7]。而微生物报告菌株/全细胞微生物传感器能够有效弥补传统方法的上述不足之处[8-9]。因为经过基因改造的工程菌株能以剂量依赖方式响应环境中特定化学物或一类化学物[10]。
本研究利用Red重组系统删除了3 个铜离子(Cu2+)“外排泵”基因,获得了对Cu2+高度敏感的E.coliΔcusA-ΔcopA-ΔcueO突变菌株,从而有利于微生物报告菌株富集水环境样品中痕量Cu2+,有效提高了报告菌株的检测灵敏度以及精确度。本研究构建的微生物报告菌株可与理化分析法互补分析水环境中铜的生物有效性及其总量,从而综合评价水环境中铜的生物毒性效应。
1 材料和方法
1.1 材料 野生型E.coliMC4100 购于中国普通微生物菌种保藏管理中心;质粒pKD46、pKD3、pCP20、NGC-pMD19-T、pBAD-HisB和pET28a,菌种pET-28a/BL21、DH5α、NGC-T/DH5α和BL21均为浙江省医学遗传学重点实验室保存;pMD19-T购自日本TaKaRa公司。
1.2 引物设计 根据Ecogene网站提供的目的基因及其启动子与转录终止(CopAp、soxS、copA、cueO、cusA)序列及已知的gfpmut2基因序列,使用Primer5.0软件设计引物(见表1-2),部分引物在基因的5′端或3′端引入酶切位点。
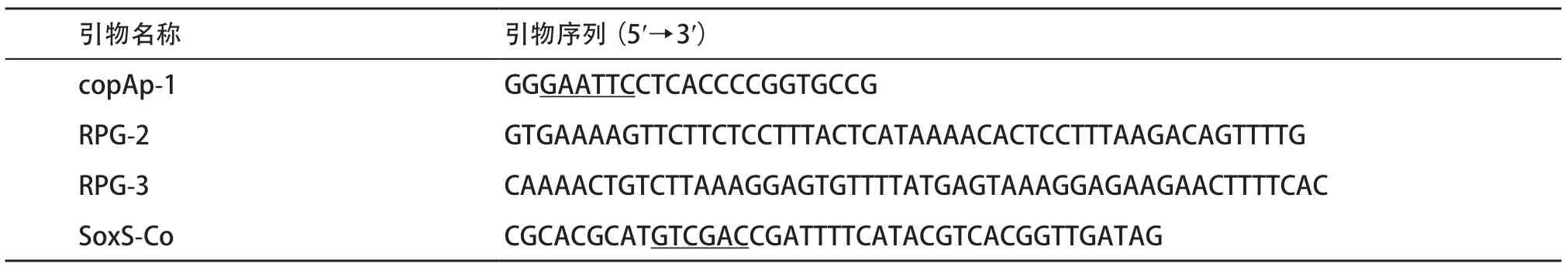
表1 用于构建报告基因的引物序列

表2 用于基因敲除和菌落PCR鉴定的引物序列
1.3 主要仪器 Milli-QAdvantageA10超纯水系统(德国Millipore公司),HZQ-X100振荡培养箱(哈尔滨东联电子技术开发有限公司),DU-800核酸-蛋白分析仪(美国Beckman公司),电转化仪(美国BIORAD公司),RF-5301荧光分光光度计(日本岛津公司)。
1.4 方法
1.4.1 融合基因的制备与报告载体的构建:利用引物CopAp-1和RPG-2,以E.coli基因组作为模板扩增出具有融合位点的CopAp基因,利用引物RPG-3和soxSCo,以质粒NGC-pMD19-T作为模板扩增出具有相应融合位点的gfpmut2基因;将2个含有互相重叠位点的CopAp基因和gfpmut基因按照等摩尔的比例加入反应体系中作为模板,利用Pyrobest酶和ExTaq酶,以CopAp-1和SoxS-Co为引物进行PCR扩增(见图1),PCR条件为:94℃4min;94℃30s,60℃30s,72℃3min,35 个循环;72℃10min;25℃5min。
扩增产物(CopAp::gfpmut2)经电泳检测、切胶回收、加A反应后与pMD-19T载体连接,测序分析正确后再将其连接到表达载体pET28a上,获得报告载体CopAp::gfpmut2-pET28a。将报告载体转化DH5α后挑取阳性克隆提取质粒酶切鉴定,鉴定正确的克隆扩大培养后,用质粒提取试剂盒提取质粒,-20℃冻存备用,同时于-80℃菌种保存。
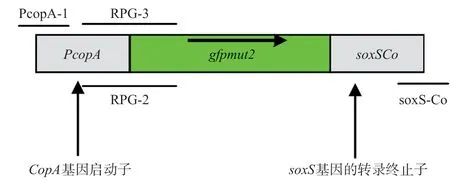
图1 采用交叉PCR技术构建检测Cu2+的报告基因
1.4.2 利用Red重组系统构建缺失copA、cueO 和cusA基因的Cu2+敏感菌株:以pKD3为模板,以各自敲除基因的引物PCR扩增含FRT位点(FLP重组酶识别位点)的氯霉素抗性基因(见图2Step1),将其电转化至含pKD46质粒的E.coliMC4100中(见图2Step2)。pKD46/MC4100细菌感受态制备时经0.02%(m/v)阿拉伯糖诱导,使pKD46质粒在菌体内表达Gam、Bet和Exo3种λ噬菌体重组酶,其中Gam重组酶抑制大肠杆菌的RecBCD核酸外切酶V活性,使转入氯霉素基因不被降解[11],同时在Exo和Bet重组酶辅助下氯霉素基因与3种待敲除基因copA、cueO、cusA的同源臂发生同源重组,从而置换出3个目的基因(见图2Step3),获得到copA::cat/MC4100、cueO::cat/MC4100和cusA::cat/MC41003种突变菌。然后将温度敏感型质粒pCP20(42℃诱导FLP重组酶表达的同时质粒也逐渐丢失)[11]转化至上述3种突变株感受态细胞中,消除FRT位点间的氯霉素抗性基因(见图2Step4),分别得到copA、cueO和cusA基因缺失的单突变菌株。

图2 采用Red重组系统进行基因敲除实验
同样操作,在单基因突变菌的基础上制备双基因突变菌及三基因突变菌。经PCR鉴定正确后共制备得到以下7种突变菌:单基因突变菌:ΔcopA、ΔcueO 和ΔcusA;双基因突变菌:ΔcopA-ΔcueO、ΔcopA-ΔcusA 和ΔcueO-ΔcusA;三基因突变菌:ΔcopA-ΔcueO-ΔcusA。
1.4.3 含报告载体的微生物报告菌株的构建:将报告载体CopAp::gfpmut2-pET28a转化至E.ColiMC4100和7种突变菌中,然后对每种细菌分别进行CopAp::gfpmut2目的基因PCR鉴定与突变菌PCR鉴定,确保重组质粒转化成功。
1.4.4 野生菌和7 种突变菌及其对应的微生物报告菌株对Cu2+的敏感性测定:将野生菌株及7种突变菌株过夜培养,转接至新鲜的M9基础培养基中扩大培养2h左右,用M9基础培养基将吸光度稀释至OD600为0.005后分装,加入Cu2+溶液,使其终浓度分别为0、0.125、0.25、0.5、1、2、4、8、16、32μmol/L,37℃、250r/min振荡培养,检测其10h内浊度改变,间隔2h测量各管菌液OD600值。重复实验3次,每次操作3份平行管。
取8种含报告载体的宿主菌的过夜培养菌以新鲜LB培养基1:50稀释并扩大培养至OD600为0.5左右,分装,加入等体积不同浓度的铜标准溶液至各管菌液终浓度分别为1×10-10、1×10-9、1×10-8、1×10-7、1×10-6、1×10-5、1×10-4、1×10-3mol/L,另加等体积去离子水作为对照,每种浓度各做3份平行管。将菌液于37℃、250r/min振荡培养2h后,取100μL菌液10 倍稀释于0.9mLpH8.0Tris-HCl缓冲液中,加入34mg/mL氯霉素1μL(终浓度为34μg/mL),分别测量各管细菌稀释液荧光强度及OD600值,并绘制曲线。
1.4.5 报告菌株检测Cu2+的最佳实验条件的优化:用移液枪吸取计算好的CopAp::gfpmut 2-pET28a/ΔcusA-ΔcopA-ΔcueO过夜菌种子液加入到50mL新鲜LB液体培养基中,使起始菌液OD600值约为0.02,于37℃、250r/min振荡培养至OD600值分别为0.1、0.2、0.3、0.4、0.5和0.6,然后加入Cu2+溶液,使其终浓度为100μmol/L,另加等体积无菌MilliQH2O作为阴性对照。将菌液于37℃、250r/min振荡培养4h后分别测量细胞荧光强度与浊度变化(为了使背景散射和内滤效应最小化,需要报告菌株的全细胞悬浮液的OD600≤0.3[12])。
此外,本研究也摸索了诱导时间对报告菌株检测不同浓度Cu2+的灵敏度和线性范围曲线拟合的影响。首先用移液枪吸取计算好的CopAp::gfpmut2-pET28a/ΔcusA-ΔcopA-ΔcueO过夜菌种子液加入到100mL新鲜LB液体培养基中,使起始菌液OD600值约为0.02,于37℃、250r/min震荡培养至OD600值约为0.5,分装(0.99mL/管),然后加入10μL不同浓度的Cu2+溶液至各管菌液,使其终浓度分别为10-7、5×10-7、10-6、5×10-6、10-5mol/L,另加等体积无菌MilliQH2O作为阴性对照。每种浓度各做9个平行管(每次取3个平行管)。将以上菌液于37℃、250r/min振荡培养2、3、4h后,4000r/min水平离心10min,弃上清液,收获的菌体重悬于1mLDB中,然后取50μL重悬菌液20倍稀释于0.95mLDB中,混匀,分别测量其稀释液荧光值与OD600值。实验重复3次。
1.4.6 GFPmut2在微生物报告菌株中的诱导表达情况及鉴定:取CopAp::gfpmut2-pET28a/ΔcusAΔcopA-ΔcueO过夜培养菌以1:50扩大培养至OD600为0.5左右,分装,加入等体积不同浓度的铜标准溶液至各管菌液,使终浓度分别为1.0×10-8、1.0×10-7、1.0×10-6、1.0×10-5、1.0×10-4、1.0×10-3mol/L,另加等体积去离子水作为空白对照。同时取pET28a/ΔcusA-ΔcopA-ΔcueO菌液作为阴性对照。将以上菌液于37℃、250r/min振荡培养3h,收获细菌,重悬于pH8.0Tris-HCl缓冲液中拍照。并选取铜浓度最高的诱导样品,在激发波长为481nm条件下进行490~600nm范围波长扫描,并用同样的激发波长在激光共聚焦显微镜下观察。
1.4.7 微生物报告菌株检测Cu2+的特异性研究:选择CopAp::gfpmut2-pET28a/ΔcopA菌株进一步研究其对其它金属离子的响应情况,观测其是否能被其他金属离子启动诱导表达GFPmut2蛋白。取CopAp::gfpmut2-pET28a/ΔcopA过夜培养菌以1:50扩大培养至OD600为0.5 左右,分装后以终浓度为100μmol/L的不同二价金属离子(Mn2+、Co2+、Ba2+、Fe2+、Ca2+、Mg2+、Zn2+、Cu2+、Pb2+、Cr2+)37℃诱导3h,分别取40μL菌液15倍稀释于pH8.0Tris-HCl缓冲液中,测量荧光强度与OD600值。
1.4.8 流式细胞术分析报告菌株检测信号的稳定性与可重复性:用移液枪吸取计算好的CopAp::gfpmut2-pET28a/ΔcopA-ΔcueO-ΔcusA过夜菌种子液加入到20mL新鲜LB液体培养基中,使起始菌液OD600值为0.02,加入10μLKana(100mg/mL),37℃、250r/min扩大培养至OD600为0.5左右,分装(0.99mL/管),加入10μL不同浓度的Cu2+溶液至各管菌液,使其终浓度分别为1.0×10-8、1.0×10-7、1.0×10-6、1.0×10-5、1.0×10-4、1.0×10-3mol/L,另加等体积无菌MilliQH2O作为阴性对照。将以上菌液于37℃、250r/min振荡培养3h后,4000r/min水平离心10min,弃上清液,收获的菌体用经0.22μm无菌滤膜过滤的0.9%氯化钠溶液(含有终浓度为20μg/mL氯霉素)重悬洗涤2~3次后,根据其OD600值将菌液浓度大致调为5×106CFU/mL,并于37℃震荡孵育15min以获得浓度均一的菌悬液。然后取1mL样品移入流式管中。以激发光波长为488nm,发射光波长为505~545nm的检测参数对样本进行分析测试。仪器设定为每个样本检测10000个细胞。实验重复3次。
1.4.9 确定报告菌株CopAp::gfpmut2-pET28a/ΔcopA-ΔcueO-ΔcusA 检测Cu2+的线性范围:取CopAp::gfpmut2-pET28a/ΔcopA-ΔcueO-ΔcusA过夜培养菌以1:50扩大培养至OD600为0.5左右,分装,加入等体积不同浓度的铜标准溶液至各管菌中,使Cu2+终浓度分别为5.0×10-8、1.0×10-7、2.5×10-7、5.0×10-7、7.5×10-7、1.0×10-6、2.5×10-6、5.0×10-6、1.0×10-5mol/L,另加等体积去离子水作为对照,每种浓度各做3份平行管。将以上菌液于37℃、250r/min振荡培养3h,取100μL菌液15倍稀释于1.4mLpH8.0Tris-HCl缓冲液中,加入氯霉素使终浓度为34μg/mL,分别测量各管细菌稀释液荧光强度及OD600值,并绘制曲线进行曲线拟合。
1.4.10 加标回收实验:首先配制含MOPS缓冲剂的培养基:1g/L胰蛋白胨、0.5g/L酵母膏、1g/LNaCl,先加50mLMilliQH2O,振荡至完全融解后加MilliQH2O定容至80mL,高压蒸汽灭菌(121℃、30min),再加入10mL400mmol/L无菌MOPS缓冲液(pH7.2)[13],混匀。其次从温州医科大学茶山校区采集一个生活饮用水样品,经0.22μm的无菌过滤器过滤。并在过滤后的生活饮用水中加入铜单元素标准品,使其终浓度分别为0.5和10mg/L,并采用原子吸收光谱法测定两种水样中铜含量。最后用移液枪吸取计算好的CopAp::gfpmut2-pET28a/ΔcopA-ΔcueO-ΔcusA过夜菌种子液加入到上述90mL含MOPS缓冲液的LB液体培养基中,使起始菌液OD600值约为0.02,37℃、250r/min震荡培养至OD600值约为0.5,分装(0.9mL/管),然后分别加入100μL上述含不同浓度Cu2+的生活饮用水,每种浓度各做3 个平行管。将以上菌液于37℃、250r/min振荡培养3h后,4000r/min,水平离心10min,弃上清液,收获的菌体重悬于1mLDB中,然后取50μL重悬菌液20倍稀释于0.95mLDB中,混匀,分别测量其稀释液荧光值与OD600值。然后根据标准曲线的回归方程计算样品中Cu2+的加标回收率。
2 结果
2.1 报告载体CopAp::gfpmut2-pET28a的构建 通过PCR扩增,得到大小为1500bp产物,与预期结果相符;阳性克隆质粒用EcoRI和SalI双酶切鉴定,同样也能切出1500bp的目的片段,目的片段序列经测序分析确证,表明报告载体CopAp::gfpmut2-pET28a构建成功(见图3)。
2.2 copA、cueO和cusA基因缺失的Cu2+敏感菌株的构建 以CopA-No和CopA-Co、CueO-No和CueO-Co、CusA-No和CusA-Co为引物,分别对野生型E.ColiMC4100和通过基因敲除得到的7种突变菌进行PCR鉴定。如图4所示,基因敲除后对应的PCR扩增片段约为1000bp,而未被敲除的菌株PCR扩增产物均与野生型菌PCR扩增产物条带的大小一致。
2.3 野生菌及7种突变菌对Cu2+的敏感性 通过3次独立重复实验测定野生型E.coliMC4100以及7 种突变菌株对Cu2+的敏感性,得出8 种E.coli 各自的最小抑菌浓度(minimalinhibitoryconcentration,MIC)(见表3)。研究发现,培养10h后,由于培养基营养成分耗尽,部分细菌吸光度有所下降,故以0~8h作为细菌生长情况的监测时段。并且规定:8h后,使试验管OD600值与对照管OD600值之比不大于10%的最低Cu2+浓度为细菌的MIC。
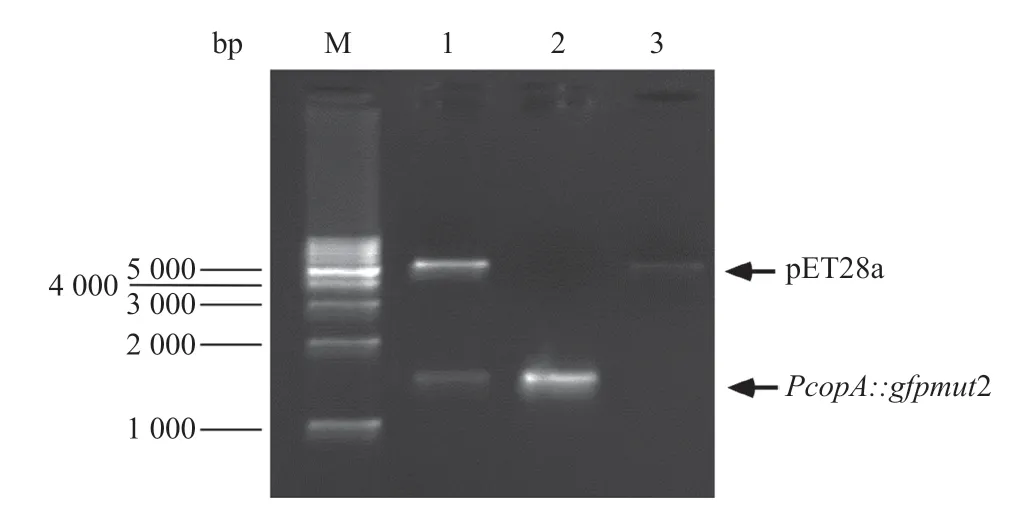
图3 CopAp::gfpmut2-pET28质粒的双酶切鉴定图谱
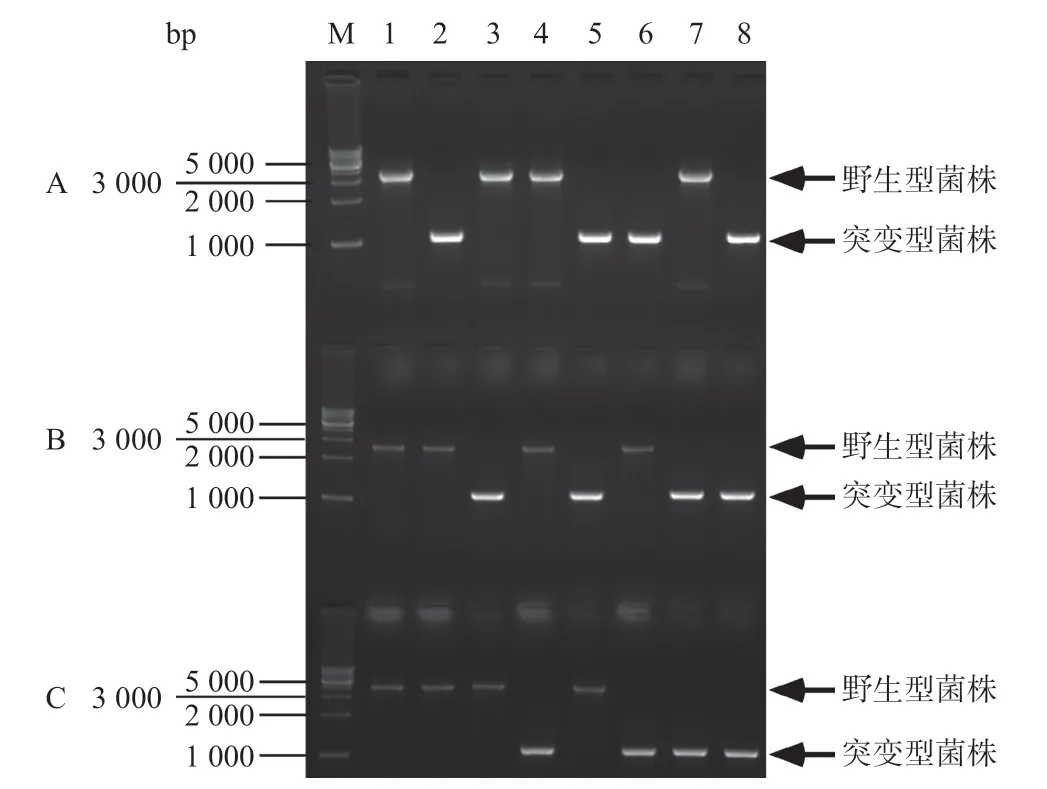
图4 野生型E.coliMC4100及其7种突变菌株的菌落PCR鉴定图谱
如表3所示,copA、cueO和cusA基因缺失的突变菌与野生型细菌相比,对Cu2+的敏感性均有一定程度的增加,其中以ΔcopA、ΔcopA-ΔcusA和ΔcopAΔcueO-ΔcusA对Cu2+最为敏感,其敏感程度均为野生型的64倍。由此推测,CopA在野生型E.coli 耐受Cu2+的机制中起主导作用。
2.4 鉴定Cu2+对微生物报告菌株细胞内荧光蛋白的诱导表达 以不同浓度的Cu2+诱导CopAp::gfpmut2-pET28a/ΔcusA-ΔcopA-ΔcueO菌株荧光蛋白的表达,肉眼可见细菌重悬液呈现明亮的绿色(见图5A),且随Cu2+浓度升高而颜色加深。其中图5A中样品8的发射光谱结果显示在481nm激发光激发下在507nm处具有最大吸收峰(见图5B),这些特征符合GFPmut2蛋白的荧光特征,这也证实了目的蛋白的表达;并且激光共聚焦显微镜图谱显示与10-4mol/LCu2+孵育后的整个报告菌株的菌体呈现亮绿色(见图5C),更进一步验证了Cu2+可以诱导荧光蛋白的表达。

表3 Cu2+对野生型E.coliMC4100及其7种突变菌株的MIC(μmol/L)

图5 经Cu2+诱导后微生物报告菌株的表征图谱
2.5 微生物报告菌株检测水体中Cu2+最佳参数的优化 如图6A-B所示,当初始细菌浊度在0.4~0.6时,加入100μmol/LCu2+与微生物报告菌株孵育4h后,微生物报告菌株的生长已进入平台期,细胞荧光信号的累积以及荧光值与细菌浊度的比值同样也进入平台期,不再随菌株浊度的变化而显著变化。因此,本研究确定Cu2+诱导报告菌株累积荧光信号的最佳起始OD600值为0.5。
如图6C所示,随着与Cu2+孵育时间的延长,报告菌株荧光信号的累积与孵育时间呈正相关。但是孵育4h后,细胞中累积的相对荧光强度反而有所下降,这可能是由于细胞进入衰退期所致。经曲线拟合分析表明在3h时,在10-7至10-5mol/LCu2+浓度范围内,报告菌株CopAp::gfpmut2-soxSCopET28a/ΔcusA-ΔcopA-ΔcueO累积的荧光信号强度与Cu2+浓度呈线性依赖关系,相关系数为0.99529。因此,本研究选择3h为报告菌株与Cu2+最佳孵育时间。
此外,本研究也分析了水环境pH值对报告菌株细胞内增强型绿色荧光蛋白稳定性的影响。如图6D所示,当水环境pH值小于6时,GFPmut2荧光信号显著降低,在此pH值区间范围内,荧光信号强度与pH值大小负相关;在pH值为6~8.5范围内,GFPmut2发射的荧光信号强,且非常稳定。因此,本研究采用pH8.0Tris缓冲液重悬菌体后再进行荧光信号的检测。并且规定加入LB培养基中水环境样品的体积不能超过培养基体积的1/50,从而避免水环境样品对培养体系pH值和渗透压的显著干扰。
2.6 微生物报告菌株CopAp::gfpmut2-pET28a/ΔcusA-ΔcopA-ΔcueO 对Cu2+的特异性分析 CopAp::gfpmut2-pET28a/ΔcopA报告菌株与终浓度为100μmol/L的不同二价金属离子(Mn2+、Co2+、Ba2+、Fe2+、Ca2+、Mg2+、Zn2+、Cu2+、Pb2+、Cr2+)孵育3h后,测量各样品的荧光及OD600值,分别将各金属离子诱导的荧光/吸光度值与Cu2+诱导后的荧光/吸光度值(定义为100%)的百分比值为纵坐标绘制柱状图。如图7所示,上述10种金属离子,只有Cu2+能够诱导报告菌株表达荧光蛋白,说明本研究构建的报告菌株具有很好的Cu2+响应特异性。
2.7 对比分析8种微生物报告菌株检测Cu2+的灵敏性 根据8种微生物报告菌株对Cu2+的响应曲线的实验结果表明,单独缺失cueO或cusA,或者同时缺失cueO和cusA基因,对提高报告菌株检测Cu2+的灵敏性,几乎没有显著性影响。而缺失copA 基因的系列报告菌株对Cu2+的灵敏度显著增强,尤其以ΔcusA-ΔcopA-ΔcueO三突变菌株为宿主菌的报告菌株对Cu2+的响应能力最强,产生的荧光信号也最强(见图8)。综上所述,本研究采用Red重组系统改造野生型E.coli 之后,可以显著提高报告菌株的检测性能。
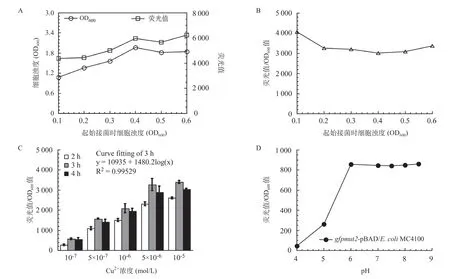
图6 微生物报告菌株检测水体中Cu2+最佳参数的优化
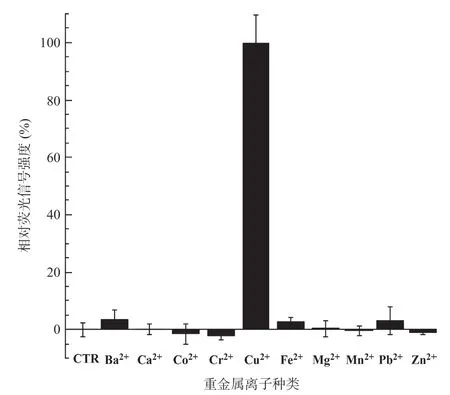
图7 微生物报告菌株CopAp::gfpmut2-pET28/ΔcusA-ΔcopA-ΔcueO对Cu2+的特异性响应图谱
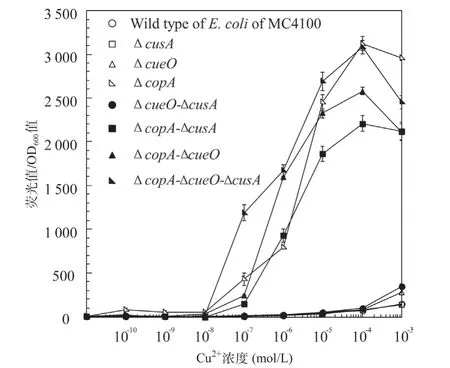
图8 敲除参与Cu2+外排转运基因对报告菌株响应Cu2+效果的影响
2.8 流式细胞术分析报告菌株荧光信号的稳定性与可重复性 TOM-PETERSEN等[14]研究表明,将Cu2+感应元件CopAp::gfpmut2插入到质粒载体中,会存在荧光本底值高和荧光信号不够稳定的缺陷。但是,目前已有文献报道的检测Cu2+的微生物报告菌株,检测元件都是位于质粒中[7,15]。因此,本研究采用流式细胞术分析了基于质粒的感应元件荧光信号的稳定性与可重复性。如图9所示,虽然与不同浓度Cu2+孵育后报告菌株的单细胞荧光峰图在左边低荧光值区域具有明显拖尾现象,甚至无荧光细胞数明显增加(见图9B-C)。但是相对没有添加外源性Cu2+的阴性对照(见图9A),随着Cu2+浓度的增加,荧光值峰图明显右移,高荧光值区域的荧光峰图离散度明显变小(见图9B-C)。尤其是图9D表明即使是独立重复实验,报告菌株应答微摩尔浓度以上Cu2+产生的荧光信号,具有很好的可重复性(SD值<20%)。

图9 流式细胞术分析报告菌株荧光信号的稳定性与可重复性
2.9 CopAp::gfpmut2-pET28/ΔcopA-ΔcueO-ΔcusA报告菌株检测Cu2+的线性范围 以等体积终浓度分别为5.0×10-8、1.0×10-7、2.5×10-7、5.0×10-7、7.5×10-7、1.0×10-6、2.5×10-6、5.0×10-6、1.0×10-5mol/L的Cu2+诱导CopAp::gfpmut2-pET28/ΔcopA-ΔcueO-ΔcusA报告菌株表达绿色荧光蛋白,测量其荧光强度和吸光度,以Cu2+终浓度的对数值为横坐标,荧光强度/吸光度值为纵坐标进行曲线拟合(见图10),其回归方程为y=14460+1924.8log(x),相关系数R2=0.99477,表明在0.05~2.5μmol/L(0.0032~0.16mg/L)Cu2+浓度范围内,CopAp::gfpmut2-pET28/ΔcopA-ΔcueO-ΔcusA报告菌株产生的荧光信号与Cu2+浓度之间具有很好的线性关系。参考我国各类国标中针对铜的限制表明,CopAp::gfpmut2-pET28/ΔcopA-ΔcueO-ΔcusA报告菌株具备监测地表水和地下水环境中痕量Cu2+的应用潜力(见表4)。
2.10 加标回收实验 为了进一步评估报告菌株应用于环境水样的潜力,本研究在生活饮用水(采集于温州医科大学茶山校区)中加入已知浓度Cu2+,分别采用微生物报告菌株和原子吸收光谱法进行检测,实验结果表明微生物报告菌株对生活饮用水中0.0496mg/L和0.9634mg/LCu2+的回收率分别为87.90%和104.37%(见表5),而我国针对生活饮用水卫生标准(GB5749-2006)中铜的限值为1mg/L,针对污水综合排放标准(GB8978-1996)的一级标准限值为0.4mg/L(见表4)。因此,本研究所述微生物报告菌株的灵敏度完全具备应用于监测生活饮用水和污水中Cu2+污染的潜力。
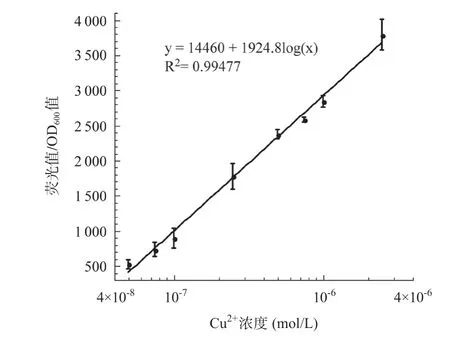
图10 CopAp::gfpmut2-pET28/ΔcopA-ΔcueO-ΔcusA报告菌株检测Cu2+的线性范围

表4 我国各类国标中针对铜的限制

表5 报告菌株CopAp::gfpmut2-pET28/ΔcopA-ΔcueO-ΔcusA检测生活饮用水样品中Cu2+的加标回收率
3 讨论
在负责维持E.coli 体内Cu2+稳态的cop操纵子中,由于cusA、copA和cueO3个结构基因对Cu2+的外排作用,导致E.coli 胞质内Cu2+浓度不会随外环境Cu2+的增加而升高,从而限制了以其为宿主菌的报告菌株的检测灵敏性,并且也会导致野生型报告菌株对Cu2+耐受,进一步降低其检测灵敏度。为了解决上述问题,本研究首先对野生型E.coli 宿主菌进行了基因工程改造:①删除了E.coli 中负责将Cu2+从细胞内向细胞外泵出的copA和cusA基因以及负责将Cu+氧化为Cu2+,防止外排到周质中Cu+再次进入胞质的cueO基因;②以荧光强度更强的增强型绿色荧光蛋白GFPmut2[16-17]作为报告标志基因构建融合报告载体。研究结果表明本研究构建的ΔcopAΔcueO-ΔcusA突变菌对Cu2+非常敏感,在M9基础培养基中其敏感性是野生型E.coliMC4100 的64 倍(见表3)。虽然相对ΔcopA 单基因缺失菌株,三突变菌株的敏感性并未显著增加,但是相对E.coliMC4100,ΔcueO-ΔcusA双突变菌对Cu2+的敏感性提高了4倍。说明在删除copA基因的基础上面,进一步删除cueO 和cusA基因是有助于提高报告菌株对Cu2+敏感性的。并且从8种微生物报告菌株对Cu2+的响应曲线可以看出(见图7),相对野生型报告菌株,宿主菌为ΔcueO、ΔcusA和ΔcueO-ΔcusA的报告菌株对Cu2+的敏感性略有提高;而含有copA基因缺失的报告菌株对Cu2+的敏感性显著增强,该研究结果与文献报道一致[15];尤其是E.coliΔcopA-ΔcueOΔcusA三基因突变菌响应Cu2+的荧光信号最强,线性范围最好,其累积的荧光信号强度为野生型的40倍左右(见图8)。综上所述,本研究构建的基于E.coliΔcopA-ΔcueO-ΔcusA 三基因突变菌的报告菌株,相对基于野生型E.coliMC4100或者ΔcopA单突变菌株,能够有效提升CopAp::gfpmut2检测元件对水溶液中钠摩尔数量级Cu2+的响应能力。
绿色荧光蛋白(greenfluorescentprotein,GFP)因具有检测方便、荧光稳定、无毒害、通用性、不需要外源性底物、辅助因子和ATP、易于实现融合表达以及在活细胞内定时定位观察等优点,已成为微生物报告菌株中最常用报告基因之一[18]。本研究所选报告基因为增强型GFPmut2,它是在野生型GFP中突变3个氨基酸位点(S65A、V68L、S72A)[17],它不仅具有更强的荧光信号,而且只需日光中的蓝光(481nm)就可以激发出亮绿色的荧光,这样不仅可以提高报告菌株的监测灵敏度,更重要的是不需要紫外设备就能通过肉眼观测菌体颜色变化判断目标检测物浓度高低,这为野外实时监测带来很大方便。本研究实验数据表明,经Cu2+诱导后,通过肉眼即可观察到报告菌株菌体呈亮绿色,且具有浓度依赖性(见图5A)。
目前,已有多种基于cop操纵子的Cu2+检测元件被文献报道,比如copAp::luxCDABE(检测Cu2+的线性范围为3~30μmol/L)[19],pSLcueR/copAp::luxCDABE(对Cu2+的最低检出限值(limitofdetection,LOD)为0.15μmol/L)[23],pSL-cueR/copAp::PpyWT(LOD:0.15μmol/LCu2+)[21]和pPROBEcueR/cueAp::gfp感应元件(检测Cu2+范围为1~70mg/L)[7],这些感应元件都被插入到质粒载体中,然后再转化到野生型E.coli 或者恶臭假单胞菌中,从而构建特异性检测水体中生物有效性Cu2+的全细胞微生物报告菌株。此外,KANG等[15]最新研究表明,在E.coliΔcopAΔcueR 双突变菌中共表达pCopAp-eGFP和pCDF-Duet-CueR质粒,可以显著提高报告菌株检测Cu2+的敏感性,其检测Cu2+范围为0~10μmol/L。本研究基于E.coliΔcopA-ΔcueOΔcusA三基因突变菌构建的报告菌株检测Cu2+的线性范围为0.05~2.5μmol/L(0.0032~0.16mg/L),相对上述文献报道的同类微生物报告菌株,其检测灵敏度具有明显的优势。
此外,由于环境样品成分复杂,可能会影响报告菌株的生长和GFPmut2蛋白的表达。比如,固体颗粒或样品颜色可能会增强/猝灭报告菌株GFPmut2蛋白荧光,有毒物质(比如有机磷杀虫剂或各类除草剂)的抑制效应或营养物质的促进效应[22]。因此,本课题组在后续实验中需要构建组成性表达GFPmut2的内参菌株[20,23],以校正上述因素对报告菌株荧光表达的影响。在每次实验中,将同时使用报告菌株和内参菌株对环境样品进行检测。内参菌株被用来确定校正系数[20]。
综上所述,本研究构建的突变菌有很好的线性范围,跟同类报告菌株相比具有更高的灵敏度。同时采用增强型GFP作为报告基因,能通过肉眼就能观测菌体颜色的变化,从而判断目标检测物浓度的高低,具有实时监测的优势。当然我们今后将继续对报告菌株CopAp::gfpmut2-pET28/ΔcopA-ΔcueOΔcusA进行改进与优化,并将其构建为能够检测水体中Cu2+的微生物传感器,制定标准化的检测流程,并应用于水体环境中Cu2+的检测与监测。为进一步研发能够实时、同步、快速检测多种重金属污染物(包括铬、铅、汞、铜等)的微生物芯片传感器提供技术上的借鉴和良好的应用范例。
