罗非鱼循环水养殖系统中一株肺炎克雷伯氏菌的分离鉴定及其脱氮性能研究
2020-06-09王秀华武和英于党辉
王秀华,武和英,杨 冰,张 琴,于党辉,黄 倢
(1.中国水产科学研究院黄海水产研究所,青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室,农业农村部海水养殖病害防治重点实验室,青岛市海水养殖流行病学与生物安保重点实验室,山东青岛 266071;2.广西壮族自治区海洋研究所,广西海洋生物技术重点实验室,广西北海 536000)
随着水产养殖用地的逐年减少和养殖用水资源的日益短缺,集约化高密度的养殖模式已成为水产养殖业发展的趋势。而在高密度水产养殖系统中,因残饵、粪便分解导致的高浓度氨氮及亚硝基氮等有害物质给养殖动物带来了潜在的危害,如影响养殖动物正常的生理代谢[1],破坏机体免疫力,加速病害发生[2]。因此研究降解养殖水体中氨氮、亚硝基氮的技术方法,将有助于促进当前水产养殖业的健康发展。
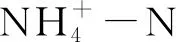
本研究从山东德州市一罗非鱼养殖场循环水养殖系统的脱氮池中分离到一株具有高效脱氮特性的细菌,研究了不同培养条件对其脱氮效果的影响,采用Biolog细菌鉴定系统及16S rDNA序列比对方法对该菌进行了初步的分类鉴定,同时对该菌进行了生物安全性评价,以期为该菌的开发利用提供技术支持。
1 材料与方法
1.1 实验材料
1.1.1 样品来源
菌株安全性评价用斑马鱼(daniorerio)300尾,购买于市场,平均体长(2.0±0.1)cm、平均体重(0.25±0.01)g。攻毒感染前,实验室暂养2周。
1.1.2 脱氮培养基
氨氮培养基与亚硝酸盐培养基配制方法参照文献[6],氨氮培养基(g/L):丁二酸钠 1.69;NH4Cl 0.08;MgSO4·7H2O 0.2;KH2PO40.05;Na2HPO40.5;NaCl 5.0;pH 6~7。亚硝酸盐培养基(g/L):丁二酸钠 1.69;NaNO20.1;MgSO4·7H2O 0.2;KH2PO40.05;Na2HPO40.5;NaCl 5.0;pH 6~7。配制氨氮培养基、亚硝酸盐培养基,分别先配制不含有NH4Cl、NaNO2的基础成分。基础成分配制完毕后,各培养基均经121 ℃高压灭菌20 min,之后将经0.22 μm微孔滤膜过滤除菌的一定浓度的NH4Cl、NaNO2母液,按相应的比例加入到灭菌后的培养基中。在液体培养基的基础上加入2%的琼脂则为固体培养基。
1.2 实验方法
1.2.1 菌株的采集和分离纯化
从山东省德州市一罗非鱼养殖场循环水养殖系统的脱氮池和山东省潍坊市一内陆对虾养殖场的半咸水对虾养殖池中分别采集水样,置入无菌采样瓶,低温条件下带回实验室,用LB平板划线分离纯化(LB培养基:蛋白胨 1%;酵母提取物 0.5%;NaCl 1%),对不同的菌株编号入菌种资源库保存备用。
1.2.2 脱氮菌株的筛选
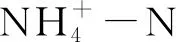
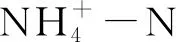
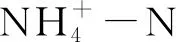
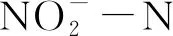
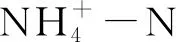
1.2.3 脱氮菌株碳源的筛选
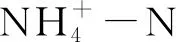
1.2.4 菌株在不同盐度中的脱氮效果
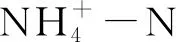
1.2.5 菌株在不同pH中的脱氮效果
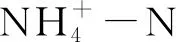
1.2.6 菌株在不同C ∶N比中的脱氮效果
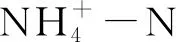
1.2.7 菌株在硝化和亚硝化培养基中的生长曲线及对应的脱氮效果
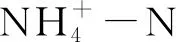
1.2.9 菌株安全性实验评价
用LB液体培养基将待测菌株28 ℃活化24 h后,4 ℃ 4 000g离心15 min,沉淀用PBS稀释成菌悬液,并用曝气48 h后的自来水将菌悬液分别稀释成2×104、2×105、2×106、2×107、2×108CFU/mL五个浓度梯度的菌液,用于浸泡感染实验,空白组加入10%的PBS。实验用水族箱每个有效水体5 L,每组放入斑马鱼40尾,每组设置两个平行。
感染用斑马鱼实验前停喂饵料24 h,置入菌液后24 h恢复正常投喂管理,每天进行吸污和换水,日换水量为30%。每天早晚2次观察并记录每组斑马鱼的死亡情况,直到一周之内不再死亡即停止观察,然后统计累计死亡率。
1.2.10 菌株鉴定
16S rDNA序列分析比对及系统发育分析法:细菌DNA提取采用细菌基因组 DNA 快速抽提试剂盒(生工生物工程(上海)股份有限公司),细菌16S rDNA序列扩增方法参照文献[8]。扩增产物委托上海生工生物工程技术有限公司进行分析,所得序列在NCBI数据库中利用BLAST进行同源性比对,选取同源性较高的序列,利用MEGA 5.0 进行多重比较后通过邻接法构建系统发育树,以确定分离菌株的分类地位。
Biolog细菌鉴定:采用Biolog微生物自动分析系统(MICROSTATION,Biolog,美国),细菌纯培养采用Biolog BUG 的固体培养基,28 ℃恒温培养12 h,再将菌落用液体培养基(IF-B)稀释(Biolog,美国),稀释的菌液加入到Gen III 微板中(每个孔100 μL),28 ℃恒温培养24 h,然后用MICROSTATION进行鉴定。
1.2.11 数据分析
试验数据用平均数±标准方差(x±s,n=3)的方法来表示,运用软件SPSS18.0,经One-Way ANOVA 分析,采用Duncan’s多重检验分析试验结果平均数的差异显著性,设差异水平α=0.05 (P<0.05为差异显著)。
2 结果与分析
2.1 脱氮菌株的筛选
从罗非鱼养殖系统和对虾养殖池中共分离出13株菌株,其中有6个菌株既能在硝化培养基中生长也能在亚硝酸盐培养基中生长,结果见表1。选取去氨氮效果最佳的菌株DZYC2016100902(简称DZYC02菌株)为本实验的目的菌株用于后续研究,该菌株在硝化培养基及亚硝酸盐培养基中菌落呈白色、圆形、边缘整齐,菌落1 mm左右,在LB培养基中为乳白色,圆形、边缘整齐,菌落2 mm左右,表面湿润有光泽。
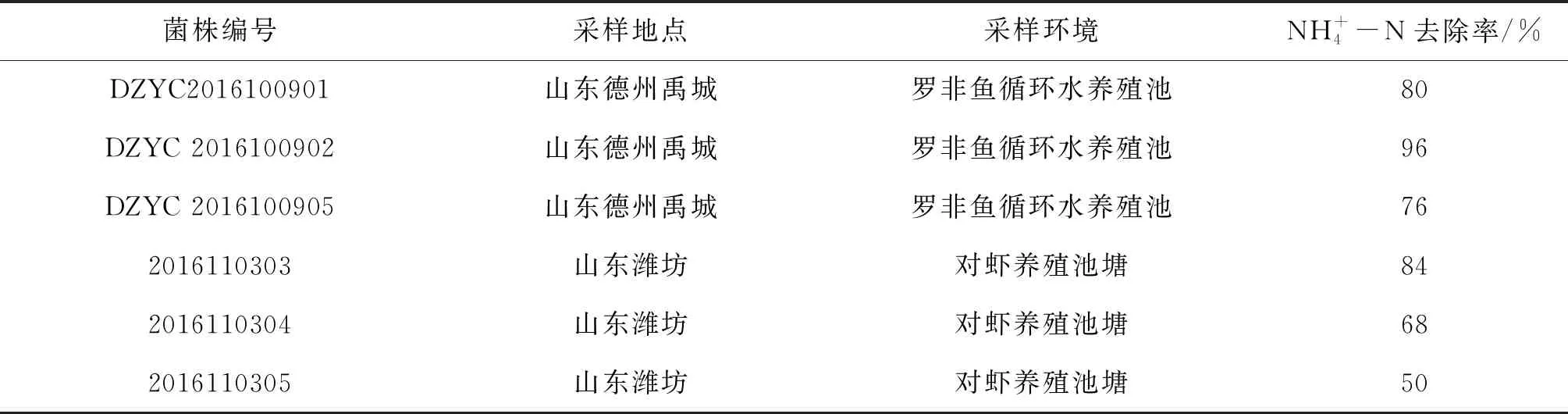
表1 不同菌株对氨氮的去除率Tab.1 Removal rates of ammonia nitrogen by different bacterial strains %
2.2 碳源对菌株DZYC02脱氮效果的影响
菌株DZYC02在不同碳源条件下对氨氮的去除率如图1所示。可知菌株在不同的碳源中48 h对氨氮的去除率由低到到高的碳源排列是丁二酸钠、葡萄糖、蔗糖、可溶性淀粉、乙酸钠、柠檬酸钠。以柠檬酸钠为碳源时,在24 h和48 h的氨氮去除率均达到100%,均显著高于其它组的氨氮去除率,其它组48 h氨氮去除率也明显高于24 h;当丁二酸钠为碳源时,24 h和48 h氨氮去除率均低于其他组,差异显著;当乙酸钠为碳源时,24 h氨氮去除率低于葡萄糖、蔗糖、可溶性淀粉组,差异显著,但以葡萄糖、蔗糖、可溶性淀粉作为唯一碳源时氨氮去除率差异不显著;而乙酸钠组48 h氨氮去除率高于葡萄糖、蔗糖组,差异显著,也高于可溶性淀粉组,差异不显著。说明碳源种类差异影响菌株DZYC02氨氮的去除率。
2.3 盐度、pH及C ∶N对菌株DZYC02脱氮效果的影响
不同盐度、pH及C ∶N环境中菌株DZYC02脱氨氮效果见图2。由实验结果可知,当盐度由0升
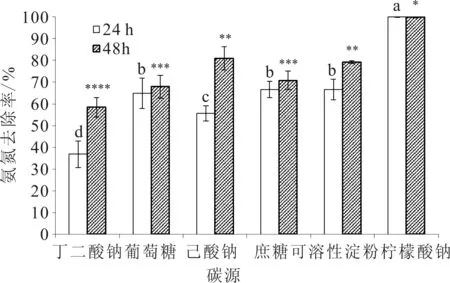
图1 不同碳源对菌株氨氮去除率的影响Fig.1 Effects of carbon sources on ammonia nitrogen removal rates of strain DZYC02 标有不同小写字者表示24 h时组间差异显著;标有相同小写字母者表示组间差异不显著;标有不同*者表示48 h时组间差异显著;标有相同*者表示组间差异不显著
高到15时,发酵液中氨氮的去除率一直保持100%;当盐度大于15时,该菌株的脱氮能力开始下降,脱氮率随着盐度的升高而降低,当盐度为30时,该菌株的脱氮率趋于0。
当pH值由4升高到5时,菌株氨氮去除率由(3.2±1.2)%升到的100%。当pH处于5~7时,氨氮去除率维持在(99.9±0.1)%,该pH范围内3个组间的脱氨氮效果差异不显著;当pH值由7升高到9时,菌株发酵液中氨氮的去除率显著下降,脱氮率由(99.8±0.1)%下降到(2.9±0.6)%。表明pH是影响该菌株脱氨氮效果的因子之一,该菌适宜于弱酸环境。
当C ∶N由5提高至15时,发酵液中氨氮的去除率随C ∶N的升高而显著增大;当C ∶N在15~30时,各组氨氮去除率均在100%,趋于稳定。
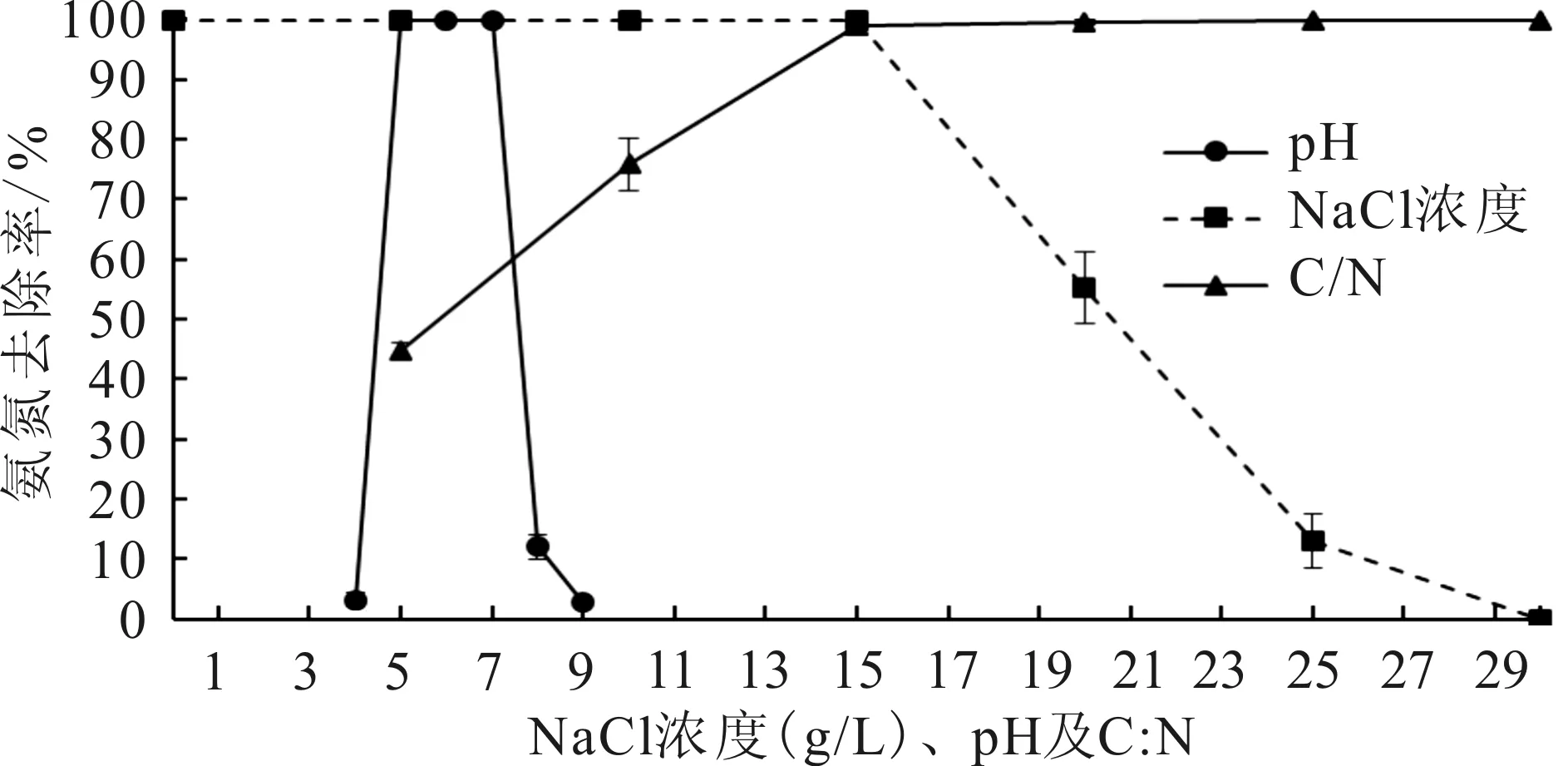
图2 盐度、pH及C ∶N对菌株DZYC02脱氮效果的影响Fig.2 Effects of salinity,pH and C ∶N on ammonia nitrogen removal rates of strain DZYC02
2.4 菌株在氨氮及亚硝酸盐培养基中的生长曲线
菌株DZYC02在氨氮及亚硝酸盐液体培养基中的生长曲线见图3。在硝化培养基中,菌株DZYC02在经3 h左右的迟缓期后,进入对数生长期,又经12 h后菌液OD600 nm值增长趋于平缓,随后进入稳定期。在细菌对数生长期,培养液中的氨氮浓度快速降低,表明细菌增殖过程中可利用培养基中的氨氮。
菌株DZYC02在亚硝氮液体培养基中,经12 h左右的迟缓期后,进入对数生长期;21 h左右又经一次迟缓增殖,到36 h菌株又开始进入对数生长期,到42 h发酵液OD600 nm值达到最大,随后进入下降趋势;39 h以后培养基中的亚硝氮浓度仍逐渐降低,至48 h亚硝基氮浓度接近为零,表明细菌增殖过程中可利用培养基中的亚硝基氮。
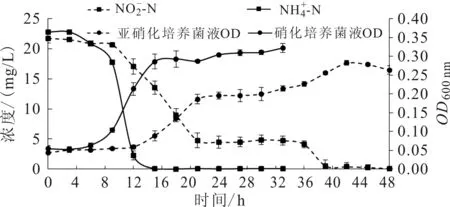
图3 菌株在氨氮及亚硝氮培养基中的生长曲线Fig.3 The growth curve of strain DZYC02 in ammonia nitrogen and nitrate nitrogen medium
2.6 菌株的生物安全性
结果显示,斑马鱼经菌株DZYC02浸泡感染两周时间内,高浓度实验组(2.0×108CFU/mL)和低浓度实验组(2.0×104CFU/mL)及对照组(PBS)的斑马鱼,均未出现死亡,并且在此期间斑马鱼正常摄食,游动活泼。而仅在2.0×105CFU/mL浓度组出现1尾死亡。根据实验结果综合判断,该菌株对斑马鱼不具有感染力。
2.7 菌株鉴定
PCR扩增菌株DZYC02的16S rDNA序列,PCR电泳图见图4,将该扩增产物进行序列分析,得1 377 bp的碱基序列(NCBI 登录号为SUB5864511),提交到NCBI网站进行BLAST序列比对),发现该菌与肺炎克雷伯氏菌Klebsiellapneumoniae的亲缘关系最近,同源性达到99%。选取与该菌源性相近的16株菌的16S rDNA序列构建系统发育树,结果见图5,可见该菌与K.pneumoniaesubsp.rhinoscleromatis ATCC 13884菌聚为一类,初步判定该菌为一株克雷伯氏菌K.pneumoniae。Biolog鉴定结果显示菌株DZYC02与K.pneumoniae的相似度达到 0.615,大于0.5,遗传距离3.977,小于5。综合两种鉴定结果,判定该菌株为一株肺炎克雷伯杆菌。
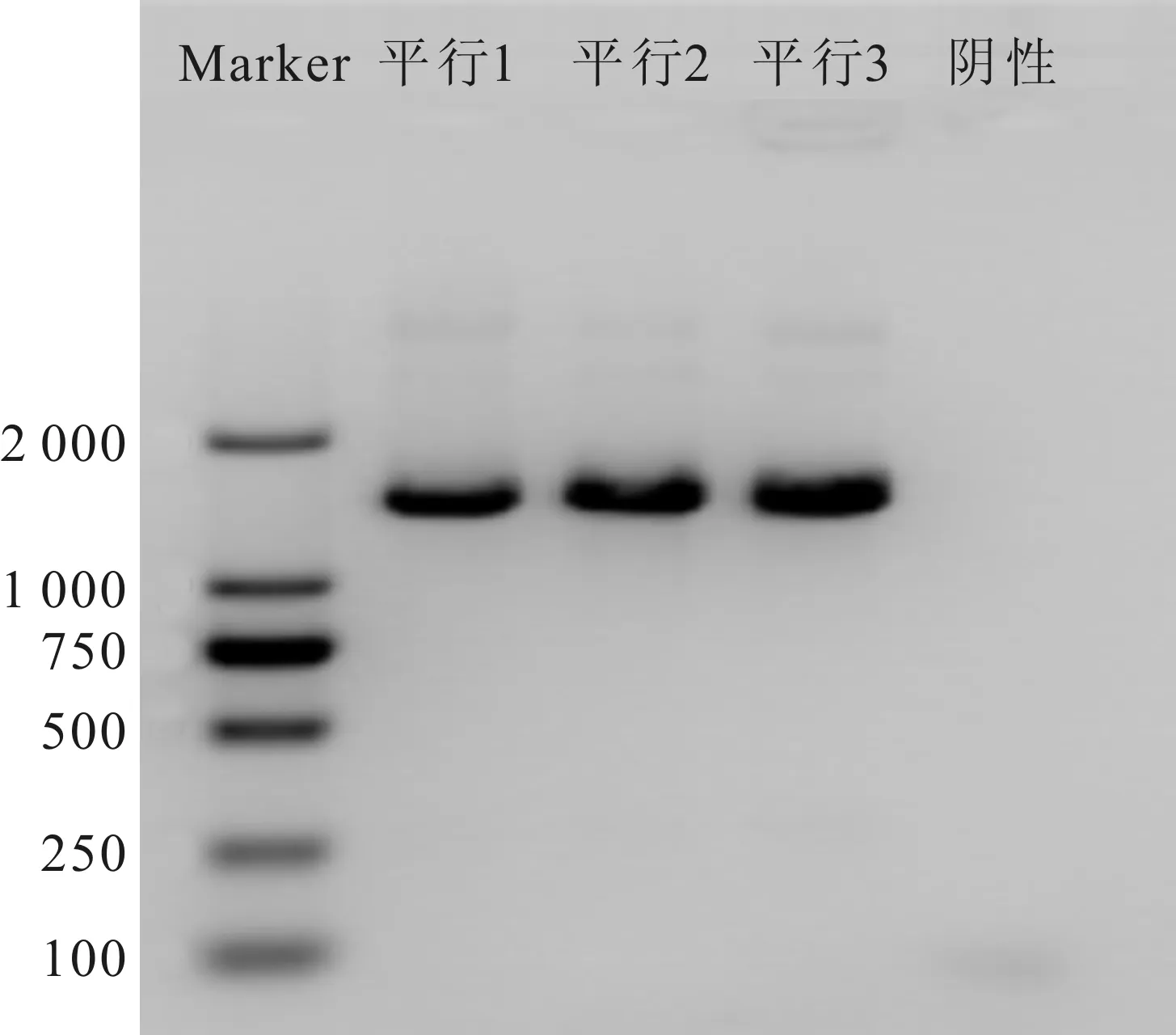
图4 菌株DZYC02的16S rDNA 电泳图Fig.4 PCR products of 16S rDNA gene of bacterial strains DZYC02
3 讨论
利用生物脱氮技术进行水质处理已较早用于污水处理行业,近年来生物脱氮技术也被用于水产养殖[9,10]。目前已经发现的脱氮菌种类多,根据其同化作用类型,分为自养硝化细菌、异养硝化细菌[11,12]、自养反硝化细菌、异养反硝化细菌[13,14 ]。而有些脱氮菌兼具有硝化与反硝化能力[12,15 ],如肺炎克雷伯氏菌为异养硝化好氧反硝化细菌[16],常见于污水处理系统中,其脱氮特性与携带的编码羟胺氧化酶、周质硝酸盐还原酶、亚硝酸盐还原酶的基因表达有关[17,18]。有研究表明,异养硝化菌在氨代谢过程中,由氨单氧酶催化氨形成羟胺后,经非血红素铁羟胺氧化酶的催化,直接形成N2O及N2[19],而不同于自养硝化细菌,在氨氧化过程中产生亚硝基氮。
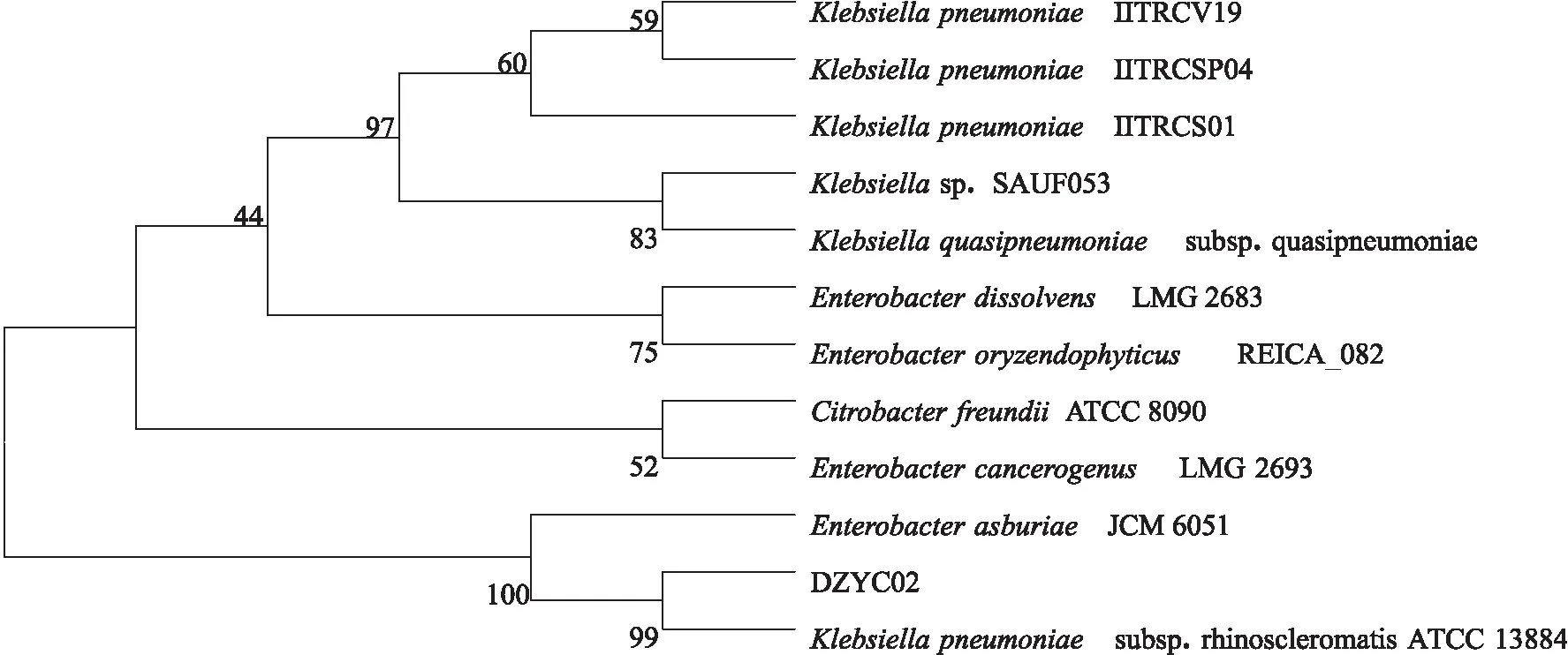
图5 根据16S rDNA基因序列构建的菌株DZYC02与相近的菌株系统发育树Fig.5 Phylogenetic tree base on 16S rDNA sequences generated of strain DZYC02 with other similar stains节点数表示bootstrap支持率,1 000次重复.
微生物脱氮过程与环境理化因子及营养物质密切相关,不同的脱氮菌对环境及营养的需求差异较大,适宜的盐度、温度、pH、溶解氧及C ∶N等能够提高脱氮效果[20-24]。有研究发现,从养殖场沉积淤泥中分离的产酸克雷伯菌(K.oxytoca)适宜最佳脱氮条件为pH 7~9,盐度0~5,当盐度大于15时不具脱氮效果[25],且采用不同的碳源,其脱氮效果存在差异。本研究中所分离的菌株DZYC02为一罗非鱼循环水养殖池中的菌株,在中性至偏弱酸(pH 5~7)低盐度(0~15)环境中对氨氮及亚硝基氮具有良好的去除作用,环境中添加适量的碳源可提高该菌的脱氮效果。可知同为一属的两株菌,因生存的环境不同,其脱氮条件存在一定的差异。
肺炎克雷伯氏菌属于肠杆菌科克雷伯氏菌属,为革兰氏阴性杆菌,该菌广泛分布在自然界,因含有多种毒力因子[26],对人畜均具有致病力[27,28]。肺炎克雷伯氏菌能够引起团头鲂(Megalobramaamhlycephala)出血性败血症[29],该菌也可从海水鱼中分离到[30]。 感染实验初步证实,本研究中所分离的肺炎克雷伯氏菌为一无毒株,浸泡感染斑马鱼不具有毒力,而在分离该菌的罗非鱼循环养殖池中,也未发现养殖罗非鱼出现发病的现象,但为了养殖动物的安全,在开发应用该菌前,还需要对该菌对鱼类的侵染力、毒力等相关因子开展进一步的研究。
