施氏鲟促卵泡激素受体基因cDNA的克隆、表达及调控
2020-06-09韩世成吕伟华王念民
高 雪,韩世成,马 波,吕伟华,王念民,张 颖
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨 150070; 2.上海海洋大学农业农村部淡水种质资源重点实验室,上海 201306)
与脊椎动物相似,促性腺激素释放激素(GnRH)、促性腺激素(GtHs)和性腺类固醇激素作为生殖相关的关键激素,主要通过下丘脑-垂体-性腺轴来参与鱼类的生殖调控[1]。在调控过程中,GnRH诱导垂体合成并释放促卵泡激素(FSH)和促黄体激素(LH)[2],FSH和LH分泌到血流中,并通过与细胞表面上的同源受体GtHRs结合而协同参与体内重要的生理过程,该特定的结合受体主要存在于硬骨鱼的性腺中,参与诱导类固醇的分泌和配子的发生[3,4]。促卵泡激素受体(follicle-stimulating hormone receptor,FSHR)属于视紫红质类A家族的G蛋白偶联受体(GPCR)超家族的一员[5],目前为止,已经在大马哈鱼(Oncorhynchusrhodurus)、鲶(Silurusasotus)、斑马鱼(Daniorerio)和日本鳗(Anjuillajaponica)等多种硬骨鱼中克隆得到FSHR基因[6-9],并进行了组织表达的研究,发现Gthr基因主要在性腺中表达,这种有限的组织分布强调了这两种糖蛋白激素在脊椎动物性腺生理调节中的重要性[10,11]。在成熟的鲑鱼中,发现FSHR定位于雌性鲑鱼的包膜细胞和颗粒细胞,以及雄性鲑鱼精子囊周围的细胞[12],直接参与了生殖细胞的生长和发育。此外,在日本鳗鲡[13]和非洲鲶鱼[14]的间质细胞中也检测到FSHR基因的表达,该细胞定位与两种促性腺激素在成熟鱼类中分泌的类固醇生成物一致。除了在激素生成调控中的作用,对生殖周期中FSHR基因性腺表达谱的分析表明,它们参与了鱼类配子生成的关键时期,在金钱鱼、欧洲鲈和黄颡鱼等鱼类中已得到证实[15]。
施氏鲟(Acipenserschrenckii)主要分布在黑龙江、乌苏里江和松花江等地,是我国北方重要的淡水鱼类,具有很高的经济价值,尤其是鱼卵价值更高,有“黑色珍珠”的美誉[16]。目前,我国已是世界上最大的鲟鱼养殖国与鱼子酱出口国,养殖产量占世界产量的85%以上。施氏鲟性成熟晚,不具有副性征,外表难以区分雌雄性别,繁殖生物学研究的空白很多[17]。目前,国内外对施氏鲟生长繁育方面的研究比较少,有关施氏鲟性腺发育尤其是早期配子形成的分子机制还未阐明,因此开展其分子机理的研究具有重要意义。本研究以施氏鲟为实验材料,采用RACE技术克隆得到施氏鲟FSHR基因,分析其序列特征和系统进化关系,研究其时空表达特征,为进一步阐明FSHR的生理功能和分子机制奠定基础,同时也为施氏鲟早期生殖调控提供基础数据。
1 材料和方法
1.1 实验材料及分组
实验选用中国水产科学研究院鲟鱼工程繁育中心同一批次90日龄的施氏鲟,共160尾,鱼体质量为38~55 g,体长201~266 mm。实验试剂为促黄体激素释放激素激动剂LHRH-A(GnRH的类似物),按不同注射剂量组(未注射、1 μg/kg 、3 μg/kg 、5 μg/kg)进行随机分组,每组40尾,注射后,各组分别于四个时间点(1 d、3 d、5 d和7 d)取性腺和垂体,每个时间点取9尾,每三尾混合作为一个样,共三个平行,用液氮迅速冷冻样品,-80 ℃冰箱保存备用。另取体重(4.8±2.23)kg的施氏鲟,取其心、肾、脾、肠、鳃、脑及卵巢等组织,置于-80 ℃冰箱保存备用。
1.2 总RNA的提取和cDNA的合成
采用总RNA提取试剂盒(Promega)提取总RNA,按照说明书进行操作。用琼脂糖凝胶电泳检测RNA完整性,超微量核酸蛋白测定仪(Thermo Scientific美国)测定RNA浓度,暂存于-80 ℃保存。以含量为1.5 μg的总RNA为模板,按照GoScriptTM Reverse Transcription Mix,Oligo DT (Promega)和SMARTTM Race cDNA试剂盒(Clontech)的说明书,分别反转录合成cDNA和Race cDNA第一链,稀释10倍后于-20 ℃保存备用。
1.3 FSHR全长cDNA序列的获得
采用同源克隆的方法,根据小体鲟FSHR基因的cDNA序列,GenBank登录号为(ANT47399.1),在保守区域内设计核心引物,引物由吉林库美生物技术公司合成(表1)。以施氏鲟成熟期性腺cDNA为模板,使用2×Es Taq MasterMix (CWBIO)进行PCR扩增,反应体系为20 μL,PCR反应程序为:94 ℃预变性3 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,35个循环,终延伸72 ℃ 5 min。1.2 %琼脂糖凝胶电泳检测PCR扩增产物,使用琼脂糖凝胶DNA回收试剂盒(CWBIO)对目的片段进行切胶回收,纯化片段连接到pMD18-T (TaKaRa)载体,转化至大肠杆菌(DH5α)感受态细胞,在含Amp的LB平板上37 ℃培养过夜,经菌落PCR鉴定,挑选阳性克隆送吉林省库美生物科技有限公司测序。根据已经获得的中间片段分别设计5′RACE和3′RACE的内外侧特异性引物(表1),以RACE cDNA第一链为模板,用引物UPM和FSHR外侧引物进行第一轮扩增,随后以第一轮PCR产物的稀释液为模板,用NUP和FSHR内侧引物进行第二轮扩增。反应程序按照SMARTer®RACE 5′/3′Kit (TaKaRa,clontech)试剂盒的说明书设定。胶回收、连接、转化及测序如上所述。
1.4 施氏鲟FSHR基因的序列分析
用SeqMan对FSHR基因的中间序列和3′ RACE、5′ RACE末端进行全长拼接;使用DNAMAN 8.0软件查找开放阅读框(ORF)并将其推导为氨基酸序列,应用NCBI中BLAST程序对序列进行比对;利用Clustal X和Mega 7.0邻接法(Neighbour-Joining,NJ)构建系统进化树;使用专业蛋白在线分析系统(Expert Protein Analysis System,Ex PASy)分析该蛋白基本物理化学参数、信号肽及修饰位点;利用NetNGlyc1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc)预测N端糖基化位点。利用在线工具TMHMMServer 2.0 (http://www.cbs.dtu.dk/services/TMHMM)对蛋白的跨膜区域进行预测。
1.5 荧光定量PCR
以反转录得到的cDNA为模板,根据已获得的cDNA全长序列设计荧光定量PCR特异性引物,以β-actin基因设计内参引物(表1),采用半定量RT-PCR和qRT-PCR法,检测FSHR 基因mRNA在雌性施氏鲟各组织中表达情况及GnRH激动剂对FSHR基因表达的影响。荧光定量PCR仪使用ABI 7500 (Applied Biosystems,USA),荧光试剂使用SYBRPremix Ex Taq (Takara,II 中国大连),按说明书进行实验。结果采用2-ΔΔCT方法计算相对表达量,数据用平均值±标准差(mean±SD)表示。为确保实验的准确性和可重复性,每个样品设3次重复。用SPSS进行单因素方差分析和Duncan多重比较,显著性水平设为P<0.05。
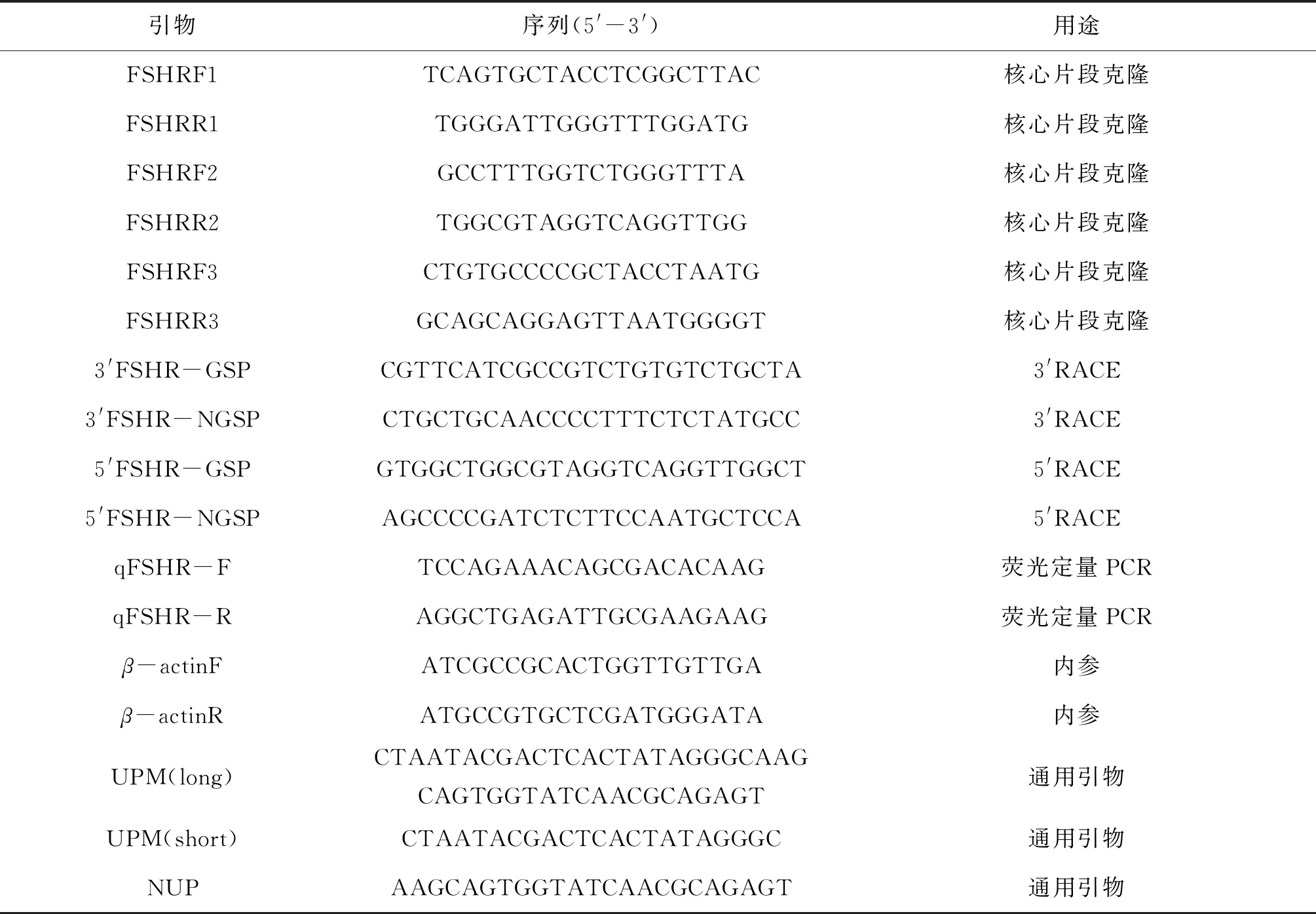
表1 实验所用引物及序列Tab.1 Names and sequences of primers used in this study
2 结果与分析
2.1 施氏鲟FSHR基因全序列克隆和分析
使用三对核心序列引物和3′端与5′端非翻译区特异性RACE引物扩增得到施氏鲟FSHR基因cDNA序列全长2 696 bp,包括5′端非编码区(5′ UTR,102 bp),开放阅读框(ORF)1 986 bp以及3′端非编码区(3′ UTR,608 bp),共编码661个氨基酸。预测施氏鲟FSHR蛋白质的分子量为75.02 kD,理论PI值为8.35,亮氨酸Leu的含量最高,为12.9%。疏水性分析结果显示, FSHR疏水性平均值为正值0.289,属于疏水性蛋白质。此蛋白具有典型的G蛋白偶联受体家族的结构FSVyT LTVITLERWHtI,位于428~444aa。该氨基酸序列包含339aa的胞外区域(ECD)和58aa的胞内区,其中前17aa为信号肽;长度为264aa的7次跨膜螺旋区(7 TM helices),由3个胞内环(in I~in III)和3个胞外环(out I~out III)连接。推测该氨基酸含有5个潜在的N端糖基化位点,分别为48NTTH、138NLSK、194NNTK、270NLTY、294NMSQ (图1)。此外,预测整个编码区有31个丝氨酸(Ser)磷酸化位点、21个苏氨酸(Thr)磷酸化位点和9个酪氨酸(Tyr)磷酸化位点。
2.2 施氏鲟FSHR氨基酸同源性分析
利用DNAMAN8软件对施氏鲟的氨基酸序列进行比对,施氏鲟FSHR氨基酸序列与小体鲟(Acipenserruthenus)FSHR的同源性最高为99%,与斑马鱼同源性为65%,与人类等哺乳动物同源性为59%(表2),在进化中比较保守。不同物种氨基酸序列对比发现了多个半胱氨酸保守性区域和GpHR家族保守信号序列,为CCAF、ERW、FTD、NPFLY(图2)。利用MEGA7.0构建系统进化树,FSHR进化分析发现,进化树可分为两大支,其它各种鱼类聚为一支,施氏鲟、哺乳类和鸟类聚为一支且与小体鲟亲缘关系最近(图3)。

图1 施氏鲟FSHR基因cDNA全长序列Fig.1 Full sequence of FSHR gene cDNA of A.schrenckii起始密码子ATG;跨膜螺旋区(TM Ⅰ-TM Ⅶ):黑底白字;胞内环(in Ⅰ-in Ⅲ)→;胞外还 (out Ⅰ-out Ⅲ)←;潜在的N-糖基化位点▭;终止密码子:TGA
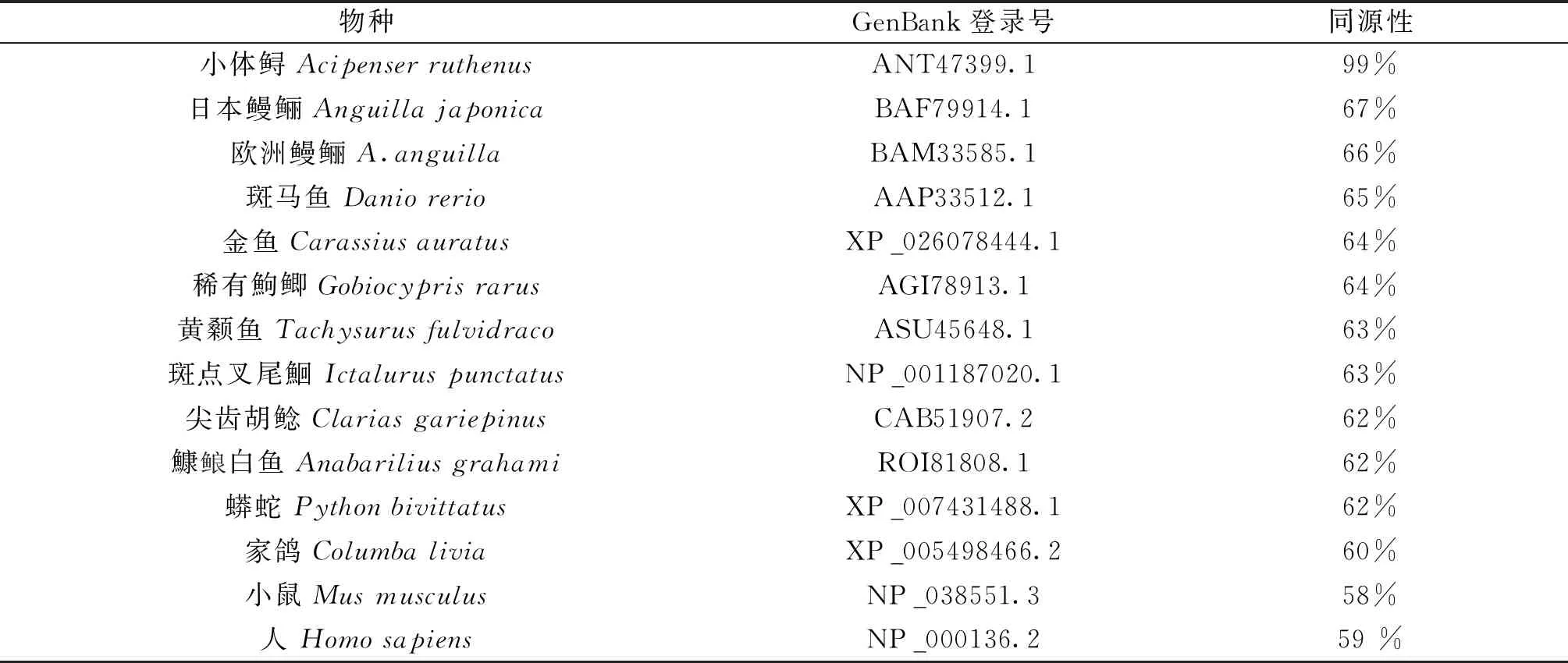
表2 FSHR氨基酸序列的同源性比对Tab.2 Comparative identity of amino acid sequence of FSHR

图2 施氏鲟FSHR氨基酸序列与其他物种FSHR氨基酸比对Fig.2 Alignment of A.schrenckii FSHR with FSHRs from several other species相同的氨基酸、高度保守的氨基酸,分别以“黑色”和“灰色”表示;黑色边框:GpRH家族的特殊保守信号序列;黑色下划线:富含半胱氨酸残基的高度保守区。
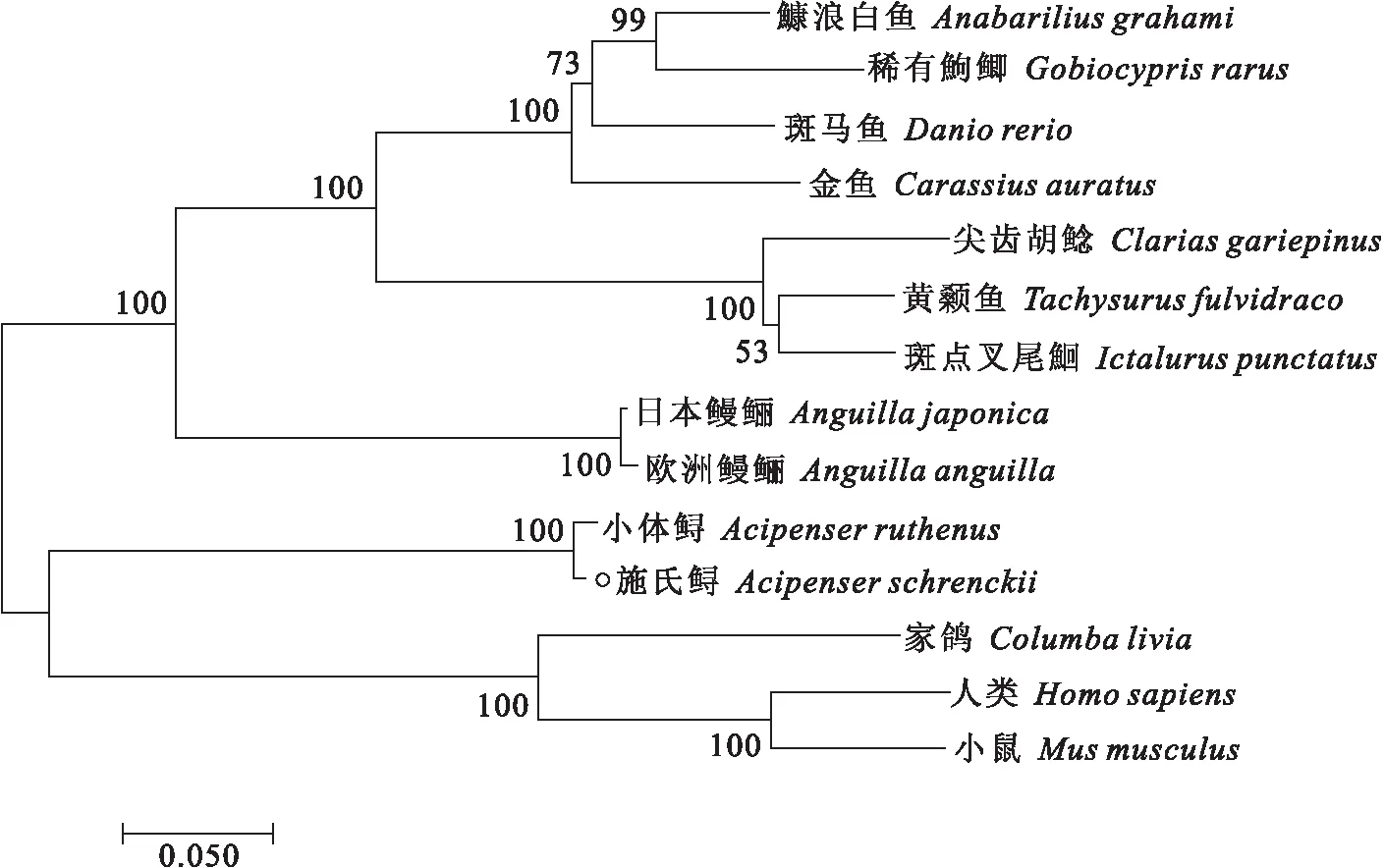
图3 施氏鲟FSHR与其他脊椎动物FSHR构建的系统进化树Fig.3 Phylogenetic tree of A.schrenckii FSHR and other species FSHR
2.3 施氏鲟FSHR基因组织分布表达
采用半定量 RT-PCR 和荧光定量RT-qPCR检测 FSHR 基因在Ⅱ期雌性施氏鲟不同组织中的表达。从图4中看出β-actin 基因片段在施氏鲟各组织中的扩增良好,能够排除RNA 提取失败导致的假阴性结果。结果显示,施氏鲟的促卵泡受体基因在心脏、肝、脾、脑、性腺等12种组织中均有表达,在垂体中表达量最高,其次为性腺,而在肌肉、皮肤、肾和鳃中几乎不表达 (图5)。
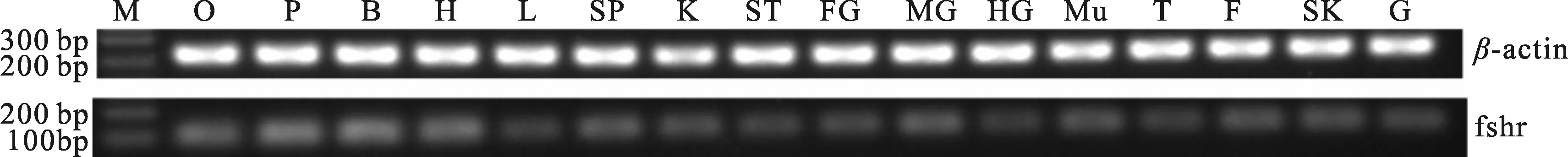
图4 FSHR基因在雌性施氏鲟各组织中的表达Fig.4 The expression of FSHR gene in female A.schrenckiiM:DNA分子量标准;O卵巢;P垂体;B脑;H心脏;L肝脏;SP脾;K肾;ST胃;FG前肠;MG中肠;HG后肠;Mu肌肉;T输卵管;F脂肪;SK皮肤;G鳃。
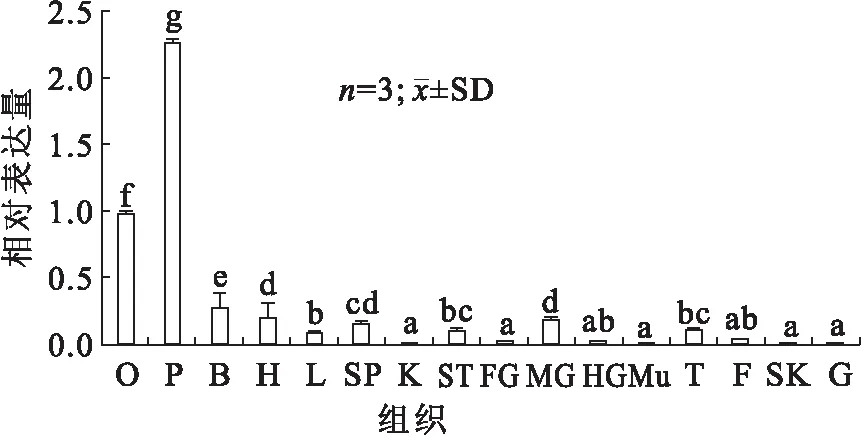
图5 FSHR 基因在雌性施氏鲟各组织中的表达Fig.5 The expression of FSHR gene in female A.schrenckiiO卵巢;P垂体;B脑;H心脏;L肝脏;SP脾;K肾;ST胃;FG前肠;MG中肠;HG后肠;Mu肌肉;T输卵管;F脂肪;SK皮肤;G鳃。
2.4 LHRH-A对施氏鲟FSHR基因表达的影响
与对照组相比,注射不同浓度LHRH-A 的施氏鲟垂体中 FSHR 基因mRNA的表达量在不同时间点均有上升,其中,3μg/kg组在注射第3天 FSHR 的表达量达到最高峰,差异性显著,表明GnRHα处理后FSHR大量表达(图6);性腺中FSHR的表达量整体呈现先升高后降低的变化趋势,但是各浓度组中FSHR达到最高表达量的时间不同(图7),其中,1 μg/kg组在第3天达到峰值,5 μg/kg组在第5天达到峰值,均高于对照组,且差异性显著。
3 讨论
FSHR是视紫红质样受体家族的G蛋白偶联受体(GPCR)(家族A),与TSHR一起构成了糖蛋白激素受体(GpHR)的亚家族[5]。本实验克隆得到施氏鲟促卵泡激素受体基因的全长cDNA序列,全长为2 696 bp,编码661个氨基酸,蛋白质相对分子量约为75.02 kD,理论PI值为8.35。在NCBI数据库中,经blast对比,其与小体鲟的促性腺激素受体基因氨基酸的相似性高达99%,可以确定其为施氏鲟的促性腺激素受体基因。施氏鲟与其它鱼类的促性腺激素受体相似,其一般拓扑结构包括一个大的细胞外结构域、七个跨膜螺旋区和一个羧基末端的尾部[18],但与哺乳动物FSHR氨基酸序列相比,鱼类FSHR的细胞外结构域存在显着差异,一个关键特征是它们的细胞外结构域构成蛋白质长度的一半以上,有助于激素的识别和特异性结合[19]。已有报道证明,该受体的跨膜结构域是最保守的部分,它们穿过脂质双层并由三个细胞内和三个细胞外环链接,具有受体激活和信号转导的作用[20]。此外,在施氏鲟FSHR氨基酸序列的ECD区,发现了5个N-糖基化位点,该位点最早在大马哈鱼(Oncorhynchusrhodurus)中发现[21],暗示其在脊椎动物糖蛋白激素受体中的保守性。系统发育分析显示,鱼类和哺乳类位于2个明显不同的分支,然而在进化树中我们发现,施氏鲟、小体鲟与哺乳动物和鸟类聚为一支,推测与该物种的特殊性有关。
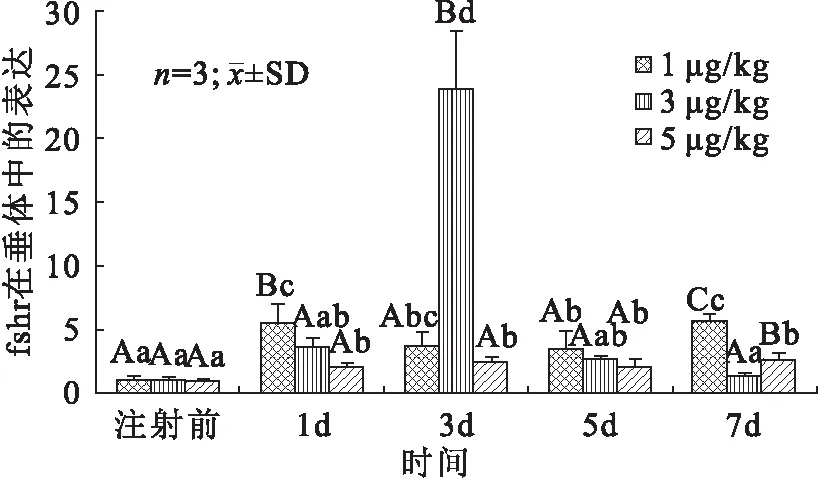
图6 注射不同浓度GnRH激动剂的施氏鲟在不同时间点垂体中FSHR基因表达量的变化Fig.6 The changes on FSHR expression in pituitary of A.schrenckii injected with different concentrations of GnRHα at different time points小写字母代表同一实验组不同时间点有显著性(P<0.05),大写字母代表在同一时间点不同实验组有显著性差异(P<0.05)。图7同。
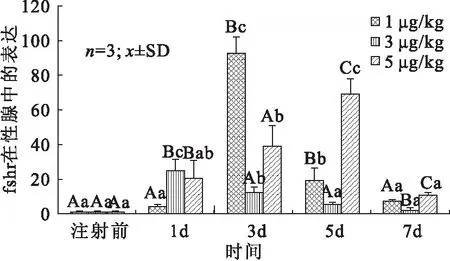
图7 注射不同浓度GnRH激动剂的施氏鲟在不同时间点性腺中FSHR基因表达量的变化Fig.7 The changes on FSHR expression in gonad of A.schrenckii injected with different concentrations of GnRHα at different time points
施氏鲟FSHR在各组织中的荧光定量PCR结果表明,施氏鲟的促卵泡受体基因在大部分组织中均有表达,但表达量存在差异,说明促卵泡受体在施氏鲟中具有广泛的生理作用。FSHR在施氏鲟垂体和卵巢中的表达量较高,该结果与黄颡鱼(Pelteobagrusfulvidraco)和非洲鲶鱼(Oncorhynchusrhodurus)相似。而在垂体中的高表达可能与FSH在下丘脑的分泌有关。除此之外,FSHR在施氏鲟心脏、肝脏、脾、脑和输卵管等组织中也存在不同程度的表达,这在欧洲鲈鱼[9]和斑马鱼[22]的非性腺组织中均有相似的发现。以上研究推断,施氏鲟的促卵泡受体基因在雌性的生殖功能中有着重要作用,同时可能具有更广泛的性腺外生理功能。研究资料显示,GnRH在离体或在体情况下都可以刺激鱼类脑垂体释放GtH并促进鱼类的性腺发育[23]。LHRH-A是哺乳类GnRH的高活性类似物,能刺激鱼类性垂体释放GtH。本研究结果表明,腹腔注射LHRH-A可不同程度地升高施氏鲟早期性腺和垂体中促卵泡激素受体基因mRNA表达,进而促进其性腺发育。注射剂量为3 μg/kg的LHRH-A 2 d施氏鲟垂体FSHR mRNA表达无显著变化(P>0.05),3 d的表达量才显著提高(P<0.05),之后下降(P<0.05),而注射1 μg/kg和5 μg/kg LHRH-A垂体mRNA表达水平与对照组差异较小,这表明LHRH-A在注射3 d后可显著促进施氏鲟垂体FSHR mRNA表达水平。与垂体的表达模式不同,不同剂量LHRH-A的作用下,性腺中FSHR mRNA的表达均为先升高后降低的变化趋势,其中,1 μg/kg和5 μg/kg分别在第三天和第五天达到极值(P<0.05),暗示LHRH-A可能以剂量依赖的方式提高施氏鲟垂体和性腺的FSHR mRNA水平和促进FSHR的分泌,但这种促进作用在注射1周后明显下降,可能由于LHRH-A属于小肽,在鱼体内被降解无法长期保留。Kumakura等[24]研究证实,在红海鲷(Pagrusmajor)中,单独施用GnRH激动剂可以刺激红雕性腺早熟。在未成熟的欧洲鳗鱼中,GnRHa和DA拮抗剂联合治疗以诱导LH的释放和卵巢发育[25]。综上所述,LHRH-A可通过调控FSHR的表达参与施氏鲟的早期性腺发育,为进一步阐明FSHR的生理功能和分子机制奠定基础,同时也为施氏鲟早期生殖调控提供基础数据。
