七叶皂苷对洛伐他汀在高脂血症大鼠模型体内药代动力学的影响
2020-06-08吴秀君苑冬敏陈克研
吴秀君,苑冬敏,陈克研,马 然,韩 波,于 艳
0 引言
他汀类药物是一类强效的3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,能够显著降低总胆固醇(TC)和低密度脂蛋白(LDL)水平,是目前已知最有效的降脂药物之一[1-2]。2016年国家心血管病中心发布的《中国成人血脂异常防治指南》明确了他汀类药物作为血脂异常药物治疗的基石地位[3-4]。此外,他汀类药物具有抗肿瘤作用,能够抑制肿瘤生长并诱导肿瘤细胞凋亡[5-6]。尽管总体耐受性较好,但由于横纹肌溶解以及肝肾功能损害等严重不良事件时有发生[7-8],他汀类药物的不良反应仍应引起足够重视。研究显示,他汀类药物的不良反应发生率与药物体内暴露水平有关,随着暴露水平的增加可呈几何倍数增加[9-10]。他汀类药物主要经由药物代谢酶CYP450代谢,CYP450的抑制或诱导可能改变他汀类药物的代谢行为,导致药物体内暴露水平增加或降低,从而造成不良反应增加或药效降低[11-13]。
七叶皂苷是从七叶树科植物天师栗的干燥种子中提取得到的一组三萜皂苷盐,具有抗炎、抗渗出、消肿、增加静脉张力及改善微循环等药理作用,临床上主要用于慢性静脉功能不全、脑水肿、创伤和手术后引起的肿胀的治疗[14-15]。近年来,大量研究证实,七叶皂苷具有明显的抗肿瘤作用,使得这一中药有了更广泛的应用前景。除外用与口服剂型外,七叶皂苷主要通过静脉滴注和静脉注射给药,在临床上常与其他药物配伍使用[16-17]。Huang等[18]研究显示,七叶皂苷对大鼠肝CYP450有调控作用,能够诱导CYP1A2的活性,但抑制CYP2C9和CYP3A4的活性。此外,七叶皂苷血浆蛋白结合率高,笔者前期研究显示,七叶皂苷的血浆蛋白结合率高达95%[19],这些特征均提示,七叶皂苷具有与其他合并用药发生相互作用的潜力。
本研究以洛伐他汀为模型药物,观察高脂血症大鼠中七叶皂苷对洛伐他汀药代动力学行为的影响,旨在为他汀类药物的临床合理应用提供理论依据。
1 仪器和试药
1.1 仪器 API 4000型液相色谱质谱联用仪,美国Applied Biosystem公司;TurboVap LV全自动浓缩仪,美国Zymark公司;Milli-Q Gradient A10超纯水器,美国Millipore公司;LX全自动血液生化分析仪,美国Beckman公司;XS-225A电子分析天平,德国PRECISA公司。
1.2 药品与试剂 洛伐他汀、洛伐他汀酸、辛伐他汀(内标,IS1)、辛伐他汀酸(内标,IS2)标准品购于中国药品生物制品检定所,洛伐他汀胶囊(哈药集团制药总厂),注射用七叶皂苷钠(武汉爱民制药有限公司),色谱纯甲醇(美国Fisher公司),其他试剂均为分析纯。大鼠高脂饲料购于江苏协同生物。
1.3 试验动物 清洁级健康雄性Sprague-Dawley(SD)大鼠,体重(180±10.0) g,由辽宁长生生物技术有限公司提供,实验动物许可证号:SCXK(辽)2015-0001。
2 方法与结果
2.1 方法
2.1.1 动物模型的建立 大鼠在标准环境[温度(23±2) ℃,湿度(50%±10%)]中适应1周后,随机分组,6只给予普通饲料,另外12只给予高脂饲料,5周后经眼眶静脉采血测定三酰甘油(TG)、TC、LDC和高密度脂蛋白(HDL)。
2.1.2 分组与给药 将造模成功的高脂血症大鼠随机分为2组,即单独给药组和联合给药组,每组6只大鼠。单独给药组大鼠尾静脉注射给予0.9%生理盐水,联合给药组大鼠尾静脉注射给予注射用七叶皂苷钠(0.5 mg/kg,以0.9%生理盐水溶解),1次/d,连续14 d。最后一次给药后,两组大鼠分别单剂量灌胃给予洛伐他汀(20 mg/kg,0.5%CMC-Na混悬液),分别于洛伐他汀给药前和给药后0.5、1.0、1.5、2、3、4、5、6、8、10、12、24、36 h于眼眶静脉采血约0.3 ml,在2~8 ℃下5 000 r/min离心15 min,分离血浆,-70 ℃保存待测。
2.1.3 血清生化指标测定 血清生化指标采用全血自动生化分析仪测得。
2.1.4 血浆样品中洛伐他汀和洛伐他汀酸浓度测定 色谱条件:色谱柱为Agilent Zorbax Elipse XDB C18色谱柱(4.6 mm×150 mm,5 μm);流动相为甲醇(A)-水(含10 mmol/L乙酸铵)(B),梯度洗脱:0.0~1.3 min 80%~97%A,1.3~1.8 min 97% A,1.8~2.5 min 97%~80% A,2.5~3.7 min 80% A;流速为1.0 ml/min,1∶1分流;柱温:30 ℃;进样量:10 μl。
质谱条件:电喷雾离子源(ESI源),多反应监测(MRM)模式;采用正负离子切换,洛伐他汀采用正离子检测,电压3 500 V,温度 500 ℃。源内气体1 (GS1,N2)压力:45 psi;源内气体2 (GS2,N2)压力:35 psi。洛伐他汀酸采用负离子检测,电压-3 500 V,温度500 ℃,GS1(N2)压力:45 psi,GS2(N2)压力:35 psi;洛伐他汀、洛伐他汀酸、辛伐他汀和辛伐他汀酸的解簇电压(DP)分别为35、-55、50、-60 V,碰撞能量(CE)分别为35、-25、15、-25 eV,离子反应分别为m/z427.1、m/z325.3(洛伐他汀,正离子),m/z421.4、m/z319.2(洛伐他汀酸,负离子)和m/z441.3、m/z325.1(IS1,正离子),辛伐他汀酸(IS2,负离子)m/z435.4、m/z319.2。前2.6 min为负离子检测,后1.1 min为正离子检测。
生物样品预处理:精密吸取100 μl大鼠血浆,精密加入10 μl内标溶液(50 ng/ml),涡旋混匀后加入环己烷-二氯甲烷(3∶1) 3 ml,涡旋混匀30 s,振荡10 min后,5 000 r/min离心5 min,吸取上清液,置另一干净玻璃试管中,50 ℃水浴N2吹干,残渣用100 μl甲醇复溶后,12 000 r/min离心2 min,取上清10 μl进样分析。

2.2 结果
2.2.1 血清生化指标 与食用普通饲料的大鼠相比,采用高脂饲料喂养5周后,SD大鼠血清TC、TG和LDL含量均显著升高(P<0.01),而HDL水平降低(P<0.05),表明高脂血症模型大鼠造模成功。见表1。

表1 两组大鼠血清生化测定结果(mmol/L)
注:与正常组比较,*P<0.05,**P<0.01
2.2.2 方法学验证 笔者对所建立的HPLC-MS/MS方法进行了方法学验证,洛伐他汀和洛伐他汀酸在0.1~50 ng/ml浓度范围内线性关系良好(R2>0.998 8),最低定量限均为0.1 ng/ml。在低、中、高3个质控浓度水平(0.2、5、40 ng/ml)洛伐他汀和洛伐他汀酸的平均回收率(n=4)分别为80.2%~86.7%、78.5%~88.4%。洛伐他汀的日内和日间精密度(RSD,n=6)分别为2.3%~8.2%、1.4%~6.5%,洛伐他汀酸的日内和日间精密度(n=6)分别为1.1%~5.6%、2.5%~5.6%。洛伐他汀和洛伐他汀酸的准确度(RE,n=6)分别为0.2%~6.2%、1.1%~6.1%。大鼠血浆中,洛伐他汀和洛伐他汀酸的基质效应分别为98.7%~112.1%、86.8%~95.7%。该方法灵敏度高、精密度好,可用于大鼠血浆中洛伐他汀及其活性代谢物洛伐他汀酸的含量测定。
2.2.3 药代动力学比较 大鼠口服洛伐他汀后,洛伐他汀和洛伐他汀酸的血药浓度-时间曲线见图1,主要药代动力学参数见表2。结果显示,在高脂血症大鼠模型中,连续14 d给予七叶皂苷导致洛伐他汀代谢产物洛伐他汀酸的血浆暴露水平显著升高,Cmax、AUC0-t、AUC0-∞分别是单独给药组的2.43(90%CI:1.55,3.31)、2.66(90%CI:1.67,3.66)和2.99(90%CI:1.44,4.55)倍,两组比较差异有统计学意义(P<0.05)。联合给药后,洛伐他汀酸的血浆清除率(Clz)下降(P<0.01),但两组消除半衰期比较差异无统计学意义。联合给药后洛伐他汀的体内暴露水平也有所增加,但与单独给药组相比,Cmax、AUC0-t、AUC0-∞差异均无统计学意义(P>0.05),表明七叶皂苷对洛伐他汀的体内代谢没有明显影响。
3 讨论
近年来,随着生活水平的提高,人群饮食结构和生活方式的重大变化以及人口老龄化的加剧,高脂血症的发生率呈逐年上升趋势。2012年的调查结果显示,中国成人血脂异常总体患病率高达40.40%,更为严峻的是青少年儿童高脂血症患病率也有明显增加[2]。高脂血症已然成为危害身心健康的重要危险因素,对高脂血症的防治已成为医学界的一项重要课题,因此,寻求积极、有效的降脂治疗方法具有重要的现实意义。目前,由于中医药的兴起,中西医结合治疗正在成为降脂治疗的新策略而被越来越多的用于临床。然而,中西药结合应用也增加了不良反应的风险,这已在大量的文献中得到证实。

图1 高脂血症大鼠灌胃给予洛伐他汀后洛伐他汀及洛伐他汀酸的血药浓度-时间曲线
表2 单独给药或与七叶皂苷联合给药后两组大鼠洛伐他汀及其代谢物洛伐他汀酸的药代动力学参数(n=6)
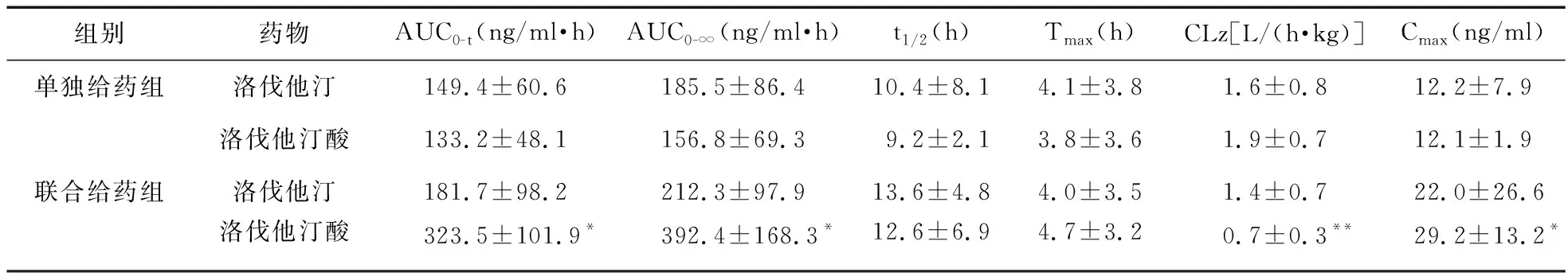
组别药物AUC0-t(ng/ml·h)AUC0-∞(ng/ml·h)t1/2(h)Tmax(h)CLz[L/(h·kg)]Cmax(ng/ml)单独给药组洛伐他汀149.4±60.6185.5±86.410.4±8.14.1±3.81.6±0.812.2±7.9洛伐他汀酸133.2±48.1156.8±69.39.2±2.13.8±3.61.9±0.712.1±1.9联合给药组洛伐他汀181.7±98.2212.3±97.913.6±4.84.0±3.51.4±0.722.0±26.6洛伐他汀酸323.5±101.9*392.4±168.3*12.6±6.94.7±3.20.7±0.3**29.2±13.2*
注:与正常组比较,*P<0.05,**P<0.01
洛伐他汀是第1代他汀类药物,目前仍是临床首选的调脂药。其是一种内酯形式的无活性前体药物,在体内62%转化为开放酸活性代谢物,即洛伐他汀酸,38%转化为闭环内酯代谢物。洛伐他汀酸是洛伐他汀的主要活性成分,其在体内主要经由CYP3A4/5代谢成无活性代谢产物而排出体外[13]。虽然洛伐他汀通常耐受性良好,但其具有肌病和横纹肌溶解症的严重不良反应,且发生频率不定。研究表明,在药物的全身暴露较高时,发生这些严重不良反应的风险显著增加。因此,在洛伐他汀的临床应用中,应考虑可能影响药物暴露的因素,包括年龄、性别、身高、体重、种族、疾病状态以及合并用药等,其中,与合并药物的相互作用(DDI)是必须考虑的重要因素之一。有报道,在他汀类药物不良反应中,一半以上与DDI有关。由于洛伐他汀酸在体内主要经CYP3A4/5酶代谢,因此,CYP3A4/5酶抑制剂或诱导剂具有与洛伐他汀发生DDI的潜力。近年来,中药对CYP450酶的抑制诱导作用的报道越来越多,由此导致的DDI也屡见不鲜。七叶皂苷作为一种中药提取物,其对CYP3A4和CYP2C9酶的抑制作用已经得到证实[20]。七叶皂苷在临床上常用于治疗脑卒中所致的脑水肿,而他汀类药物是脑卒中强化降脂治疗的主要药物,二者在联合用药时很有可能发生DDI。然而,迄今为止尚无七叶皂苷制剂与他汀类药物相互作用的报道。本研究以洛伐他汀为模型进行研究,结果显示,七叶皂苷降低了洛伐他汀在高脂血症大鼠体内的代谢,导致其主要代谢产物洛伐他汀酸的暴露水平显著增加,而对前体药物洛伐他汀本身的体内暴露水平没有显著影响,推测七叶皂苷降低洛伐他汀酸代谢水平的机制可能与其对大鼠CYP3A4酶活性的抑制有关。
综上所述,本研究初步证实,七叶皂苷可抑制洛伐他汀在高脂血症大鼠体内的代谢,导致其暴露水平明显增加,这种作用可能与七叶皂苷对药物代谢酶CYP3A4的抑制有关。本研究结果提示,他汀类药物在与七叶皂苷联合应用时,应根据临床情况合理调整剂量,减少或避免由于相互作用所造成的不良反应。
