乳鼠心肌细胞片状生长的分离、培养及纯化
2020-06-05张宇杨帆
张宇 杨帆
随着社会进步与人们生活水平提高,心血管疾病的发病率日趋增高并逐步年轻化[1],心血管疾病研究一直是科研工作者不断探索及关注的领域。在分子医学及细胞生物学快速发展的今天,乳鼠心肌细胞是目前心血管疾病研究与治疗的主要对象,乳鼠心肌细胞原代培养则是进行心血管疾病研究的最基础手段[2]。动物体内环境复杂,不利于进行细胞信号转导通路、基因表达及细胞生理病理学特性等研究,故需要稳定、有效的体外细胞培养模 型[3]。心肌细胞具有培养简易方便,且实验重复性好等优点,被认为是进行心脏基因测序及细胞学研究的有效对象,从而推进心脏疾病的治疗进程[4]。成熟心肌细胞分离培养难度较大,并且由于每个实验室体外细胞培养的条件与方法不一致[5,6],导致原代培养的心肌细胞的存活率、纯度等有很大差异,不仅浪费人力物力,而且导致实验数据不稳定与差异性大等问题,无法满足实验需求,影响实验结果的准确性和可比性。本研究在传统乳鼠心肌细胞原代分离、培养技术基础上进行改良,使乳鼠心肌细胞能够成片状生长,有利于心肌细胞生理、病理及毒理等的基础实验研究进展。
1 材料与方法
1.1 材料
1.1.1 实验动物 出生24h 内的C57BL/6J 乳小鼠30只,由贵州医科大学实验动物中心提供。
1.1.2 实验设备 生物安全柜(新加坡ESCO 公司),恒温培养振荡器(美国Thermo 公司),CO2恒温细胞培养箱(美国Thermo 公司),倒置相差光学显微镜(德国Leica 公司),倒置荧光显微镜(德国Leica 公司)。
1.1.3 实验试剂 Dulbecco's Modified Eagle's Medium (DMEM)高糖型培养基(美国Corning 公司),胎牛血清(FBS,以色列BI 公司),5-溴脱氧尿嘧啶核苷(BrdU,美国Sigma 公司),明胶(美国Sigma 公司),0.25%胰蛋白酶(简称胰酶,杭州吉诺生物公司),Ⅱ型胶原酶(美国Thermo 公司),青霉素-链霉素溶液(简称双抗,杭州吉诺生物公司),Troponin I 兔多克隆抗体(美国Abcam 公司),Dylight488 标记羊抗兔IgG(美国Abcam 公司),TrionX-100(上海碧云天公司),牛血清白蛋白(BSA,美国AMRESCO公司),台盼蓝(北京索莱宝公司),无水乙醇(上海沪试),甲醛(上海沪试),磷酸盐缓冲液(PBS,杭州吉诺生物公司)。
1.2 试剂配制
1.2.1 培养基A 含体积分数为10% FBS 及1%双抗配制的DMEM 高糖型培养基。
1.2.2 培养基B 含体积分数为10% FBS、1%双抗以及0.1mmol/L BrdU 配制的DMEM 高糖型培养基。
1.2.3 消化液 将0.1%胰酶与0.1%胶原酶Ⅱ型混匀,现用现配。
1.3 细胞培养方法
1.3.1 取材 乳小鼠置于75%乙醇中消毒后,移入超净工作台,固定其四肢,用无菌眼科剪开胸并取出心脏,剪去心房及结缔组织部分,仅留取左心室,放入预冷PBS 中反复清洗血液,并移入另一无菌玻璃皿中,将心室组织剪为1mm3组织块,在冰上进行上述操作。
1.3.2 细胞消化 第一次消化心室组织:将剪碎后的心室组织移入50ml 离心管,加入10ml 消化液,放入37℃摇床100rpm,15min,弃掉上清,收集沉淀。第二次消化心室组织:将第一次消化后沉淀的心室组织中加入10ml 消化液,37℃摇床100rpm,10min,充分吹打后静止,待未消化完全细胞沉淀后小心收集上清(避免吸入组织块)置于20ml 培养液中。重复5~6次消化步骤,至完全消化为止,收集上清。用200μm筛网过滤,1 000rpm,4℃,离心8min,收集上清。
1.3.3 细胞培养 用培养基A 将收集到的细胞悬液再次重悬,接种于T25 培养瓶,放入5% CO2恒温(37℃)细胞培养箱培养1.5h(即差速贴壁分离法)。将T25 培养瓶中的上清液转移至另一无菌T25 培养瓶,放入细胞培养箱培养1h,进行第二次差速贴壁。同时,在六孔板中铺0.5%明胶,置于培养箱中培养1h 备用。收集上清并计数后,离心1 000rpm,4℃,8min,弃上清,留取细胞沉淀。用培养基B 重悬细胞沉淀,按照1.5×105/10cm2的细胞密度接种于包被0.5%明胶的六孔板中,放入细胞培养箱。同时,取200μl 未接种的细胞悬液进行细胞存活率检测。细胞培养24h 后给予培养基B 换液,前3 天每天使用培养基B 换液培养,以后使用培养基A(即不加BrdU)常规培养。
1.4 细胞形态学观察、细胞纯度及存活率检测
1.4.1 光学显微镜 细胞培养24h 后,于倒置相差光学显微镜下观察。
1.4.2 细胞免疫荧光染色及细胞纯度鉴定 实验前1d 将细胞消化后按照1.5×105/10cm2的细胞密度重新铺于24 孔板中培养24h。次日,拿出细胞吸出培养基,用预冷PBS 轻柔清洗细胞3 次。用4%甲醛溶液固定10min,预冷PBS 轻柔清洗细胞3 次;用0.2% TritonX-100 破膜10min,预冷PBS 轻柔清洗细胞3 次。3% BSA 室温封闭1h,预冷PBS 轻柔清洗细胞3 次。加入Troponin I 兔多克隆抗体(一抗浓度1∶400),放入细胞培养箱孵育16~20h。次日,吸出一抗,预冷PBS 轻柔清洗细胞3 次,加入Dylight488 标记羊抗兔IgG 抗体(二抗浓度1∶400),室温孵育1h,预冷PBS 轻柔清洗细胞3 次,在倒置荧光显微镜下观察。细胞纯度=荧光染色阳性细胞数/细胞总数×100%。
1.4.3 细胞存活率检测 利用台盼蓝染色法评价细胞存活率,是目前常规的检测方法。留取200μl 细胞悬液,加入等量0.4%台盼蓝染液,室温染色2~ 3min。将染色后的细胞悬液涂于载玻片上,盖玻片封片,于倒置相差光学显微镜下观察。任意选取5个视野,统计被染色细胞(死细胞)和未被染色细胞(活细胞)。细胞存活率(%)=未被染色细胞/(被染色细胞+未被染色细胞)×100%。
2 结果
2.1 细胞形态学观察及细胞纯度检测
2.1.1 光学显微镜 细胞培养24h 后,心肌细胞基本全部贴壁,伸出伪足,呈梭形、三角形或不规则形,核仁清楚(图1A)。培养48h 后,细胞伪足逐渐增多,呈局部片状。培养72h 后,大部分心肌细胞的突起相互交联,形成片状(图1B)。
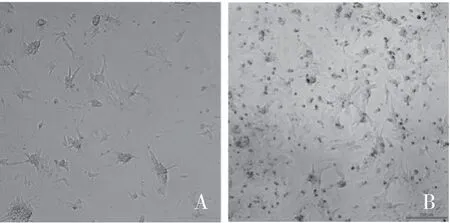
图1 乳小鼠原代培养的心肌细胞图
2.1.2 细胞免疫荧光染色 培养24h 和培养72h 后,通过免疫荧光染色检测贴壁心肌细胞,细胞呈梭形、三角形或不规则形。培养24h 后,细胞呈簇状或团状分布(图2A);培养72h 后,细胞已相互连接,形成片状(图2B)。随机选取5 个不同镜下视野计算出心肌细胞纯度为(95.30±1.36)%。
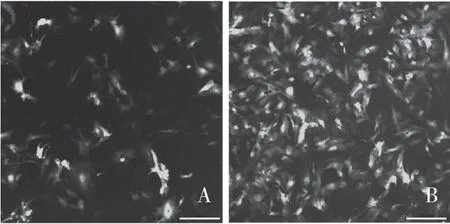
图2 乳小鼠原代培养的心肌细胞荧光染色图
2.2 细胞搏动频率在倒置显微镜下观察,细胞培养24h 后有少数自发性搏动;培养48h 后出现局部片状搏动,节律、频率不等,收缩频率为(99.33±5.13)次/min;培养第5 天,大部分心肌细胞呈同步收缩,收缩频率为(100.67±6.43)次/min;培养第7 天、第9 天、第11 天,细胞仍保持均一搏动,收缩频率分别为(104±10)次/min、(92.67±10.02)次/min、(97.00±9.17)次/min(图3)。
2.3 细胞存活率通过台盼蓝染色法我们检测出在培养第2 天、第5 天、第7 天、第9 天、第11 天的细胞存活率分别为(95.33±2.51)%、(83.00±3.60)%、(63.33±3.51)%、(57.67±3.06)%、(48.67±3.21)%(图4)。
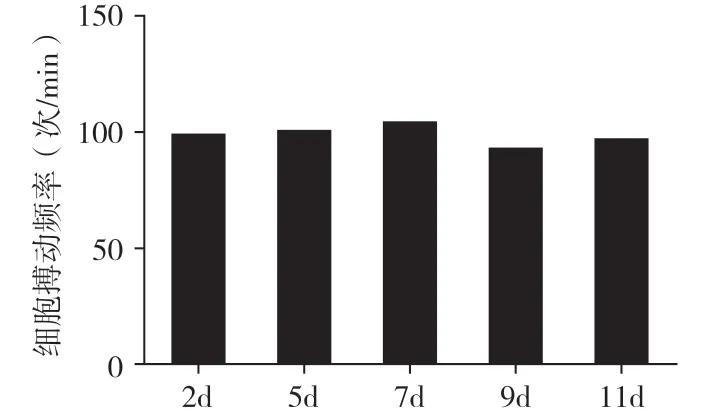
图3 乳小鼠原代培养心肌细胞搏动频率
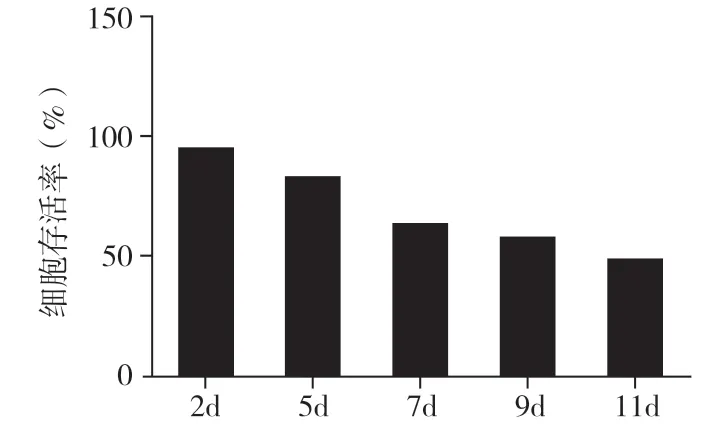
图4 乳小鼠原代培养心肌细胞存活率
3 讨论
心血管疾病的基础研究技术历经50年的发展,现今的电生理、钙瞬变、蛋白质组学及基因水平转移等研究,对探索心肌细胞病理生理状态的功能改变起到至关重要的推进作用[7]。心肌细胞的分离与培养则是深入研究心血管疾病最基础的手段[2]。体外培养的心肌细胞去除了体内复杂的体液、神经等因素的作用,尤其相较于心肌细胞株H9C2 更能有效反映心脏生理特性、信号传导通路及基因表达等,是研究心血管生理、病理、毒理的常用细胞模型[4]。心肌细胞对物理、化学等损伤极为敏感,这将导致体外分离培养的心肌细胞产量和存活率低等问题。此外,心肌细胞占心脏组织的25%,其余心脏成分以成纤维细胞为主[8],成纤维细胞分裂增殖能力强,更能成为体外培养的优势细胞。因此,为了在体外培养出纯度高、活性强的心肌细胞,我们根据实验研究经验,在传统的实验技术方法上进行 改良。
在小鼠年龄选择上,传统的心肌细胞培养选用出生3 天的乳鼠[5],认为此时的心肌细胞增殖更快,但是由于出生时间短的小鼠心脏组织中胶原组织含量少,细胞消化过程省时省力,并且能减少对心肌细胞的损害,因此,我们选用出生24h 内的小鼠进行实验。在实验操作的时间节点选择上,传统的实验方法是差速贴壁1 次,时间为1.5h[2,8],但是我们发现,在第1 次差速贴壁后的上清液中仍有大量成纤维细胞,由于心肌细胞的贴壁时间为4~24h,因此,我们将第1 次差速贴壁后收集的上清液进行第二次差速贴壁,时间为1h。在培养细胞接种密度上,细胞接种密度对细胞正常生长也同样重要,细胞过密导致营养不良,细胞过疏也将降低细胞间信号传递,由于大多数实验室暂无标准化的细胞接种密度,我们根据William 等[9]的研究,推荐使用1.5×105/10cm2的细胞密度进行接种。我们所分离培养的心肌细胞在搏动节律上一致,搏动频率在培养第2~11天无明显差异。通过以上三点的改进,我们在体外分离培养的心肌细胞存活率在培养第2 天达(95.33±2.51)%,在培养第11 天达(48.67±3.21)%,是前面的研究所没有观察到的[8,10]。
综上所述,我们在短时间内体外分离培养获得纯度高、存活率高、生长状态良好的成片状的原代心肌细胞,有利于今后为心血管疾病的基础研究提供参考。
