乳腺癌超声造影边缘带增强特征及定量参数与其免疫组化指标的相关性分析
2020-06-01王婧婕贾春梅
王婧婕 胡 田 贾春梅
乳腺癌是一种高度血管异质性、恶性基质化的肿瘤,发病率逐年上升,严重威胁女性的生命健康[1]。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表 皮 生长因子受体-2(human epidermal growth factor receptor-2,HER-2)和增殖细胞核抗原(proliferating cell nuclear antigen,Ki-67)作为与乳腺癌密切相关的免疫组化指标,既可以影响病灶的超声表现[2],又可以反映乳腺癌预后并指导治疗。研究[3]表明肿瘤边缘带是反映其生物学行为的重要部分,与预后密切相关。本研究通过分析乳腺癌超声造影边缘带增强特征以及定量参数与免疫组化指标的相关性,以期指导乳腺癌患者术前精准治疗方式的选择。
资料与方法
一、研究对象
选取2016年9月至2019年7月于我院行超声造影检查的乳腺癌女性患者76例(76个病灶),年龄22~78岁,平均(47.0±12.1)岁。所有患者均经术后病理及免疫组化证实,包括浸润性导管癌65例,浸润性小叶癌4例,导管内原位癌4例,黏液癌3例。纳入标准:有明确病理诊断且超声图像清晰的乳腺癌患者;术前均未进行放化疗治疗。本研究经我院医学伦理委员会批准,入选者均知情同意。
二、仪器与方法
1.超声造影检查:使用GE Logiq E 9彩色多普勒超声诊断仪,9L和ML6-15探头,频率分别为9 MHz和6~15 MHz;配备QLAB分析软件。造影剂使用SonoVue(意大利Bracco公司),使用前加入5.0 ml 0.9%生理盐水用力振荡制备成混悬液备用。嘱患者取仰卧位,双臂上举充分暴露乳腺,常规多切面观察病灶,在乳腺病灶显示较好时切换至造影模式,经肘静脉快速推注配置好的造影剂混悬液4.8 ml,随后立即注射5.0 ml 0.9%生理盐水,实时观察、记录并储存3~5 min造影灌注动态图像。由2名经验丰富的超声医师回放观察乳腺癌病灶造影后增强范围、边界、边缘增强特征。边缘增强特征标准[4]:当出现3个及以上不同方向的血管从病灶外向病灶内部汇聚时定义为放射状增强;1支或多支粗大扭曲的供血血管从病灶边缘穿入病灶内部时定义为穿支增强;病灶边缘出现造影剂环状充填时定义为环状增强。造影后边缘有放射状增强、环状增强及穿支增强的一种或几种均记为有边缘增强特征;若均无则记为无边缘增强特征。
2.定量参数检测:开启QLAB软件,避开病灶的滋养血管及坏死区,选取超声造影后病灶增强范围的边缘上、下、左、右4处感兴趣区域,软件自动生成各区域时间-强度曲线(time-intensity curve,TIC),获得该区域血流灌注参数,包括峰值强度、基础强度、梯度、上升支斜率、达峰时间、曲线下面积。计算4处感兴趣区域灌注参数的平均值进行统计学分析。
3.免疫组化检测:由我院病理科医师对标本进行免疫组化判定,ER、PR、HER-2、Ki-67表达情况均采用SP染色法进行测定。ER、PR判定:肿瘤细胞核染色≥10%判定为阳性,<10%判定为阴性。HER-2以SP染色后细胞膜出现棕色颗粒着色阳性细胞数≥10%记为“+”,≥20%记为“++”,≥30%记为“+++”,其中“0”或“+”判定为阴性;“++”经HER-2基因扩增,有基因扩增判定为阳性,无基因扩增判定为阴性;“+++”判定为阳性。Ki-67判定:细胞核棕黄色染色≥14%判定为阳性,<14%判定为阴性。
三、统计学处理
应用SPSS 20.0统计软件,超声造影边缘带增强特征与免疫组化指标相关性分析行χ2检验;定量参数与免疫组化指标相关性分析采用Spearman相关分析法。P<0.05为差异有统计学意义。
结 果
一、免疫组化结果
本研究76例乳腺癌患者中,ER表达阳性49例,PR表达阳性45例,HER-2表达阳性25例,Ki-67表达阳性58例。
二、乳腺癌超声造影边缘带增强特征与免疫组化指标的相关性分析
乳腺癌病灶边缘带放射状增强与ER、Ki-67阳性表达均相关,穿支增强与HER-2阳性表达相关,造影后范围扩大与ER、HER-2、Ki-67阳性表达均相关,边缘增强特征与Ki-67阳性表达相关,差异均有统计学意义(均P<0.05);环状增强、造影后边界不清与ER、PR、HER-2、Ki-67表达均无明显相关性。见表1。
三、乳腺癌超声造影边缘带定量参数与免疫组化指标的相关性分析
乳腺癌超声造影边缘带定量参数峰值强度、TIC曲线下面积及梯度与Ki-67阳性表达均呈正相关,达峰时间与ER、PR阳性表达均呈负相关,差异均有统计学意义(均P<0.05)。见表2和图1。
讨 论
乳腺癌发生、发展、侵袭及转移均依赖于新生血管,肿瘤边缘带是肿瘤细胞生长旺盛的区域,血管密度大,分布密集,相互吻合形成袢,部分血管呈窦状扩张,最大微血管密度多位于病灶边缘2.5 mm内[5]。应用超声造影不仅可以清晰观察到肿瘤内微小血管的走行、分布情况,还可以对肿瘤进行定量分析,为乳腺癌术前诊疗提供影像学参考依据[6]。ER、PR、HER-2、Ki-67等免疫组化指标与乳腺癌诊疗方法的选择及预测预后密切相关,从超声造影角度早期无创客观分析乳腺癌边缘带特征与免疫组化指标的相关性已成为目前临床的研究热点[7]。

表1乳腺癌病灶超声造影边缘带增强特征与免疫组化指标的相关性分析 例
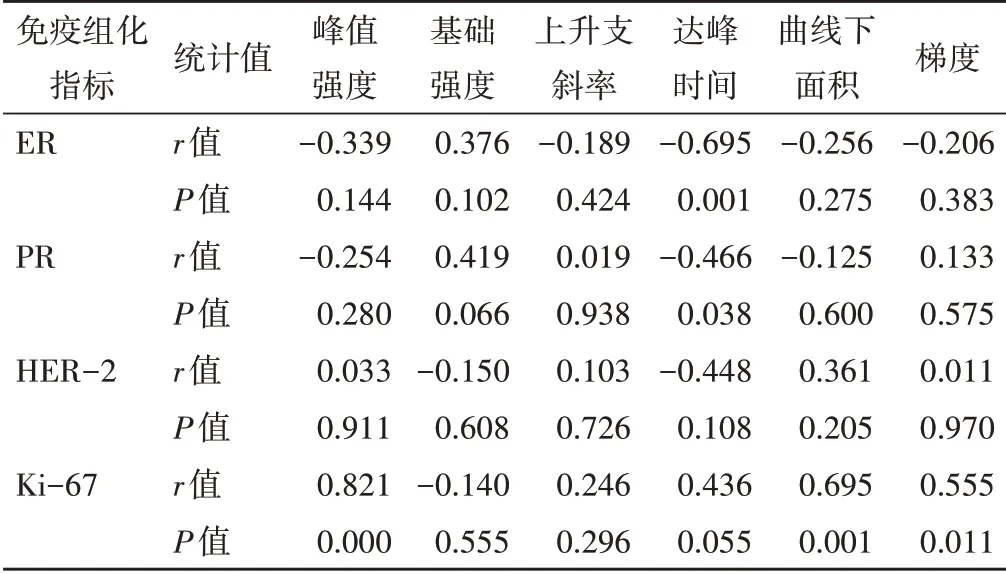
表2 乳腺癌边缘带定量参数与免疫组化指标的相关性分析
本研究中乳腺癌边缘带造影后范围扩大与ER、HER-2、Ki-67阳性表达均相关(均P<0.05)。分析其原因,ER、HER-2、Ki-67阳性表达可刺激病灶边缘的肿瘤细胞向周围正常乳腺腺体或脂肪结缔组织浸润蔓延,引起间质反应形成不规则界面的瘤周间质反应带[8]。此是乳腺癌血管异质性最明显的区域,呈浸润性生长,与正常乳腺组织相互交叉存在。一般肿瘤包膜不完整或无包膜,二维超声所测量的病灶大小较实际癌细胞浸润范围小。乳腺癌边缘带造影后范围扩大的原因为浸润区域血管显影。本研究还发现乳腺癌边缘带放射状增强与ER、Ki-67阳性表达均相关。原因为位于肿瘤边缘带的相关肌纤维母细胞可诱导ER表达阳性,分泌大量血管生成因子及促生长因子。Ki-67又称为肿瘤增殖相关蛋白[9],能够客观准确地反映肿瘤细胞的增殖活性。当ER、Ki-67表达阳性时,肿瘤成分沿导管向周围组织蔓延浸润,新生血管形成速度快于肿瘤生长速度,致其从肿瘤实质穿入周围组织,且肿瘤新生血管近肿瘤处内径较宽,在穿入周围组织过程中逐渐变细,呈“蟹足征”[10],故超声造影呈放射状增强。本研究结果提示乳腺癌边缘带穿支增强与HER-2阳性表达相关。分析原因为HER-2作为一种原癌基因,既可以抑制肿瘤细胞的凋亡,又可以破坏乳腺大部分正常血管、上调血管内皮生长因子(vascular endothelial growth factor,VEGF)刺激肿瘤血管的形成[11]。随着新生血管的增多和血管内皮细胞的繁殖,肿瘤得到滋养,细胞氧耗增加,致肿瘤体积迅速增加,而为了确保肿瘤养分充足,微血管密度及肿瘤新生血管内径也随之增加,分支紊乱、走行迂曲的新生血管相互融合并从肿瘤周边向肿瘤延伸形成穿支血流[12]。
本研究乳腺癌边缘带定量分析结果显示,峰值强度、曲线下面积和梯度与Ki-67阳性表达均呈正相关。Ki-67作为肿瘤增殖相关蛋白,与VEGF呈正相关,即Ki-67阳性率越高,则表明处于增殖期的乳腺癌细胞越多,分泌的VEGF越多。Ki-67与VEGF的协同作用可促进病灶边缘生成新生血管,微血管密度增加,血流丰富,灌注速度快,造影剂快速进入病灶内并滞留[13]。峰值强度、曲线下面积及梯度均可以反映局部组织微血管密度及血流灌注情况,因此Ki-67表达越高,其值越大。本研究中乳腺癌边缘带定量参数达峰时间与ER、PR阳性表达均呈负相关,分析其原因,雌激素、孕激素与ER、PR结合可以上调VEGF,使得肿瘤边缘形成大量杂乱无序、走行迂曲、管壁纤薄的新生血管及动静脉瘘[14],呈异常高速血流,故造影剂随血流快速进入肿瘤内,因此ER、PR阳性表达者超声造影达峰时间较ER、PR阴性表达者更短。
综上所述,乳腺癌超声造影边缘带增强特征及定量参数与ER、PR、HER-2、Ki-67均有一定的相关性,可为乳腺癌患者术前选择精准的治疗方式提供一定的影像学参考依据。但本研究样本量比较少,今后需扩大样本量进一步研究。
