盐酸血竭素对金黄色葡萄球菌分选酶A 活性影响研究
2020-06-01刘玉敏金太花王建峰邓旭明关立增
刘玉敏,金太花,王建峰,邓旭明,关立增*
(1. 长春科技学院,吉林 长春 130600;2.临沂大学 农林科学学院,山东 临沂 276005;
3.吉林大学动物医学学院,吉林 长春 130062)
金黄色葡萄球菌(Staphylococcus aureus)是临床上较为常见的重要致病菌,可导致人或者动物的多种致死性感染[1-2]。虽然抗生素的应用对S.aureus 感染有着较好的控制作用,并为人类健康和养殖业发展做出了巨大贡献。但是随着抗生素的长期临床应用及滥用,S.aureus 的耐药性越来越强[3-4]。因此临床上迫切需要研发新的抗S.aureus 的药物。而盐酸血竭素(Dracorhodinperochlorate,DP)是从一种叫血竭的水果中分离出的物质,研究发现,DP具有抗S.aureus的作用,但具体抗菌机制尚不清楚,有待进一步研究[5]。
研究表明,分选酶A(SrtA)是介导S.aureus 感染的主要成分之一,SrtA 可使粘附表面蛋白锚定于细胞壁上,在细菌粘附过程中起到重要作用[6]。因此,通过以SrtA 为药物作用靶标筛选抗S.aureus 药物是有效的途径之一[7]。但关于DP 是如何通过调控SrtA 而起到抗S.aureus 感染的机制还未见报道。因此,本实验利用纤连蛋白粘附、荧光底物肽实验、生物膜实验、细胞侵袭、分子模拟和定点残基突变方法,从多个角度分析和验证DP 对S.aureus SrtA 的作用机制,为DP 抗S. aureus 的作用机制提供参考依据。
1 材料与方法
1.1 主要实验材料 S. aureus BAA-1717 和J774 细胞购自ATCC(美国标准生物品保藏管理中心);ΔSrtA 突变菌株和SrtA 蛋白表达载体pGEX-6P-1-SrtAΔN59保存于吉林农业大学预防兽医学实验室;DP购自成都瑞芬思生物科技有限公司;纤维蛋白原、纤连蛋白为Sigma-Aldrich 产品;荧光底物肽(Dabcyl-QALPETGEE-Edans)由吉尔生化公司合成。
1.2 SrtA 蛋白的表达及纯化 将pGEX-6P-1-SrtAΔN59培养至OD600nm为0.6~0.8,加入1 mmol/L IPTG 过夜诱导培养。离心后收集菌体重悬于PBS 中,超声裂解细菌,离心60 min 后收集裂解液上清,利用GST 标签柱料纯化表达的重组SrtA 蛋白。
1.3 DP 对SrtA 蛋白的抑制活性检测 采用荧光共振能量转移法(FRET)检测DP 抑制S. aureus SrtA 蛋白的活性。荧光底物肽用去离子水稀释50 倍;90 μL纯化SrtA(蛋白浓度是2 μg/mL)与不同浓度的DP(2 μg/mL、4 μg/mL、8 μg/mL、16 μg/mL) 于96 孔板中37 ℃孵育30 min,随后加入10 μL 荧光底物肽,混匀并避光置于37 ℃孵育1 h,酶标仪检测样品的荧光数值。设蛋白酶K 处理荧光底物肽为阳性对照组,去离子水处理荧光底物肽为阴性对照组,药物处理荧光底物肽为药物处理组。
1.4 细胞侵袭试验 将J774 细胞培养于DMEM 高糖培养基内并重悬细胞于培养基内,1 mL 细胞(4×105个)铺板于24 孔板内(含载玻片)。S.aureus BAA-1717 于TS 培 养 基 内(含 不 同 浓 度DP:2 μg/mL、4 μg/mL、8 μg/mL、16 μg/mL)培养至对数生长中期(OD600nm为1.0),离心(5 000 r/min 5 min)并重悬于DMEM 高糖培养基内(OD600nm为0.1)。弃掉培养板中的培养基并加入1 mL 重悬菌液(含不同浓度DP),37 ℃培养1 h。预热PBS 清洗3 次,载玻片加入0.2%的Triton,充分裂解后并倍比稀释,样品涂在TSB 固体培养板上,37 ℃孵育过夜并计算菌落数量[8]。
1.5 DP 对SrtA 介导的S. aureus 黏附功能的影响向96 孔板每孔中分别加入100 μL 纤连蛋白母液,4 ℃孵育过夜,次日移出溶液,PBS 清洗2~3 次,然后加入100 μL/孔5%BSA 溶液,于37 ℃孵育2 h,移出BSA 溶液,并用PBS 溶液清洗2~3 次,备用。
分别挑取S. aureus BAA-1717 单菌落和ΔSrtA 突变株单菌落至2 mL LB 培养基中,于37 ℃200 r/min培养8 h。然后将BAA-1717 菌液转移至1 L 的LB 培养基中,ΔSrtA 突变株菌液转移至100 mL LB 培养基中,于37 ℃200 r/min 继续培养30 min。之后从BAA-1717 菌液中分别吸取10 mL 液体于5 个50 mL 锥形瓶中,并分别加入0、2 μg/mL、4 μg/mL、8 μg/mL、16 μg/mL 的DP 溶 液 与S. aureus BAA-1717 共 孵 育,同时吸取10 mL ΔSrtA 突变株菌液于50 mL 锥形瓶中,于37 ℃200 r/min 培养2 h。将菌液转移至灭菌离心管中,3 000 r/min 离心5 min,弃上清,用PBS清洗菌体3 次,最后用PBS 重悬菌体并调节菌液至OD600nm=1.2,备用。
向上述备好的96 孔板中分别加入100 μL 两种菌液,37 ℃孵育2 h。用PBS 溶液清洗2 次,弃PBS 溶液并加入25%的甲醛溶液固定20 min。移去甲醛溶液并用PBS 溶液清洗3 次后加入100 μL 冰醋酸溶液,用酶标仪在波长570 nm 下检测溶液吸光度[9],根据吸光度计算细菌粘附率并绘制结果图。
1.6 生物膜实验 挑取S. aureus BAA-1717 单菌落至2 mL LB 培养基中,并向各个试管中分别加入浓度为0、2 μg/mL、4 μg/mL、8 μg/mL、16 μg/mL 的DP 溶液,于37 ℃、200 r/min 培养过夜,调节OD600nm至0.01 后向96 孔板每孔中分别加入100 μL 菌液,于37 ℃孵育24 h,移去菌液后PBS 溶液清洗2 次,加入结晶紫溶液固定生物膜, PBS 清洗两次后加入无水乙醇溶液,利用酶标仪在570 nm 波长下检测溶液吸光值。另设阳性对照为S.aureus BAA-1717 菌液,阴性对照为PBS。
1.7 DP 抗SrtA 活性机制分析及验证 参照王琳等[10]应用同源模建、分子对接和分子动力学模拟等方法分析DP 与SrtA 的结合模式图和潜在的互作位点。以野生型SrtA蛋白表达质粒为模板对SrtA蛋白进行了定点残基突变,定点残基突变引物如下:SrtAΔN59P30A:F(5'-GAACCAGTATATGCGGGACCAGCAAC-3');R(5'-GTTGCTGGTCCCGCATATACTGGTTC-3');SrtAΔN59T105A:F(5'-GATGTTAAGCCTGCGGATGTAGAAGTTC-3')R(5'-GAACTTCTACATCCGCAGGCTTAACATC-3')。根据定点残基突变试剂盒说明书进行突变,测序验证定点残基突变是否成功。SrtAΔN59P30A和SrtAΔN59T105A(两者均为分选酶A 结合蛋白)表达纯化参照试验1.2“野生型SrtA 表达和纯化”;DP 对SrtAΔN59、SrtAΔN59P30A和SrtAΔN59T105A活性的影响参照试验1.3“荧光底物肽实验”。
1.8 数据处理 所有试验均为3 次重复,且试验数据以Mean±SD 表示。数据统计分析应用SPSS 13.0软件,应用student's t-test 分析方法检测实验组之间的差异性,当*代表p<0.05 时表示实验组间差异性显著,**代表p<0.01 时表示实验组间差异性极显著。
2 结 果
2.1 DP对SrtA蛋白抑制活性影响检测结果 将浓度为不同的DP 与SrtA 蛋白共孵育,加入荧光底物肽检测荧光变化情况。结果显示,2 μg/mL、4 μg/mL、8 μg/mL 和16 μg/mL 4 种浓度DP 对SrtA 催化活性抑制率分别为17.55%、28.86%、46.32%和56.45%,无药物处理的样品可正常催化底物,其抑制率设定为0,然而随着药物浓度的增加,DP 对SrtA 催化活性的抑制作用明显增强(图1)。表明盐DP 在较低浓度下即可抑制S.aureus SrtA 蛋白的催化活性,并且抑制作用呈浓度依赖性。
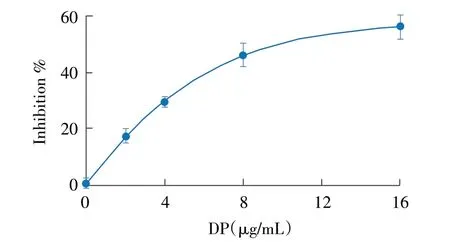
图1 DP 对SrtA 蛋白催化活性影响的检测结果Fig.1 The influence of DP on the catalytic activity of SrtA
2.2 DP 抑制S. aureus 对宿主细胞的侵袭作用J774 巨 噬 细 胞 分 别 与4 和16 μg/mL 的DP 共 孵 育 的S. aureus BAA-1717 和菌株ΔSrtA 互作后,观察各菌株侵入J774 巨噬细胞的情况。结果显示,野生型菌株可以侵入巨噬细胞,而ΔSrtA 不能有效侵入巨噬细胞,且与DP 共孵育菌株侵入巨噬细胞的数量显著减少(p<0.01),并呈现DP 剂量依赖性(图2)。表明SrtA 在细菌侵袭过程中至关重要,而DP 可能通过影响SrtA 的催化活性从而阻碍表面蛋白锚定于宿主细胞表面,进而降低了细菌侵袭细胞的能力。
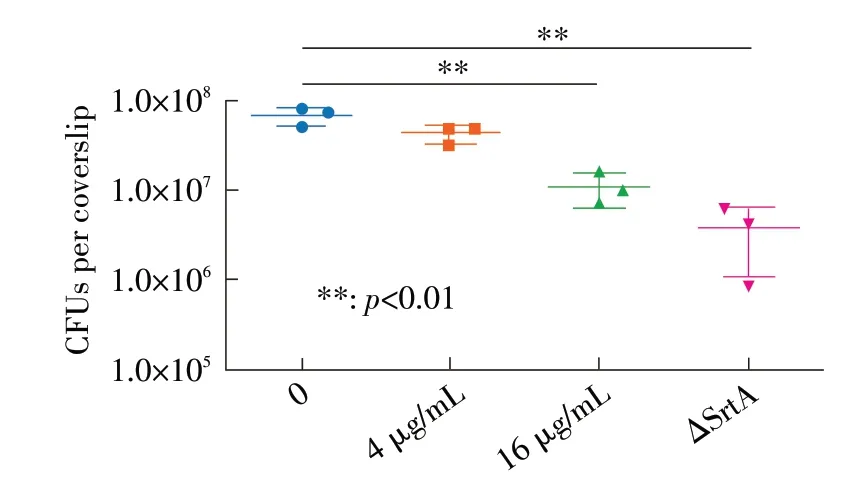
图2 DP 对S.aureus 侵袭J774 细胞影响的检测结果Fig.2 The effect of DP on the invasion of S.aureus into J774 cells
2.3 DP 对S.aureus 黏附功能的影响 利用不同浓度的DP 预处理S.aureus BAA-1717,检测其对BAA-1717 与纤连蛋白结合能力的影响。结果显示,与野生型菌株黏附率100%相比,ΔSrtA 突变菌株与纤连蛋白结合能力下降了40.08%,测得其OD570nm值仅为0.29,差异极显著(p<0.01);而DP 预处理S. aureus BAA-1717 组结果显示,当DP 浓度分别为8 μg/mL和16 μg/mL 时,其OD570nm值分别为0.39 和0.31,与野生型菌株相比分别下降了22.12%和38.92%,差异极显著(p<0.01)(图3)。表明,DP 抑制S. aureus 黏附能力呈剂量依赖性。

图3 DP 对S.aureus 粘附细胞外基质的影响Fig.3 The influence of DP on the adesion of S.aureus to fibronectin
2.4 DP 对S. aureus 生物被膜(BF)形成的影响利用不同浓度的DP 预处理菌株BAA-1717 及ΔSrtA突变菌株后,采用结晶紫法检测BF 形成能力。结果显示,与野生型菌株相比,ΔSrtA 突变菌株及DP预处理的菌株形成BF 的能力均显著性下降(p<0.01),且随着DP 浓度的增加,BF 形成能力逐渐下降,呈现剂量依赖性(图4)。表明,这一抑制作用与DP 抑制S.aureus SrtA 催化活性及细菌与细胞外基质黏附活性相一致。

图4 DP 对S.aureus BF 形成的影响Fig.4 The effect of DP on the biofilm formation of S.aureus
2.5 DP 抗SrtA 机制分析和验证 本试验通过计算生物学方法对DP 与SrtA 结合模型图进行了确定,结果显示,结合模式图的稳定性主要是由于DP 与SrtAΔN59的P30 和T105 结合并封闭了SrtA 的活性中心(图5)。为进一步验证这一理论值,构建SrtAΔN59及其突变子SrtAΔN59P30A和SrtAΔN59T105A,并分析了DP 对蛋白催化活性的影响。结果显示,DP 可有效抑制SrtAΔN59的催化活性,但DP 对SrtAΔN59P30A和SrtAΔN59T105A催化活性的抑制作用明显减弱(p<0.01)(图6)。表明,DP 通过与SrtAΔN59中的P30 和T105 结合而封闭了其活性中心。
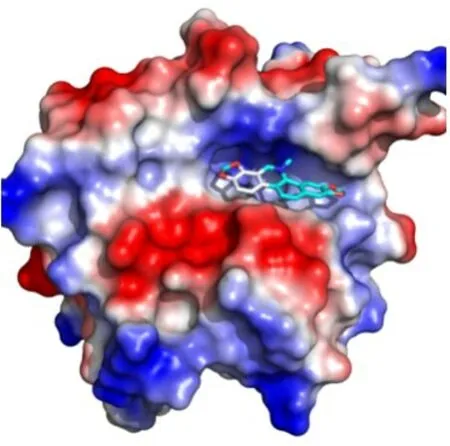
图5 DP 与SrtA 结合示意图Fig.5 A schematic model of the binding of DP to SrtA
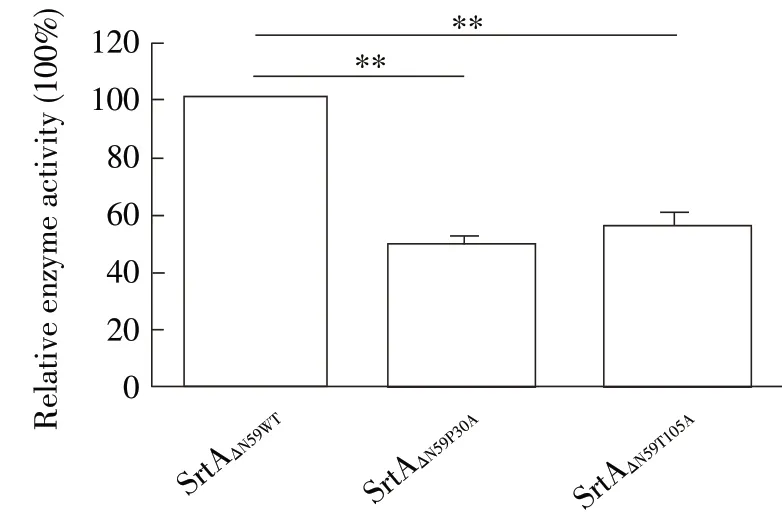
图6 DP 对SrtA 及其突变子蛋白催化活性的影响Fig.6 The influence of DP on the catalytic activity of SrtA and its mutants
3 讨 论
近年来,随着人们对细菌性感染机制的逐步了解,抗毒力策略的提出为细菌性感染的治疗提供了新的思路,毒力因子在细菌性感染过程中的作用越来越受到研究者们的重视[11-13]。S.aureus 黏附和损伤宿主细胞的关键性毒力因子包括表面黏附蛋白和细胞外毒素[14]。SrtA 介导了其中20 余种表面蛋白共价锚定到细菌细胞壁上,它对于S.aureus 定植和侵入组织以及诱发感染是极其重要的。SrtA 是一种“管家”分选酶,它的同系物是相当保守的,几乎存在于所有的革兰氏阳性菌中[15],因此本试验选取其为S.aureus 抗毒力治疗的靶点。先前的研究通过从天然化合物中筛选、生物合成以及高通量筛选等方法,已经成功发现了几种不同类型的SrtA 抑制剂[16]。
已有研究报道S.aureus SrtA 缺失株表面蛋白锚定明显下降,对细胞的侵袭和小鼠乳腺炎感染模型中的致病力显著下降[17]。另外,SrtA 存在于大部分革兰氏阳性致病菌中,且结构同源性较高,尤其是催化活性中心,提示SrtA 是革兰氏阳性病原菌(尤其是S.aureus)感染药物研发的潜在靶点[18]。传统抗生素以病原菌生命所必需成分(如DNA、蛋白质、细胞膜和细胞壁等)为靶标而直接发挥杀菌或抑菌活性,给予靶细菌选择压力大,易诱导耐药性。与抗生素作用机理不同,通过干预病原菌感染过程并不影响细菌生存,既可以有效防治病原菌感染,又对病原菌选择压力较小,不易诱导耐药性[19]。
本研究首先进行了细胞S. aureus 的侵袭实验,结果表明,DP 能够降低S. aureus BAA-1717 侵袭J774 细胞的能力,侵袭进入细胞内的细菌数量显著减少。同时通过荧光共振能量转移法,将激发波长设定为350 nm、发射波长设定为495 nm 进行检测,结果显示,S.aureus SrtA 蛋白的活性能够被DP 有效抑制。该结果进一步说明DP 可以通过抑制SrtA 蛋白活性而降低金葡菌对细胞的侵袭能力。
本研究也发现,DP 对S.aureus SrtA 的活性产生抑制之后,S.aureus 与细胞纤连蛋白结合能力显著降低,从而减少了其对细胞的黏附作用。该结果也进一步证实SrtA 可干扰S.aureus 与细胞纤连蛋白的结合作用,这与前人的观点[20]基本一致。此外,本实验室在研究DP对S.aureus 生物膜的形成影响时发现,与野生型菌株相比,ΔSrtA 突变菌株及DP 预处理的菌株形成BF 的能力均显著性下降。该结果说明,DP 也可以通过干扰S.aureus BF 合成而起到抑菌作用。
为了进一步确定DP 与SrtA 的作用机制,本研究采用计算生物学手段和定点残基突变等方法对二者作用机制进行了研究。研究发现,DP 可直接与SrtA 的P30 和T105 结合而封闭蛋白的活性中心,进而影响着SrtA 所参与的一些生物学过程。该结果进一步阐明了DP 通过与SrtA 作用而抗S.aureus 是其抗菌的主要机制之一。
综上所述,本研究结果进一步补充性地证实了以病原菌毒力因子为靶标的抗毒力策略的可行性,也为S.aureus 药物治疗,提供了新的作用靶标。
