当量生物素控制对谷氨酸棒杆菌发酵产L-异亮氨酸的影响
2020-05-29熊海波梅漫莉徐庆阳
熊海波,梅漫莉,徐庆阳,2,3*
(1.天津科技大学 生物工程学院,天津 300457;2.天津市氨基酸高效绿色制造工程实验室, 天津 300457;3.代谢控制发酵技术国家地方联合工程实验室,天津 300457)
L-异亮氨酸是人体必需的氨基酸,同时又是3种支链氨基酸之一[1],因其特殊的结构和功能,在人类生命代谢中具有极其重要的地位[2,3]。异亮氨酸是人体激素、蛋白质合成和能量生成的原料,在细胞膜的跨膜运输中发挥着至关重要的作用[4]。同时作为食品添加剂,可调节食品中的氨基酸平衡,因此,被广泛应用于食品与医药等行业,具有巨大的商业价值[5]。日本在L-异亮氨酸产量、品质和技术水平上均居世界领先地位,2018年,全球生产L-异亮氨酸的主要厂家日本的味之素、协和发酵、田边制药以及德国的Degussa均以发酵方式为主,其中,日本味之素占据了全球医药及食品用氨基酸市场份额的60%[6-8]。中国L-异亮氨酸发酵产业起步较晚,技术水平落后,糖酸转化率低,发酵副产物较多,后期分离提取困难,因此在国际上行业竞争能力相对较弱[9],但随着20世纪90年代中国氨基酸市场的开放,国内发酵行业迅猛发展,目前中国已经成为氨基酸发酵产业大国[10,11]。微生物要大量积累L-异亮氨酸,必须使代谢调节异常化,这种代谢调节异常化的细胞对环境条件是敏感的,所以需要优化发酵条件[12]。当前,微生物发酵法产异亮氨酸主要以大肠杆菌作为工程菌株,但大肠杆菌发酵控制条件复杂,易受噬菌体侵染,且副产物缬氨酸产量较高,分离提取困难。为解决上述问题,提高L-异亮氨酸产量及糖酸转化率,保证菌种产酸的稳定性,本研究以谷氨酸棒杆菌YILM 1504为供试菌株,以生物素为唯一变量,确定了发酵产L-异亮氨酸过程中最适生物素添加量及中后期补料工艺。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
谷氨酸棒杆菌(Corynebacteriumglutamate)YILM 1504:由天津科技大学代谢工程实验室保存。
1.1.2 培养基配方
种子培养基配方:葡萄糖25 g/L,MgSO40.5 g/L,KH2PO45 g/L,(NH4)2SO45 g/L,酵母浸粉5 g/L[13],玉米浆干粉20 g/L,VH0.1 mg/L,VB10.3 mg/L,消泡剂 0.2 g/L,用NaOH调节pH到4.5~5之间,种子发酵罐培养用氨水调节并维持pH到6.7~7.0之间。
发酵培养基配方:葡萄糖80 g/L,MgSO40.8 g/L,KH2PO41.6 g/L,(NH4)2SO45 g/L, 玉米浆干粉(10,20,30,40 g/L,即15,30,45,60 μg/L),VB10.3 g/L,豆饼水解液10 mL/L,赖氨酸0.2 g/L,蛋氨酸0.2 g/L,培养基pH用NaOH调节到4.5~5之间,发酵培养过程中pH用氨水调节并维持到6.7~7.0之间。
1.2 仪器与设备
LDZH-100KBS型全自动立式蒸汽灭菌器 天津博鑫生物科技有限公司;5 L自动控制发酵罐 上海保兴生物设备工程有限公司;SBA-40E 生物传感分析仪 山东省科学院生物研究所;Agilent 1200高效液相色谱仪 Agilent Technologies公司;KQ-C 高压蒸汽发生器 上海奉贤协新机电厂;752分光光度计 上海分析仪器厂;Olympus生物显微镜 日本Olympus 会社。
1.3 方法
1.3.1 菌种培养
从-80 ℃冰箱中取出谷氨酸棒杆菌Corynebacteriumglutamate)YILM 1504保菌管,在无菌间传两根斜面试管,32 ℃培养箱培养活化24 h,活化后的菌株再传2个200 mL茄形瓶,继续32 ℃培养24 h,保持菌株旺盛的活力[14]。
2 L种子发酵培养,发酵罐接种3 L,32 ℃,维持pH在 6.7~7.0。初始通风2.0 L/min,初始罐压小于0.05 MPa,初始转速200 r/min,种子培养时间16 h,期间转速逐步调节到400 r/min,其他条件不变,OD600大于20×0.8可接发酵培养。
3 L发酵培养,种子罐留600 mL种子液,添加发酵培养基,定容到3 L,发酵液连续培养46 h。温度32 ℃,pH 6.7~7.0,溶氧保持在30~40之间,转速由200 r/min逐步提高到900 r/min。通风量由2.0 L/min逐步提升到6.0 L/min。16 h后测残糖,流加80%(体积分数)的葡萄糖,维持罐内残糖在10~20 g/L之间。中间添加适量消泡剂消除泡沫[15]。
1.3.2 梯度浓度生物素添加对比实验
5 L发酵罐中,发酵培养基其他条件不变,10,20,30,40 g/L玉米浆换算成生物素添加量分别为15,30,45,60 μg/L。设置4个生物素添加量梯度,每个梯度3批实验,探究生物素浓度对菌体量、产酸和副产物的影响。
1.3.3 直接添加与分批流加生物素对比实验
5 L发酵罐中,分批流加实验的发酵培养基成分及培养条件与底料直接添加生物素相同,但分批流加生物素实验,在发酵培养期间,分别在18,32,42 h添加10 g/L的玉米浆(15 μg/L的生物素)。每个实验设置3个批次,探究流加生物素对菌体量及产酸的影响。
L-异亮氨酸发酵初期为0~18 h,中期为18~32 h,后期为42~56 h,发酵间期指整个发酵过程,为0~56 h。图6中初期添加指直接添加实验,间期补加指分批流加实验。
1.3.4 玉米浆干粉处理方法
用铁锅称取800 g玉米浆干粉,添加2 g消泡剂,溶于2.1 L水中,电磁炉240 ℃煮40 min,得到的玉米浆浓液,冷却后定容到2 L,制备成40%玉米浆液体备用。
普通玉米浆本身富含糖、氮和微生物生长无机微量元素和有机因子,保存不当容易滋生杂菌,导致酸败变质,使其成分有较大的波动。而玉米浆干粉为超低温喷雾干燥的固体颗粒,内在质量比普通液体玉米浆质量稳定(有效活性成分均一而稳定)可控,从而使生物发酵的稳定性和重现性保持良好。该实验使用玉米浆干粉为保龄宝生物股份有限公司生产,每1 g 40%玉米浆溶液中含有1.5 μg生物素。
1.3.5 异亮氨酸及副产物检测
发酵液中只检测到丙氨酸一种主要副产物,因此只需测L-异亮氨酸和丙氨酸含量。
发酵期间,用纸层析法初步检测产酸量,发酵结束后用高效液相色谱精密检测产酸量及副产物含量。
纸层析法:点样1 μL样品与标品,展开剂为正丁醇∶冰醋酸∶水为4∶1∶2,展开时间20 min,结束后晾干,茚三酮显色,然后置于80 ℃烘箱中干燥30 s即呈现红色斑点,对比颜色深浅、斑点大小,得出浓度。
高效液相色谱:发酵液中L-异亮氨酸和丙氨酸浓度用高效液相色谱法测定。采用Agilent C18( 15 mm×4.6 mm,3.5 μm) 色谱柱,衍生剂为2,4-二硝基氟苯,柱前衍生,流动相为50%的乙腈、4.1 g/L 的醋酸钠溶液,柱温33 ℃,流速1 mL/min,检测波长360 nm[16]。
1.3.6 pH的测定
采用pH 6.4~8.0精密pH试纸测定。
1.3.7 残糖含量检测
每2 h取样离心,留上清。用SBA生物传感分析仪检测残糖含量。
1.3.8 菌体量检测
每2 h取样,分别稀释10,20,100倍,用紫外可见分光光度计测量OD600。
菌体生物量=吸光值OD600×稀释倍数。
注:吸光值范围在0.2~0.8,超过量程后需换下一个稀释倍数。
1.3.9 pH在线检测
发酵罐自带的梅特勒pH在线检测,用pH试剂进行放液验证检测。培养基pH控制,可用梅特勒电导率仪精密检测。
1.3.10 计算方法
糖酸转化率(%)=发酵液中L-异亮氨酸质量浓度(g/L)×发酵液总体积(L)/总耗糖量(g)×100%。
每个实验数据分别取3个数的平均值,进行单因素方差分析。
2 结果与分析
2.1 生物素浓度对菌体浓度及产酸的影响

图1 生物素浓度对菌体浓度的影响Fig.1 Effect of biotin concentration on thallus concentration
对于L-异亮氨酸而言,较高生物素有利于菌体生长和L-异亮氨酸积累。生物素是磷酸烯醇式丙酮酸羧化酶的辅基,通过促进CO2的固定能把碳架流导向合成L-异亮氨酸的途径,但过高的生物素对产酸也会产生不利的效果。玉米浆中含有丰富的生物素及速效氮源,通过添加玉米浆控制生物素含量。在5 L发酵罐中,选择在发酵初期分别一次性添加10,20,30,40 g/L玉米浆(15,30,45,60 μg/L的生物素),通过多批次生物素浓度对比实验,在忽略初始接种种子浓度的情况下,生物素浓度越高,菌体生长越迅速。由图1可知,当生物素浓度处于低适量的情况下,生物素浓度的提高对菌体浓度的增长呈阶梯式增长,在生物素浓度为15,30,45 μg/L的5 L发酵罐中,菌体最高浓度OD600分别是101.5,108,124。而当生物素浓度提高到60 μg/L时,菌体量爆发式增长,最高OD600可达到368,高生物素的发酵环境下,菌体生长速度激增,可见生物素浓度对菌体的生长影响很大。
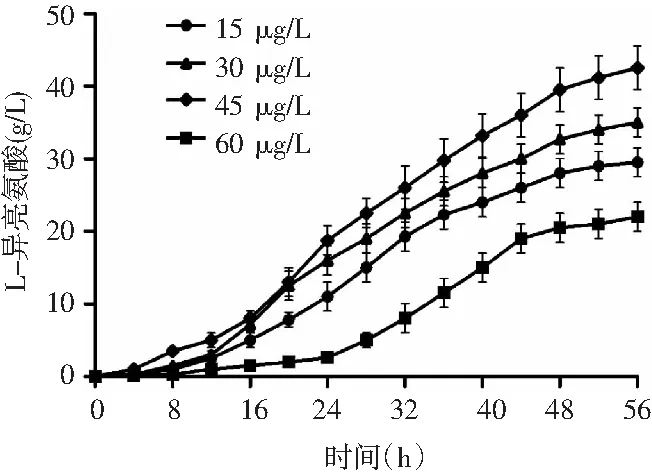
图2 生物素浓度对L-异亮氨酸产量的影响Fig.2 Effect of biotin concentration on L-isoleucine yield
低适量生物素浓度下,生物素浓度的增加与菌体浓度、异亮氨酸产量呈正相关。在15~45 μg/L的生物素浓度范围内,产酸量分别是29.5,35,42.5 g/L。在高浓度的生物素发酵液中,微生物的产酸量较低。由图2可知,当生物素浓度达到60 μg/L时,发酵产酸量为22 g/L。在第24 h才开始快速产酸,高速产酸期延后了8 h,同时菌体量的快速增长消耗了培养基中大部分的营养物质,再加上后期不利物质的积累,第42 h时,菌体提前进入衰退期,产酸进入停滞阶段。高浓度的生物素为细胞膜的生长提供了动力,在其他微生物所必需的营养物质都丰富的条件下,生物素浓度越高,微生物的生长情况越好,菌体量越高,但微生物细胞膜的完整性越好,细胞膜的通透性越低,异亮氨酸的分泌越困难,胞内终产物阻遏越强,对代谢途径中关键酶的反馈越强,抑制异亮氨酸的合成,最终导致胞外发酵液中异亮氨酸浓度较低。异亮氨酸作为必需氨基酸的一种,同样是微生物生长的必要成分,谷棒菌株在合成异亮氨酸的同时,同样从发酵液中吸收并利用异亮氨酸合成自身所需的物质。
2.2 生物素浓度对耗糖速率及糖酸转化率的影响

图3 生物素浓度对耗糖速率的影响Fig.3 Effect of biotin concentration on sugar consumption rate
谷氨酸棒杆菌发酵产L-异亮氨酸,葡萄糖为主要碳源,其消耗主要有两部分组成:一部分提供细胞生长与自身繁殖的能量与碳骨架,另一部分由细胞合成与分解成各种氨基酸、核苷酸、脂肪酸等中间代谢体。由图3可知,在10,20,30,40 g/L玉米浆(15,30,45,60 μg/L的生物素)的5 L发酵罐中,初始培养基中糖浓度都是80 g/L,随着发酵开始,微生物耗糖速率随生物素添加量的增加而加快,在18~24 h之间达到谷氨酸棒杆菌产酸的最佳糖浓度。谷氨酸棒杆菌的生长与产酸是非同步关系,在8 h以前微生物主要以自身生长与繁殖为主,随着微生物浓度的增加,耗糖速率缓慢增加;在发酵8 h左右,微生物进入分裂对数期,同时开始产酸,耗糖快速上升;当达到20 h后,细胞浓度达到最大值并保持稳定不变,产酸进入稳定期,耗糖速率基本保持稳定;40 h后,随着发酵液中营养物质的消耗和副产物的积累,发酵进入后期,微生物浓度和产酸量下降,耗糖速率降低。
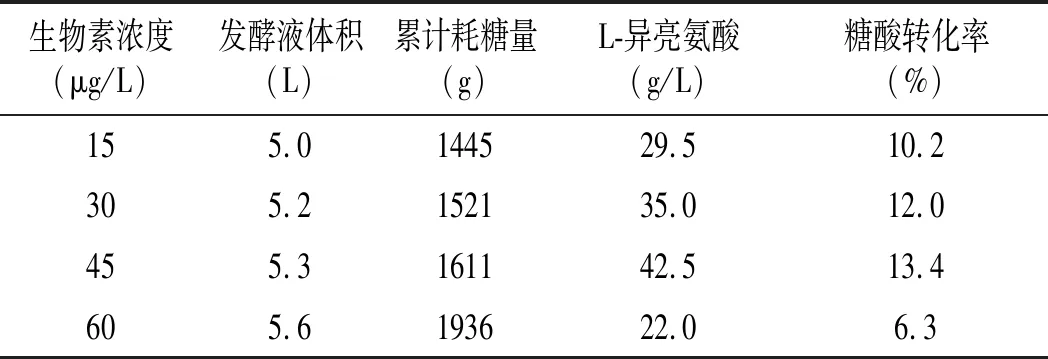
表1 不同生物素发酵参数对比Table 1 Comparison of fermentation parameters of different biotin
由表1可知,生物素的添加量影响微生物的菌体浓度和产酸量,在低适量下,生物素浓度越高,细胞生长越快,菌体量越高,产酸越快,耗糖速率越快,糖酸转化率越高;在高浓度生物素添加量下,随着生物素的增加,营养物质大部分用于微生物的生长,产酸期延后,产酸低,糖耗高,糖酸转化率底。
2.3 生物素浓度对副产物的影响
异亮氨酸合成流程图见图4。

图4 异亮氨酸合成流程图Fig.4 Flow chart of isoleucine synthesis
注:PC为磷酸烯醇式丙酮酸酶;AK为天冬氨酸激酶;HD为高丝氨酸脱氢酶;TD为苏氨酸脱水酶;AS为酰羟基酸合成酶;HT为高丝氨酸激酶。

图5 不同生物素浓度发酵对丙氨酸的影响Fig.5 Effects of fermentation with different biotin concentration on alanine
本实验使用的谷氨酸棒杆菌为赖氨酸、蛋氨酸缺陷菌株,从液相检测可以看出,副产物主要为丙氨酸。从代谢流分析得出,葡萄糖一部分经过EMP途径分解合成丙酮酸再合成丙氨酸,另一部分经过EMP途径合成磷酸烯醇式丙酮酸,再经过TCA循环合成天冬氨酸,再合成丙氨酸。在整个异亮氨酸合成途径中,合成天冬氨酸之前的所有途径相同,所以低适量生物素发酵过程中,随着生物素浓度的增加,异亮氨酸的合成增加,丙氨酸含量也随之增加。L-异亮氨酸的生产和丙氨酸的生成为协同增效。在高浓度生物素添加量发酵过程中,细胞膜完整,对氨基酸运出细胞膜也有一定的影响。由图5可知丙氨酸最高为9 g/L。
2.4 分批流加玉米浆对产酸的影响

图6 发酵间期补加玉米浆对菌体浓度的影响Fig.6 Effect of corn syrup supplementation on thallus concentration during fermentation

图7 发酵间期补加玉米浆对L-异亮氨酸的影响Fig.7 effect of corn syrup supplementation on L-isoleucine during fermentation
从上述分析可以得出,高浓度生物素添加量发酵不利于菌体产酸,对于这种情况,本实验通过分批流加生物素技术,在发酵期间补加生物素,解决了这个难题。分批式添加生物素,在总体玉米浆浓度50 g/L(生物素浓度75 μg/L)不变的情况下,在初始发酵培养基中添加20 g/L玉米浆(30 μg/L生物素),在发酵18,32,42 h分别补加10 g/L玉米浆(15 μg/L生物素)。由图6和图7可知,在发酵18 h以前,玉米浆中的速效氮源使菌体生长迅速,同时生物素浓度为30 μg/L,处于低适量生物素添加量,菌体转型时间点提前,转型时间由14~18 h提前到10~14 h,菌体转型快,产酸量高;到18 h以后,大部分菌体已经转型成功,细胞膜完整性差,转变成有利于异亮氨酸的积累和胞外分泌的新模式,底料生物素基本被消耗,此时添加少量玉米浆,补充生物素及速效氮源,细胞菌体量进一步增加,同时低适量生物素无法使细胞膜修复完整,细胞膜仍处于缺陷状态,而补加的速效氮源,有利于菌体生长和异亮氨酸分泌;32 h和42 h生物素再次被消耗完,此时添加玉米浆可保持菌体量浓度不变或下降速度变缓,延长产酸时间,提高转化率。产量达到了44.5 g/L,比初始生物素浓度为30 μg/L,后期不补料产酸量提高了49.8%。
异亮氨酸发酵的高效产酸关键在于控制发酵前中期谷氨酸棒杆菌细胞膜在结构和功能上的特异性转变[17],增强细胞膜的通透性,从而形成有利于异亮氨酸胞内积累与胞外分泌的新模式[18-21]。这就需要掌握异亮氨酸高产菌株的发酵特性以及该菌株特异型转变的周期与细胞转型的关键时间点。生物素小分子在参与羧化作用时,能够结合羧基,参与菌体内固定 CO2的羧化反应;作为乙酰CoA的辅酶,参与磷脂的合成和细胞膜的组成,最终影响目的产物的合成与分泌[22]。在发酵初期,罐内生物素对于菌体来说是过量的,在营养成分丰富的情况下,细胞进入快速生长分裂阶段。当发酵进入中期(18 h)后,罐内生物素对于菌体处于亚适量状态,菌体生长缓慢,细胞膜合成不足,封闭性减弱,通透性增加,细胞内外物质交换能力增强,有利于L-异亮氨酸分泌于胞外[23]。细胞内L-异亮氨酸浓度降低,解除终产物反馈抑制,细胞大量合成L-异亮氨酸。玉米浆在氨基酸发酵中为菌体提供氮源和生长因子,尤其是其中的生物素和限制性氨基酸的含量对发酵结果影响巨大[24]。本研究通过在培养基中添加不同浓度玉米浆的方式控制生物素的添加量,同时,玉米浆中丰富的氨基酸为菌体的转氨作用提供了原料,促进了异亮氨酸的合成。生物素的亚适量工艺目前已普遍应用于谷氨酸、缬氨酸、亮氨酸等各类氨基酸的发酵生产。
3 结论
本研究通过限制生物素浓度探究谷氨酸棒杆菌YILM 1504产L-异亮氨酸的最适生物素浓度。5 L发酵罐中,在发酵液中生物素处于低适量条件下,随着生物素浓度的增加,菌体浓度增加,耗糖速率加快,产酸量高,糖酸转化率高;经过多批次对比实验,得出最适生物素浓度为45 μg/L,此时产酸达到42.5 g/L,糖酸转化率达到最高,为13.4%;在高浓度生物素发酵液中,生物素的增加只会增加菌体浓度,不利于异亮氨酸发酵。为了解决了高浓度生物素发酵中后期菌体活力低而造成产酸低的问题,在发酵前期控制生物素浓度为30 μg/L,保持低适量生物素,有利于发酵前期细胞转型;中期在18 h向发酵液中添加10 g/L玉米浆(15 μg/L生物素),保持少量的生物素,有利于增加转型细胞浓度,提高产酸速率;后期在32,42 h继续补加玉米浆,维持细胞浓度,延长高速产酸时间,提高糖酸转化率,降低成本;54 h产酸量达到了44.5 g/L,比初始生物素浓度为30 μg/L,后期不补料产酸量提高了49.8%。
