牙鲆FEL1基因的表达及功能分析❋
2020-05-28李奥运王宣刚王欣桐王志刚于海洋
李奥运, 王宣刚, 王欣桐, 王志刚, 于海洋
(中国海洋大学海洋生命学院, 海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003)
母源性免疫(Maternal immunity)是指从母体到后代通过胎盘、初乳、乳汁或卵子传递的免疫能力,有利于增强后代抵抗致病性细菌的能力[1]。由于受精卵是一个封闭的微室,鱼卵在发育过程中,只能依赖于母体提供的免疫物质(包括免疫球蛋白、补体因子、溶菌酶、凝集素、蛋白酶抑制剂等)来抵抗病原体的入侵[2-3]。凝集素(Lectin)是先天免疫反应的可溶性碳水化合物结合效应蛋白,其与致病菌表面结构相互作用,导致调理作用、吞噬作用或补体活化的作用[4]。
最近研究发现,从细菌到脊椎动物的各个进化分支中,卵中的蛋白质均发现一种碳水化合物结合蛋白,可以凝集糖类化合物,因此将其命名为鱼卵凝集素[5]。目前在许多硬骨鱼中鉴定出来鱼卵凝集素,包括斑马鱼(Daniorerio)、鲤鱼(Cyprinuscarpio)、金鱼(Carassiusauratus)、条石鲷(Oplegnathusfasciatus)、柳叶鱼(Osmeruslanceolatus)、大马哈鱼(Oncorhynchusketa)、鲶鱼(Silurusasotus)和香鱼(Plecoglossusaltivelis)等[5-11]。研究发现斑马鱼FEL具有母源性表达,在未受精的卵中和胚胎的早期发育过程中均有表达,因此在鱼类的早期胚胎发育过程中,FEL基因可能在抵抗外来微生物的入侵中扮演重要角色,在仔稚鱼生长发育过程中起到抵抗致病菌感染的作用[1, 12-13]。在对FEL组织特异性分析中发现,斑马鱼的FEL基因在卵巢中表达量最高,在精巢和肝脏中的表达次之,而在其他组织中不表达或者微量表达;而条石鲷的组织定量分析显示,FEL基因主要在肝脏和头肾中表达量比较高,在其他组织中痕量表达,因此说明FEL基因具有组织表达特异性,而且不同的物种FEL基因的表达位置具有差异性。这为本研究牙鲆中FEL基因的表达模式提供了参考。
牙鲆是中国重要的养殖鱼种,在集约化养殖过程中病原菌的入侵造成了牙鲆大量死亡,对牙鲆养殖业构成严重威胁[14]。利用分子生物学技术对牙鲆免疫相关基因的功能进行研究,可以为抗病药物和免疫佐剂的开发研究提供理论依据,提高养殖效率和食品安全性。对于保证中国海水养殖业健康、稳定、持续的发展具有极其重要的意义。本文以牙鲆为研究对象,利用体外细菌和病毒类似物刺激牙鲆卵巢细胞系,检测牙鲆FEL1基因的时间依赖性表达模式;进行PoFEL1体外过表达实验,研究过表达PoFEL1对免疫相关细胞因子的影响;亚细胞定位分析,探讨PoFEL1在细胞中的表达位置;双荧光报告分析,检测PoFEL1对NF-κB信号通路的影响。这为探究PoFEL1在牙鲆抵抗病原菌入侵时发挥的免疫应答机制提供理论基础,同时初步探索了PoFEL1在牙鲆胚胎早期发育阶段的母源性表达作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 本实验所用的牙鲆为1.5龄鱼,研究中用到的牙鲆以及胚胎样品均取自山东黄海水产有限公司。取回的牙鲆先放在中国海洋大学海洋生命学院鱼房暂养半个月,控制水温,每日投喂饲料3次,每24 h更换40%新鲜海水。本次实验研究中,所用实验材料均按照中国海洋大学动物管理与使用委员会(OUC-IACUC)相关规定进行处理使用。
1.1.2 模板来源 胚胎发育时期所需要的模板是人为体外受精的牙鲆受精卵。取样地点在山东黄海水产有限公司。
1.1.3 细胞系来源 用于免疫刺激的牙鲆卵巢细胞系及HEK-293T细胞系来源于中国海洋大学细胞工程技术实验室。
1.2 实验方法
1.2.1PoFEL1核心片段序列的获得首先在本实验室的基因组和转录组数据库中,通过同源比对找到牙鲆FEL基因序列,将其与NCBI数据库中的牙鲆FEL基因比较,确定FEL基因序列,随后设计引物,对其进行克隆验证(见表1)。
1.2.2PoFEL1序列分析 用DNAMAN程序进行氨基酸与核苷酸序列分析;利用SMART(http://smart.embl-heidelberg.de)和Signalp 4.1 Server(http://www.cbs.dtu.dk/services/SignalP-4.1/)分析PoFEL1的同源保守功能域和信号肽有无;使用MrBayes软件,利用最大似然法构建进化树分析基因在进化过程中的物种亲缘关系,实验中所用到的基因序列见表2。

表1 本研究所用引物序列
注:限制性核酸内切酶用下划线标出。The restriction enzyme sites are underlined.

表2 本实验中所用到的FEL序列
1.2.3PoFEL1组织表达分析 取6尾牙鲆个体(3雌3雄,1.5龄),用尾静脉抽血法处死,解剖分别取精巢、卵巢、心脏、肝脏、脾脏、肾脏、脑、鳃、肌肉和肠10个组织,提取RNA,制备定量模板。
1.2.4PoFEL1胚胎发育模式表达分析 对不同发育时期的牙鲆胚胎进行了取样,取样时间点分别是:2细胞期(2 cell)、32细胞期(32 cells)、高囊胚(High blastula)、原肠晚期(Late gastrula)、神经胚(Neurula)、尾芽期(Tail bud)、出膜期(Hatching)8个时期,液氮冻存后放到-80 ℃冰箱,备用。
1.2.5 牙鲆p-EGFP-FEL1质粒构建 在PoFEL1ORF的两端,分别设计带酶切位点XhoⅠ和SacⅡ的引物序列,构建质粒并测序验证。将序列正确的质粒及空载质粒p-EGFP-N1用限制性内切酶XhoⅠ和SacⅡ进行双酶切,琼脂糖凝胶电泳检测并回收。随后将带有酶切位点的PoFEL1序列用T4连接酶连接到p-EGFP-N1载体上,并进行测序验证,最终得到p-EGFP-FEL1过表达质粒。
1.2.6 体外细胞刺激实验 将牙鲆的孵巢细胞系接种到24孔板中,在24 ℃的恒温培养箱中培养,使细胞覆盖度达到70%~90%。随后细胞换上DMEM/F12培养基(含有血清和双抗),加入lipopolysaccharide (LPS)、peptidoglycan(PGN)、Polyinosinic: polycytidylic acid (Poly I∶C, Sigma)和迟缓爱德华氏菌菌液,其中迟缓爱德华氏菌的终浓度是6×106CFU/mL,而LPS、PGN、Poly(I∶C)的终浓度是50 μg/mL,同时加入等体积的PBS作为对照组。将处理的细胞样品放在24 ℃恒温培养箱中培养,因为迟缓爱德华氏菌是一种细菌,具有传染性,因此加入迟缓爱德华氏菌的实验组需要单独培养(培养条件不变)。随后分别在0、1、2、4、12、24 h时收集细胞,加Trizol试剂并将其冻存在-80 ℃冰箱,待用。
1.2.7PoFEL1过表达实验 将生长状态良好的牙鲆卵巢细胞系接种到3个12孔板中,将其在24 ℃恒温培养箱中培养18~24 h。将12孔板中的培养基弃掉,用处理过的PBS清洗数次,加入DMEM/F12培养基(无血清和双抗)根据LipofectamineTM3000进行p-EGFP-FEL1质粒转染,同时转染p-EGFP-N1质粒作用对照,随后采用温度梯度过度的方法:30 ℃,2 h;27 ℃,2 h;24 ℃,至实验结束。转染48 h以后,其中1个12孔板,收集细胞,提RNA,制备模板。一个12孔板,将其用LPS刺激,每孔加入50 μg/mL的LPS,24 h后,收集细胞,提RNA,制备模板。剩余一个12孔板转染48 h之后,用处理过的PBS清洗数次;加入4%PFA室温放置10 min,随后用处理过的PBS清洗数次。然后在每一个孔中滴入DAPI染液,使其完全覆盖细胞,室温放置10 min,随后用处理过的PBS清洗数次,每孔中加入少量的PBS,在共聚焦显微镜下拍照观察。
1.2.8 pRL-TK质粒、NF-κB荧光素酶质粒与重组质粒共转染293T细胞
(1) 转染方法:瞬时转染根据LipofectamineTM3000实验操作说明书进行。293T细胞按常规方法贴壁培养并将其传代于24孔板中,过夜培养12 h。将24孔板中的培养基弃掉,PBS洗涤数次,每孔加入500 μL无抗生素、无血清的培养基,分为实验组和对照组每孔加入1 μL质粒,加入p-EGFP-N1质粒、p-EGFP-FEL1、质粒pRL-TK(海肾质粒),6 h后更换新鲜培养基(含双抗、血清)。转染24~48 h后荧光显微镜下观察以判断转染效率。48 h后进行Luciferse检测,每组设置6个平行,重复至少3次实验。
(2)在HEK293T细胞转染p-EGFP-FEL1质粒;48 h后,用移液器吸走24孔板中的培养基,用PBS清洗数次,将其在超净工作台中静置30 s。每孔加入100 μL 1×PLB,室温下缓慢摇动20~30 min,收集到EP管中;将其在超速离心机中,5 000 r/min 离心2 min,吸取20 μL上清液转移至新的EP管中;向其中加入100 μL ARII,吹吸混匀,在机器中检测萤火虫荧光素酶活性,其结果记作a;随后向其中加入100 μL Stop&Glo试剂,吹吸混匀,在机器中检测海肾荧光素酶活性,其结果记作b;统计结果a/b。
1.2.9 实时荧光定量(qRT-PCR) 使用primer 5 软件设计用于定量的各基因引物序列,其中β-actin作为内参序列。反应体系:荧光染料,10 μL;定量引物(正向/反向),0.4/0.4 μL;模板,1 μL;ddH2O,8.2 μL。反应程序:95 ℃,15 min;95 ℃,10 s,60 ℃,20 s,72 ℃,60 s,共40个循环。每个待测样品设置3个重复实验,用来降低实验操作误差。(本实验样本Ct值均小于35,符合qPCR实验要求)
1.2.10 数据处理 利用Graphpad Primier 5绘制柱状图,基因的相对表达量用2-ΔΔCT的算法分析计算,使用SPSS20.0(IBM,New York,US)统计软件对不同组实验结果之间进行单因素相关性分析ANOVA来证明不同组的实验结果之间的显著性差异。其中P<0.05认为差异显著则用星号*表示,P<0.01认为差异极显著则用星号**表示。实验数据以平均值±标准差(mean±SD)表示。每组实验都会进行3次重复。
2 实验结果
2.1 PoFEL1序列分析
2.1.1PoFEL1的ORF序列扩增 以牙鲆卵巢组织为模板,扩增得到PoFEL1基因的ORF序列,将其与NCBI数据库中的牙鲆FEL序列比对,结果完全一致。其中PoFEL1的开放阅读框(ORF)长675 bp,编码224个氨基酸,蛋白分子量预测为24.8 kDa,理论等电点为9.88,在线软件预测未发现信号肽序列。通过5’RACE和3’RACE测序得到牙鲆FEL1基因的5’UTR 316 bp,3’UTR 175 bp(见图1)。通过SMART软件预测显示,PoFEL1具有5个保守的TECPR结构域(见图2)。

图 1 PoFEL1基因的核苷酸序列与氨基酸序列对应图
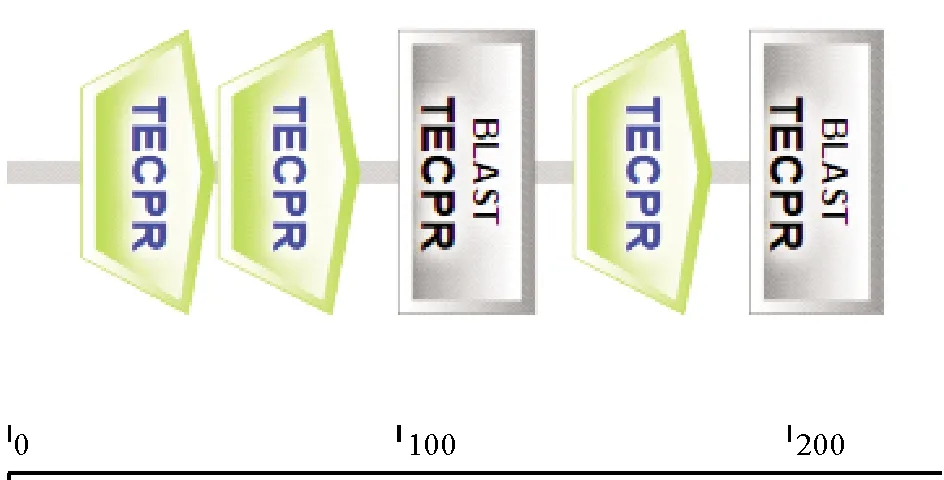
图2 FEL1蛋白结构域预测
2.1.2PoFEL1的系统进化分析 为了探究PoFEL1在动物进化过程中的地位,利用Bayes法构建了从哺乳动物、爬行动物和硬骨鱼类的FEL组成的系统进化树(见图3)。研究发现鱼卵凝集素可以聚为2类,其中哺乳动物和爬行动物与斑马鱼聚为一支,而牙鲆与大西洋鲑鱼、虹鳟鱼、大黄鱼、尼罗罗非鱼、孔雀鱼和非洲青鳉聚为一支,因此他们之间的同源性较高。有意思的是,在牙鲆中研究发现了两种FEL基因,分别是PoFEL1和PoFEL2。本文主要研究PoFEL1的母源性表达以及在牙鲆的先天性免疫中发挥的作用。
2.2 PoFEL1的组织表达分析
为了研究PoFEL1基因在牙鲆不同组织的表达模式,选用牙鲆的10个组织(心脏、肝脏、脾脏、肾脏、脑、鳃,、肌肉、小肠、精巢、卵巢),用β-actin作为内参引物,通过qRT-PCR检测PoFEL1基因在各组织中的表达水平。定量结果显示,PoFEL1基因在各个组织中都有不同程度的表达,但是表达具有差异,从图4可以看出来PoFEL1基因具有显著的组织特异性,在卵巢中表达量最高,是表达量最低的组织(脾脏)的300倍,在肠和肝脏中表达量次之,其余组织中呈现痕量表达的现象。因此,PoFEL1基因在各组织中的表达具有明显的组织特异性。
2.3 PoFEL1的发育表达模式分析
为了研究PoFEL1基因在早期胚胎发育过程中表达模式,对不同发育时期的PoFEL1基因进行qRT-PCR分析。结果显示(见图4B),PoFEL1在牙鲆胚胎发育的8个时期:4细胞时期(4 cell)、16细胞时期(16 cells)、32细胞时期(32 cells )、高囊胚(high blastula)、原肠早期(Early gastrula)、原肠晚期(Late gastrula)、神经胚(neurula)、出膜期(hatching)均有表达(见图4B),在胚胎发育的早期表达量比较高,随着胚胎发育的发生,表达量逐渐降低,提示其可能具有母源性表达的特点。
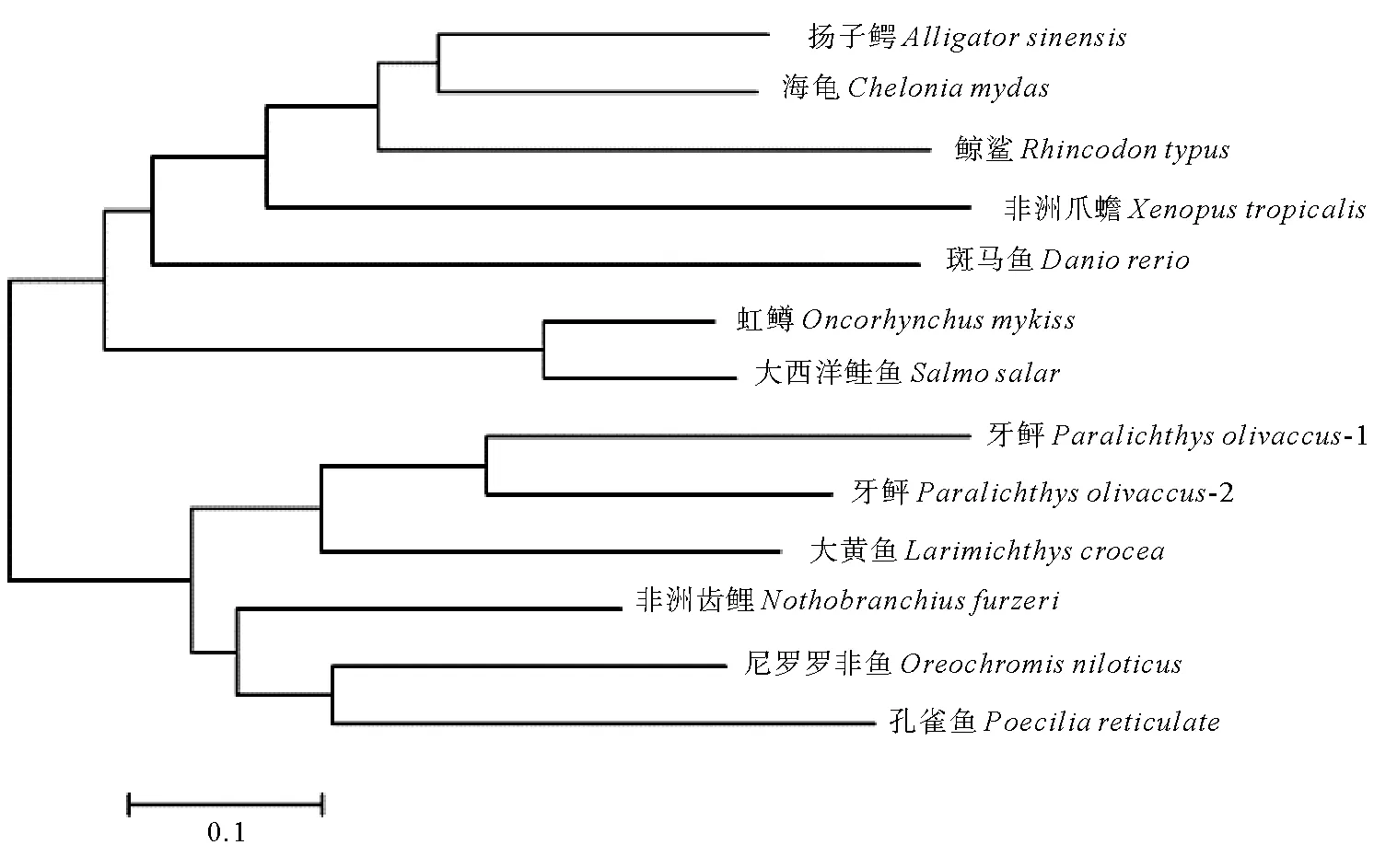
图3 基于牙鲆与其他硬骨鱼类和哺乳动物类FEL氨基酸序列构建的系统发育树

(A:牙鲆组织中PoFEL1基因的相对表达水平。β-actin作为内参基因。B:不同胚胎发育阶段中FEL1的相对表达水平。内参基因同上。A:Relative expression levels ofPoFEL1in various tissues. β-actin was used as internal control. B:Relative expression levels ofPoFEL1in different embryonic and larval stages. β-actin was used as internal control.)
图4 牙鲆FEL1基因在各个组织和不同发育阶段的表达模式
Fig.4 Expression pattern ofFEL1gene in various tissues and different developmental stages
2.4 免疫刺激牙鲆卵巢细胞系后PoFEL1的mRNA表达水平分析
因为PoFEL1在卵巢中的表达量比较高,为了进一步探讨PoFEL1在牙鲆免疫方面发挥的作用,本研究设计牙鲆体外刺激实验。分别用LPS,PGN,poly(I∶C),以及E.tarda(迟缓爱德华氏菌)刺激牙鲆卵巢细胞系,然后分别在0、1、2、4、12、24 h取样,提RNA,制备定量模板,对PoFEL1基因进行RT-PCR分析,其中PBS为对照组。结果如图5所示,不同刺激物刺激牙鲆卵巢细胞系均能使PoFEL1的表达上调。
LPS刺激时,PoFEL1的表达量呈现波动性变化模式,整体呈现出先上升又下降再上升的变化趋势,其中在2 h达到峰值,是0 h的7.6倍(见图5A)。在24 h同样达到峰值,表达量是0 h的6.5倍。PGN刺激时,FEL1表达同样呈现波动性的变化,在2 h时,达到一个峰值,是0 h时的7.1倍,随后下降,并在24 h时,再次达到峰值,是0 h的7.2倍(见图5B)。在Poly(I∶C)刺激时,1~4 h,呈现出逐渐下降的趋势,在4~24 h,呈现出缓慢上升的趋势,其中4 h时,无显著性差异,24 h时达到峰值,此时是0 h的10.7倍(见图5C)。迟缓爱德华氏菌刺激时,FEL1基因的表达出现一个波动性的变化,其中在0~1 h,表达量迅速上升,在1~12 h时,表达量有一个缓慢下降的过程,12~24 h时,表达量急剧增加,并在24 h处达到峰值,是0 h的9.9倍(见图5D)。综上PoFEL1的表达整体呈现出先上升又下降再上升的趋势。


图5PoFEL1在免疫刺激牙鲆卵巢细胞中的表达模式
Fig.5 Time-dependent mRNA expression profiles ofPoFEL1in Ovarian cell line after stimulation
2.5 过表达PoFEL1对p38,IL-6,TNF-α等细胞因子的调节作用
为了探索PoFEL1在牙鲆机体免疫途径中的功能,将p-EGFP-FEL1重组载体和p-EGFP-N1空载体分别转染牙鲆卵巢细胞系。转染成功后,对卵巢细胞系中的p38,IL-6,TNF-α等细胞因子进行RT-PCR分析。如图6所示,过表达PoFEL1,各个细胞因子的表达量均有升高。RT-PCR分析显示,过表达PoFEL1后,其表达量相对对照组显著提高(见图6A),表达量提高了427倍。细胞因子的表达量呈显著上调趋势(见图6B),其中P38相对于空白对照组上调了8.9倍,相比N1组上调2.3倍。过表达FEL1以后,IL-6的表达量相对于空白对照组和N1组均上调16倍左右。TNF-α也被激活,其表达量相对于空白对照组上调16.3倍,相对于N1组上调5倍左右。
2.6 PoFEL1的亚细胞定位
FEL1蛋白是一种凝集素类蛋白,且氨基酸序列分析显示PoFEL1编码的蛋白没有信号肽,为了探究PoFEL1的表达位置,在牙鲆卵巢细胞中转染了p-EGFP-N1和p-EGFP-FEL1两种质粒。如图7所示,牙鲆FEL1蛋白主要在细胞质中表达。


图6PoFEL1过表达对LPS刺激的牙鲆卵巢细胞中促炎细胞因子的表达变化
Fig.6 The mRNA expression profiles of pro-inflammatory cytokines in LPS-stimulated Ovarian cell line after over-expressedFEL1
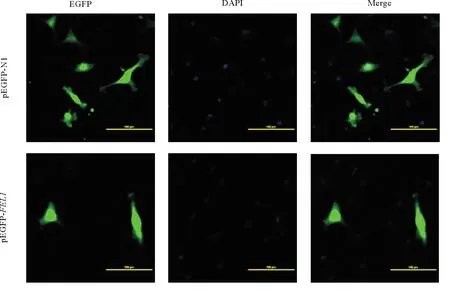
(用p-EGFP-N1转染的细胞用作阴性对照。Cells transfected with p-EGFP-N1 were used as negative controls.)
2.7 过表达PoFEL1对NF-κB的影响
为了探索PoFEL1是否可以激活NF-κB信号通路,使用HEK293T细胞在实验组细胞中转染pRL-TK质粒、NF-κB荧光素酶质粒和p-EGFP-FEL1重组质粒;同时对照组细胞中转染pRL-TK质粒、NF-κB荧光素酶质粒和p-EGFP-N1质粒。随后进行qRT-PCR分析。数据处理之后发现转染p-EGFP-FEL1重组质粒的荧光强度与对照组相比极显著升高(见图8)。
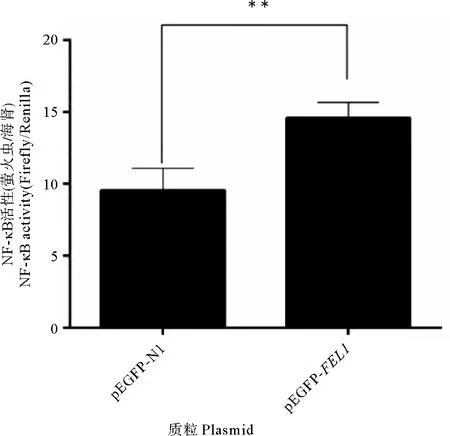

图8 在HEK-293T细胞中可以通过FEL1激活NF-κB途径
Fig.8 The NF-κB pathway can be activated byFEL1in HEK 293T cells
3 讨论
近年来,越来越多的鱼卵凝集素从鱼的卵细胞中被分离得到,蛋白结构域分析显示,鱼卵凝集素(FEL)是一种凝集素蛋白,属于凝集素超家族[5]。本研究中,通过PCR以及5’RACE和3’RACE技术获得牙鲆FEL1基因全长序列。蛋白结构分析显示,FEL1基因编码的蛋白含有5个TECPR结构域。将牙鲆的FEL1氨基酸序列与大西洋鲑鱼、条石鲷的FEL氨基酸序列对比后发现,它们均含有6个高度保守的半胱氨酸残基(Cys),在蛋白加工过程中,6个半胱氨酸残基两两配对形成二硫键,从而保证了FEL1蛋白功能的正常发挥。研究表明,二硫键在蛋白质的重折叠、建立以及维持蛋白质的三维结构中起到关键性的作用[15]。进化分析显示,牙鲆与大西洋鲑鱼、虹鳟鱼、大黄鱼、尼罗罗非鱼、孔雀鱼和非洲青鳉氨基酸序列的同源性较高,而与哺乳动物、爬行动物以及斑马鱼的氨基酸序列同源性较低。
已有的研究表明,鱼卵凝集素主要在免疫器官以及性腺组织中具有高表达。同时在斑马鱼(Daniorerio)的研究中,FEL基因在卵巢和精巢中表达量最高,在胚胎发育阶段早期表达量也较高,这与本研究在牙鲆中的发现类似,该现象暗示牙鲆与斑马鱼的FEL基因可能都具有母源性表达的特点,在功能上存在共性。在条石鲷 (Oplegnathusfasciatus)中[5],FEL基因在肝脏和头肾中表达量最高,而PoFEL1同样具有在肝脏中表达量高的特点,这一现象表明在这两种硬骨鱼中FEL基因可能具有免疫作用。上述现象说明,PoFEL1在牙鲆中具有母源性表达的特点,同时在其先天免疫中发挥作用,因此本研究推测其在牙鲆胚胎发育过程中可能起到抵抗病原感染的作用。
脂多糖(LPS)是革兰氏阴性菌细胞壁的重要组成成分,能刺激动物使之产生免疫应答反应[16];肽聚糖(PGN)存在于大部分革兰氏阳性菌和部分革兰氏阴性菌的细胞壁中[17],可引起动物机体免疫反应,因此LPS与PGN常作为一种细菌类似物应用于免疫学研究。聚肌胞苷酸(Polyinosinic-polycytidylic acid,Poly(I∶C)),是由肌苷酸和胞苷酸聚合的双链RNA,能够诱导动物细胞产生干扰素,并通过干扰素活化来行使免疫细胞的功能,将其作为病毒类似物应用于免疫学研究[18]。在条石鲷的研究中,作者用迟缓爱德华氏菌、海豚链球菌和真鲷虹彩病毒感染条石鲷,结果显示FEL基因的表达量显著增加,说明FEL基因在条石鲷抵抗病原微生物的入侵和真菌病毒的入侵方面发挥免疫应答功能[5]。PoFEL1在卵巢细胞中的转录水平能够被LPS、PGN、Poly(I∶C)以及迟缓爱德华氏菌影响,其mRNA的表达水平在免疫刺激后均呈现先上升后下降再上升的趋势,这说明牙鲆FEL1基因在卵巢细胞免疫刺激过程中具有应激效应,同时在牙鲆卵巢细胞的抗菌免疫过程中起到一定作用。本研究通过牙鲆卵巢细胞系进行体外刺激实验,证明LPS、PGN、Poly(I∶C)以及迟缓爱德华氏菌均能引起牙鲆FEL1基因的表达上调,且它们的变化趋势一致,均呈现先升高后下降再升高的变化。总之,细菌、病毒类似物等均能上调PoFEL1的表达,进一步说明了牙鲆FEL1基因在细胞抵抗细菌入侵时发挥一定的作用。
P38能被促炎因子或细菌病原体磷酸化激活,由细胞质进入细胞核内,活化转录因子,从而调节基因表达,参与细胞的免疫应答反应[19]。白细胞介素-6(IL-6)是一种与炎症反应密切相关的细胞炎症因子,在细胞的增殖、分化、凋亡以及免疫反应调节等许多重要的生物学过程中发挥显著的作用[20]。通过研究发现过表达PoFEL1能导致卵巢细胞中TNF-α、p38以及IL-6基因的表达上调,说明过表达PoFEL1能够促进TNF-α、p38以及IL-6的表达,进而激活细胞内的免疫调节功能。在草鱼的甘露糖结合凝集素(MBL)研究中,研究者利用双荧光素酶报告载体探究MBL是否可以激活NF-κB信号通路,实验结果表明过表达MBL能激活NF-κB信号通路[21]。本研究同样发现过表达PoFEL1可以显著增强NF-κB信号,进而激活NF-κB信号通路,从而对细菌入侵产生免疫应答反应,这一过程可能需要多条途径共同参与完成。另外,实验结果证明过表达PoFEL1能导致卵巢细胞中TNF-α、p38以及IL-6基因的表达上调,而TNF-α可以促进T细胞产生各种炎症因子,进而促进炎症反应的发生,从而激活NF-κB信号通路。因此,推测在牙鲆的免疫系统中可能存在一些途径,可以使PoFEL1能间接激活NF-κB信号通路对病原菌入侵产生免疫应答。
本研究克隆了牙鲆PoFEL1基因的全长序列,并分析组织表达模式以及胚胎发育时期表达模式,结果说明PoFEL1具有母源性表达,然而其具体作用机理有待进一步研究。体外细胞刺激实验及过表达实验表明PoFEL1在细胞中发挥抗菌免疫作用,双荧光报告载体实验表明过表达PoFEL1能促进TNF-α的表达,进而激活NF-κB信号通路,对细菌的入侵起到免疫应答的作用。综上所述,PoFEL1在牙鲆的先天免疫中起到重要的作用,本研究为牙鲆母源性免疫的研究奠定一定的基础,为牙鲆的抗病育种提供参考依据。
