IL-33、肿瘤微血管密度及淋巴管密度在非小细胞肺癌中的表达及对预后的影响
2020-05-25陈艺张腾龙杨哲陈玲田金王洁郭成业
陈艺?张腾龙?杨哲?陈玲?田金?王洁?郭成业

【摘要】目的 研究IL-33在非小細胞肺癌(NSCLC)患者肿瘤组织和癌旁组织的表达差异,分析IL-33与肿瘤间质中微血管密度(MVD)、淋巴管密度(LVD)的关系,探讨其与NSCLC患者预后的相关性。方法 收集125例NSCLC患者的临床资料及病理标本,通过免疫组织化学染色(免疫组化)检测患者肿瘤组织及癌旁组织中IL-33、MVD、LVD的表达情况,分析癌旁组织中低表达与高表达IL-33者的临床病毒特征,随访患者生存状况,采用Cox回归分析NSCLC患者总生存期(OS)及无进展生存期(PFS)的关系。结果 NSCLC患者癌旁组织中IL-33免疫组化评分高于肿瘤组织(P < 0.001)。癌旁组织中的MVD和LVD均高于肿瘤组织(P均< 0.001)。与低表达IL-33者相比,NSCLC患者癌旁组织高表达IL-33者中低分化者、淋巴结转移、临床分期高者比例较高(P均< 0.05)。癌旁组织内IL-33表达强度与MVD有关(P < 0.05),与LVD无关(P > 0.05)。多因素Cox回归分析显示,IL-33、淋巴结转移状态、临床T分期与OS有关;淋巴结转移、临床T分期与PFS有关(P均< 0.05)。 IL-33高表达及淋巴结有转移患者的OS及PFS均低于IL-33低表达及淋巴结无转移患者(P均 < 0.05)。结论 NSCLC患者癌旁组织IL-33的高表达与肿瘤微血管生成及NSCLC患者的不良预后有关。IL-33高表达、淋巴结转移、肿瘤临床分期晚是NSCLC患者OS的危险因素。淋巴结转移、肿瘤临床分期晚是患者PFS预后不良的危险因素。
【关键词】非小细胞肺癌;白介素-33;微血管密度;淋巴管密度;预后
Effect of expression of interleukin-33, tumor microvascular density and lymphatic vessel density on clinical prognosis of patients with non-small cell lung cancer Chen Yi, Zhang Tenglong, Yang Zhe, Chen Ling, Tian Jin, Wang Jie, Guo Chengye. Qingdao University, Qingdao 266011, China
Corresponding author, Guo Chengye, E-mail: chengye_guo@ 126. com
【Abstract】Objective To compare the interleukin-33 (IL-33)expression between cancer and adjacent tissues in patients diagnosed with non-small cell lung cancer (NSCLC), analyze the relationship between IL-33, tumor microvascular density (MVD) and lymphatic vessel density (LVD) and investigate the correlation with clinical prognosis. Methods Clinical and pathological data of 125 NSCLC patients were collected. The expression level of IL-33, MVD and LVD in the tumor and adjacent tissues were detected by immunohistochemical staining. Clinical characteristics of patients with low- and high-expression levels of IL-33 in the adjacent tissues were analyzed. The survival status of these patients was followed up. The relationship between these parameters, and overall survival (OS) and progression-free survival (PFS) was investigated by Coxs regression analysis. Results Immunohistochemical staining showed that the expression of IL-33 in the adjacent tissues of NSCLC patients was significantly higher than that in the tumor tissues (P < 0.001). The MVD and LVD in the adjacent tissues were significantly higher compared with those in the cancerous tissues (both P < 0.001). The proportion of low/moderate-grade tumor differentiation, lymph node metastasis and advanced clinical T staging in NSCLC patients with high-expression of IL-33 in the adjacent tissues was significantly higher compared with that of their counterparts with low-expression of IL-33 (all P < 0.05). The expression of IL-33 in the adjacent tissues was significantly correlated with MVD (P < 0.05) rather than LVD (P > 0.05). Multivariate Coxs regression analysis revealed that IL-33, lymph node metastasis status and clinical T staging were significantly correlated with OS, and lymph node metastasis status and clinical T staging were significantly correlated with PFS (all P < 0.05). The OS and PFS of patients with high-expression of IL-33 and lymph node metastasis were significantly worse than those with low-expression of IL-33 and no lymph node metastasis (both P < 0.05). Conclusions High expression levels of IL-33 and the formation of MVD in the adjacent tissues are associated with poor prognosis of NSCLC patients. High expression levels of IL-33, lymph node metastasis and advanced clinical T staging are the independent risk factors of OS of NSCLC patients. Lymph node metastasis and advanced clinical T staging are the independent risk factors of PFS of NSCLC patients.
【Key words】Non-small cell lung cancer;IL-33;Microvascular density;Lymphatic vessel density;
Prognosis
肺癌是全球恶性肿瘤患者的主要死亡原因之一,其中非小细胞肺癌(NSCLC)约占所有肺癌的85%[1-2]。目前对肺癌的研究已经扩展到了肿瘤的非癌细胞成分,包括组成肿瘤微环境的细胞外基质[3]。多项研究显示,IL-33是肿瘤进展、转移的重要影响因素。IL-33是IL-1超级家族的一员,由Baekkevold等(2003年)发现高表达于内皮细胞的细胞核,所以也称为“高内皮细胞来源的核因子”。早期研究表明,IL-33主要通过与生长刺激表达基因2(ST2)相互作用诱导辅助性T淋巴细胞2(Th2)型免疫应答的产生,与之相关的疾病研究主要包括哮喘、类风湿关节炎以及炎症性肠病
等[4-6]。ST2是IL-33的相关受体,表达于多种免疫细胞,包括Th2、自然杀伤细胞(NK)、自然杀伤T淋巴细胞(NKT)、肥大和树突状细胞等[7]。IL-33既可以作为细胞内的核因子,也可以作为传统的细胞因子分泌到细胞外[8]。它通常从受损的免疫细胞中释放出来,以自分泌和旁分泌的方式,发挥“警报素”的功能,在2型先天性免疫中扮演重要的角色,是细胞损伤或细胞受压的危险信号。最近越来越多的研究表明IL-33在致癌过程中有促进作用。肿瘤的转移和扩散是导致恶性肿瘤患者死亡的主要原因之一,肿瘤一般是通过直接浸润、淋巴结转移和血行播散扩散。其中淋巴结转移和血行播散主要依靠微血管生成来提供丰富的血供以及营养因子作为基础,因此可以大胆预测,肿瘤间质中微血管密度(MVD)、淋巴管密度(LVD)的表达可能是升高的。据此,探究肿瘤间质中MVD、LVD的表达情况对于预测肿瘤患者预后有重要的意义。本研究通过检测NSCLC肿瘤组织间质中IL-33、MVD、LVD的表达并分析其与患者预后的关系,期望为NSCLC的诊断和治疗开辟新的途径。
对象与方法
一、研究对象
本研究所选取的125例NSCLC患者,均为2013年6月至2014年6月在青岛市市立医院胸外科接受肺癌切除术,术前未行任何抗肿瘤治疗,术中切除组织经病理活组织检查(活检)确诊为NSCLC。其中男88例、女37例,年龄44 ~ 77岁;组织学类型为鳞癌56例、腺癌54例、腺鳞癌15例;美国抗癌联合会(AJCC)第7版TNM分期T1 58例、T2 29例、T3 38例;淋巴结阳性67例,淋巴结阴性58例;高分化62例,低分化63例。患者均处于随访状态,随访时间截至2018年6月30日。每例均同时取肿瘤组织和手术切缘处癌旁组织(距离肿块 2~3 cm),标记取部分用40 g/L多聚甲醛固定后用于免疫组织化学(免疫组化)行过氧化物酶连接(SP)法检测。本研究经青岛市市立医院医学伦理委员会批准,患者均签署知情同意书。
二、检测方法
1. 肺癌组织及癌旁组织中IL-33的表达检测
采用免疫组化检测。取待测组织以石蜡包埋, 常规切片,厚度4 μm。65℃ 烤片2 h,二甲苯脱蜡,梯度乙醇水化,3%双氧水中封闭内源性过氧化物酶,柠檬酸缓冲液高压修复抗原,山羊抗人血清封闭,加小鼠抗人IL-33单克隆抗体(1∶200,购自美国R&D Systems),4℃孵育过夜;洗涤后加辣根过氧化物酶(HRP)标记的山羊抗小鼠二抗(1∶100,购自美国R&D Systems),室温孵育30 min;洗涤后,二氨联苯胺(DAB)显色、苏木素复染及梯度乙醇脱水干燥、封片,分别在光学显微镜下观察IL-33蛋白表达强度、MVD、LVD。以一抗替换为磷酸盐缓冲液作阴性对照。
2. 结果判断
2.1 IL-33蛋白
所有的染色切片都由2位资深病理学家独立评估。计数过程由2位病理科医师,采取双盲法对组织切片计数,分别取100、200、400倍视野观察染色标本。如2位医师计数后分组结果不一致时,由第3位病理科主任医师重新计数并分组。以细胞间质见黄色至棕黄色为阳性信号。IL-33免疫组化染色强度和所占细胞总数百分比的评估:随机选择10个视野(200倍),阳性细胞比例< 5%评0分、阳性细胞比例6% ~ 25%评1分、阳性细胞比例26% ~ 50%评2分、阳性细胞比例51% ~ 75%评3分、阳性细胞比例> 75%评4分;细胞质和细胞核染色强度阴性评0分、弱阳性评1分、中度阳性评2分、强阳性评3分。总得分由所占细胞总数百分比和强度得分之和,总分0~1分表示为(-)、2 ~ 4分表示为(+)、5 ~ 7分评为
(++) [9]。取10个区域的平均值,然后进行统计学分析。其中(++)定义为高表达组,(-)或(+)定义为低表达组。
2.2 MVD
MVD的判定参照Weidner法,镜下观察微血管呈棕色(CD34阳性)的单个或成簇细胞,低倍镜(100倍)下选取5个血管密度最高的视野,并于中倍镜(200倍)下人工计数每个视野微血管数,取平均值表示MVD[10]。高值组和低值组以平均值为界限划分。
2.3 LVD
LVD的判定参照Schoppmann法,镜下观察微淋巴管呈棕黄色(D2-40阳性)单个或成簇内皮细胞,低倍镜(100倍)下选取5个包含微淋巴管的视野(包含肌层不予计算),并于中倍镜(200倍)下人工计数每个视野微淋巴管数,取平均值表示LVD[11]。高值组和低值组以平均值为界限划分。
三、统计学处理
应用SPSS 20.0进行统计学分析。计数资料以例(%)表示,组间比较采用χ2检验,IL-33在肿瘤组织和癌旁组织的表达比较采用配对t检验。IL-33表达与MVD和LVD的关系采用关联分析。采用Kaplan-Meier法绘制NSCLC患者生存曲线,IL-33表达及淋巴结转移与NSCLC患者总生存期(OS)和无进展生存期(PFS)的关系采用log-rank 检验。采用进入法进行多因素Cox回归分析。P < 0.05为差异有统计学意義。
结果
一、NSCLC患者癌旁组织与肿瘤组织中IL-33蛋白免疫组化评分、MVD及LVD的比较
1. NSCLC患者癌旁组织与肿瘤组织中IL-33蛋白免疫组化评分的比较
IL-33在NSCLC患者癌旁组织中免疫组化评分为(5.90±0.23)分,高于肿瘤组织的(1.50± 0.17)分(t = 16.500,P < 0.001),见图1。
2. NSCLC患者癌旁组织与肿瘤组织中MVD和LVD的比较
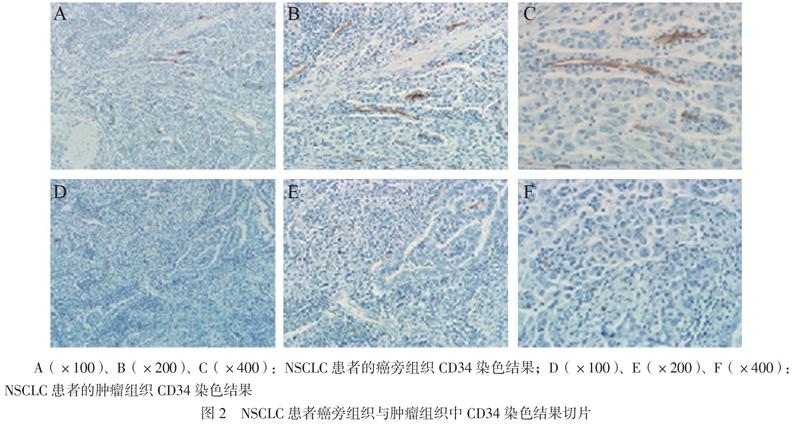
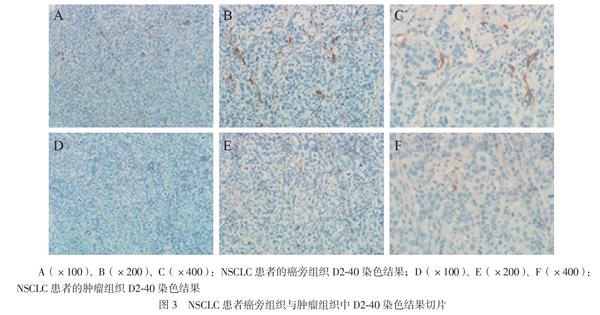
肿瘤浸润边缘的 MVD和LVD最多,并且两者密度高的病例容易出现脉管内癌栓。癌旁组织中的MVD和LVD分别为45.1±19.7和42.5±15.6,高于肿瘤组织的30.4±11.2和21.6±12.3,组间比较差异均有统计学意义(t分别为6.185、6.242,P均< 0.001),见图2、3。
二、NSCLC患者癌旁组织IL-33低表达与高表达者的临床病理特征比较
与低表达IL-33者相比,NSCLC患者癌旁组织高表达IL-33者中低分化者、淋巴结转移、临床分期高者比例较高(P均< 0.05),见表1。
三、NSCLC患者癌旁组织中的IL-33表达强度与MVD和LVD关系
癌旁组织内IL-33表达强度与MVD有关(P < 0.05),与LVD无关(P > 0.05),见表2。
四、NSCLC患者OS和PFS的影响因素分析
单因素Cox回归分析显示,IL-33、年龄、临床分期、淋巴结转移状态、LVD、MVD的表达与NSCLC患者OS有关(P均< 0.05);IL-33、年龄、淋巴结转移状态、LVD、MVD的表达与NSCLC患者PFS有关(P均< 0.05)。将所有因素纳入进行多因素Cox回归分析,结果显示IL-33、淋巴结转移状态、临床分期与OS有关(P < 0.05),见表3;淋巴结转移、临床分期与PFS有关(P均< 0.05),见表4。IL-33高表达及淋巴结有转移患者的OS及PFS均低于IL-33低表达及淋巴结无转移患者(P均< 0.05),见图4。
讨论
IL-33存在于多种肿瘤组织间质以及肿瘤患者的血清中,其表达呈现多样化的表现。IL-33在结直肠癌的癌旁组织、乳腺癌血清以及NSCLC患者血清中均有表达升高的报道[12-14]。也有研究证明肝细胞癌的生长、转移与IL-33密切相关[15]。但在多发性骨髓瘤患者中,IL-33血清水平随着疾病分期的增高有降低的趋势[16]。在不同的研究中,肺癌患者与健康人群相比,血清中IL-33水平也是有高有低[17]。有研究表明,IL-33与ST2的结合可导致低转移Lewis肺癌细胞的程序化死亡,而高转移细胞并未表现此结果[18]。尽管如此,IL-33在肺癌组织中是否具有促进细胞的生长和转移的功能尚不能明确。
IL-33作为细胞内的核因子或细胞外的细胞因子驱动Th2相关细胞因子的产生。从其机制而言,IL-33通过与受体ST2和IL-1受体协同蛋白(IL-1RAcP)的结合,诱发细胞内MyD88适配器蛋白质的招募,激活IL受体相关激酶1(IRAK1)/IRAK4通路,导致核因子-κB(NF-κB)核易位和细胞外调节蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38丝裂原活化蛋白激酶(MAPK)通路的激活,从而调节NF-κB和AP-1转录因
子[19-20]。最近的研究显示,IL-33是肿瘤进展中的重要效应因子[21]。另外一种机制研究显示,IL-33/ST2通路上调了肺癌细胞膜葡萄糖转运蛋白1(GLUT1),提高葡萄糖摄取和糖酵解。因此,当IL-33/ST2通路被阻断后,干扰了GLUT1的表达,抑制了肺癌细胞中葡萄糖摄取和糖酵解,从而减少了IL-33诱导的肺癌的生长和转移[22]。有学者用小鼠肺癌转移模型得出,转基因高表达IL-33进行可以减少肿瘤的转移,导入重组的IL-33可以增加肿瘤部位CD8+ T细胞和自然杀伤细胞的浸润,并能增加CD8+ T细胞的细胞毒作用[23]。人肺癌组织中 IL-33是否也通過增加免疫细胞浸润增强抗肿瘤效应,这一点还需进一步探究。
本研究显示,NSCLC患者的癌旁组织IL-33蛋白免疫组化评分高于肿瘤组织,与既往报道相符[24]。IL-33在癌旁组织中表达的差异性提示其在肿瘤微环境中可能具有特殊的作用,现已明确IL-33存在于各种各样的肿瘤组织间质以及肿瘤患者的血清中,其表达呈现多样化的表现;而且多项研究均发现间质(癌旁组织)内IL-33的表达情况与多种恶性肿瘤的生长、转移密切相关。因此,本研究重点偏向于癌旁组织内的IL-33,探讨肿瘤微环境对肿瘤患者预后的影响。进一步研究显示,与低表达IL-33者相比,NSCLC患者癌旁组织高表达IL-33者中低分化者、淋巴结转移、临床分期高者比例较高。由此可见,NSCLC患者癌旁组织中IL-33的高表达与肿瘤恶性程度有关。
MVD标记物CD34为105 ~ 120 kD的跨膜细胞表面糖蛋白,通常选择性地在造血干/祖细胞和血管内皮细胞上表达。LVD标记物D2-40是一种唾液酸糖蛋白,与淋巴管内皮上的黏液性跨膜糖蛋白特异性结合。本研究显示,NSCLC患者癌旁组织中MVD和LVD均高于肿瘤组织,而且其IL-33表达与MVD有关,提示IL-33与NSCLC的肿瘤微血管生成有一定关系。
本研究的Cox生存分析显示,癌旁组织IL-33、淋巴结转移状态、临床分期与OS有关,淋巴结转移、临床分期与PFS有关,癌旁组织IL-33高表达及淋巴结有转移患者的OS及PFS均低于IL-33低表达及淋巴结无转移患者。结果提示,NSCLC癌旁组织高表达IL-33是NSCLC患者不良预后的重要影响因素。IL-33在肺癌组织中不表达或者表达弱阳性,但在癌旁组织中呈现阳性表达。其原因有可能是高表达于癌旁组织血管内皮细胞的IL-33作为一种“警报素”,从受损的组织细胞中释放出来,以自分泌和旁分泌的方式,在Th2型先天性免疫中扮演着重要的角色,但由于复杂的肿瘤免疫逃逸机制,随着肿瘤的进展,肿瘤组织中IL-33的表达水平逐渐下调。也有一种可能为IL-33高表达于一些非免疫细胞,例如血管内皮细胞,当肿瘤组织发生发展时,癌旁组织受压、损伤,促进了内皮细胞释放IL-33,并作为“警报素”引发免疫。但其具体的作用机制还不确切,需要我们进一步探讨。这也有可能为NSCLC患者的预后评估及治疗的重要靶点提供了新思路。
日后我們将进一步扩大样本量验证本研究结果,判断IL-33对NSCLC患者的预后价值,并拟构建IL-33过表达载体,转染肺癌组织细胞株,进一步检测IL-33对MVD、LVD的影响,研究其对肺癌组织发生、发展、转移、坏死等影响,更进一步探究其相关机制。
参 考 文 献
[1] Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin, 2015, 65(2):87-108.
[2] 张学培,李建国. COPD对非小细胞肺癌临床特点及病理类型的影响. 新医学,2019, 50(5):374-379.
[3] Chen L, Chen M, Han Z, Jiang F, Xu C, Qin Y, Ding N, Liu Y, Zhang T, An Z, Guo C. Clinical significance of FAP-α on microvessel and lymphatic vessel density in lung squamous cell carcinoma. J Clin Pathol, 2018, 71(8):721-728.
[4] Ohta S, Tago K, Funakoshi-Tago M, Matsugi J, Yanagisawa K. Intracellular NF-HEV/IL-33 harbors essential roles in Ras-induced cellular transformation by contributing to cyclin D1 protein synthesis. Cell Signal, 2016, 28(8):1025-1036.
[5] Kakkar R, Hei H, Dobner S, Lee RT. Interleukin 33 as a mechanically responsive cytokine secreted by living cells. J Biol Chem, 2012, 287(9):6941-6948.
[6] Yazdani HO, Chen HW, Tohme S, Tai S, van der Windt DJ, Loughran P, Rosborough BR, Sud V, Beer-Stolz D, Turnquist HR, Tsung A, Huang H. IL-33 exacerbates liver sterile inflammation by amplifying neutrophil extracellular trap formation. J Hepatol, 2018, 68(1): 130-139.
[7] Imai J, Kitamoto S, Sugihara K, Nagao-Kitamoto H, Hayashi A, Morhardt TL, Kuffa P, Higgins PDR, Barnich N, Kamada N. Flagellin-mediated activation of IL-33-ST2 signaling by a pathobiont promotes intestinal fibrosis. Mucosal Immunol, 2019, 12(3):632-643.
[8] Vasanthakumar A, Kallies A. Interleukin (IL)-33 and the IL-1 family of cytokines-regulators of inflammation and tissue homeostasis. Cold Spring Harb Perspect Biol, 2019, 11(3): a028506.
[9] Cayrol C, Girard JP. Interleukin-33 (IL-33): a nuclear cytokine from the IL-1 family. Immunol Rev, 2018, 281(1):154-168.
[10] Yang M, Feng Y, Yue C, Xu B, Chen L, Jiang J, Lu B, Zhu Y. Lower expression level of IL-33 is associated with poor prognosis of pulmonary adenocarcinoma. PLoS One, 2018,13(3): e0193428.
[11] Chaudhri VK, Salzler GG, Dick SA, Buckman MS, Sordella R, Karoly ED, Mohney R, Stiles BM, Elemento O, Altorki NK, McGraw TE. Metabolic alterations in lung cancer-associated fibroblasts correlated with increased glycolytic metabolism of the tumor. Mol Cancer Res, 2013, 11(6):579-592.
[12] Bousseau S, Vergori L, Soleti R, Lenaers G, Martinez MC, Andriantsitohaina R. Glycosylation as new pharmacological strategies for diseases associated with excessive angiogenesis. Pharmacol Ther, 2018, 191:92-122.
[13] Liu X, Zhu L, Lu X, Bian H, Wu X, Yang W, Qin Q. IL-33/ST2 pathway contributes to metastasis of human colorectal cancer. Biochem Biophys Res Commun, 2014, 453(3):486-92.
[14] Lu DP, Zhou XY, Yao LT, Liu CG, Ma W, Jin F, Wu YF. Serum soluble ST2 is associated with ER-positive breast cancer. BMC Cancer, 2014, 14:198.
[15] Am?r NG, de Oliveira CE, Gasparoto TH, Vilas Boas VG, Perri G, Kaneno R, Lara VS, Garlet GP, da Silva JS, Martins GA, Hogaboam C, Cavassani KA, Campanelli AP. ST2/IL-33 signaling promotes malignant development of experimental squamous cell carcinoma by decreasing NK cells cytotoxicity and modulating the intratumoral cell infiltrate. Oncotarget, 2018, 9(56):30894-30904.
[16] Jin Z, Lei L, Lin D, Liu Y, Song Y, Gong H, Zhu Y, Mei Y, Hu B, Wu Y, Zhang G, Liu H. IL-33 released in the liver inhibits tumor growth via promotion of CD4+ and CD8+ T cell responses in hepatocellular carcinoma. J Immunol, 2018, 201(12):3770-3779.
[17] Koster R, Panagiotou OA, Wheeler WA, Karlins E, Gastier-Foster JM, Caminada de Toledo SR, Petrilli AS, Flanagan AM, Tirabosco R, Andrulis IL, Wunder JS, Gokgoz N, Pati?o-Garcia A, Lecanda F, Serra M, Hattinger C, Picci P, Scotlandi K, Thomas DM, Ballinger ML, Gorlick R, Barkauskas DA, Spector LG, Tucker M, Belynda DH, Yeager M, Hoover RN, Wacholder S, Chanock SJ, Savage SA, Mirabello L. Genome-wide association study identifies the GLDC/IL33 locus associated with survival of osteosarcoma patients. Int J Cancer, 2018, 142(8):1594-1601.
[18] Babadi AS, Kiani A, Mortaz E, Taghavi K, Khosravi A, Marjani M, Seifi S, Emami H, Abedini A. Serum interleukin-27 level in different clinical stages of lung cancer. Open Access Maced J Med Sci, 2019, 7(1):45-49.
[19] Akimoto M, Hayashi JI, Nakae S, Saito H, Takenaga K. Interleukin-33 enhances programmed oncosis of ST2L-positive low-metastatic cells in the tumour microenvironment of lung cancer. Cell Death Dis, 2016 , 7(1):e2057.
[20] Zhang X, Wang C, Shan S, Liu X, Jiang Z, Ren T. TLR4/ROS/miRNA-21 pathway underlies lipopolysaccharide instructed primary tumor outgrowth in lung cancer patients. Oncotarget, 2016, 7(27):42172-42182.
[21] Hardman C, Ogg G. Interleukin-33, friend and foe in type-2 immune responses. Curr Opin Immunol, 2016, 42:16-24.
[22] Schwartz C, OGrady K, Lavelle EC, Fallon PG. Interleukin 33: an innate alarm for adaptive responses beyond Th2 immunity-emerging roles in obesity, intestinal inflammation, and cancer. Eur J Immunol, 2016, 46(5):1091-1100.
[23] Kim MS, Kim E, Heo JS, Bae DJ, Lee JU, Lee TH, Lee HJ, Chang HS, Park JS, Jang AS, Koh ES, Hwang HG, Lim G, Kim S, Park CS. Circulating IL-33 level is associated with the progression of lung cancer. Lung Cancer, 2015, 90(2):346-351.
[24] 馮悦华, 朱一蓓, 罗光华, 王志刚, 俞鹏翼, 郑亮.IL-33在人非小细胞肺癌组织中的表达及临床意义.细胞与分子免疫学杂志,2016,32(6):808-811.
(收稿日期:2019-10-15)
(本文编辑:林燕薇)
